松果菊苷对脓毒症小鼠急性肾损伤的保护作用及其机制
2021-05-20徐臣年王青艳李莎莎安艳新
李 露,徐臣年,杜 燕,王青艳,李莎莎,安艳新
(1 西安医学院第一附属医院肾内科,西安 710077;2 空军军医大学西京医院心血管外科;3 西安医学院第一附属医院普外科;*通讯作者,E-mail:liluxayxy@163.com)
脓毒症是由细菌感染引起的全身性炎症反应综合征,已经成为重症监护室(intensive care unit, ICU)患者死亡的主要原因[1]。在临床实践中,越来越多的研究表明,急性肾损伤(acute kidney injury, AKI)是ICU脓毒症患者常见且严重的并发症,占ICU中急性肾损伤病例的50%以上[2,3]。目前,对脓毒症急性肾损伤的机制研究取得了显著进展,其中,肾脏细胞功能障碍和凋亡、肾内血流动力学改变、肾脏炎性浸润和氧化应激损伤等多种因素共同作用是脓毒症患者多器官系统衰竭的主要原因[4],但至今对脓毒症急性肾损伤的治疗进展甚少。因此,探索一种新型、有效的脓毒症性器官衰竭辅助治疗药物具有重要意义。
松果菊苷(echinacoside, ECH)是从管花肉苁蓉中分离出的苯乙醇苷类化合物,以往研究已证实,松果菊苷具有抗氧化、抗炎症、抗衰老、抗肿瘤、神经保护及免疫调节等多重药理作用[5]。近年来研究发现,松果菊苷在糖尿病肾病的治疗中也发挥了积极的作用[6-9]。此外,一项体外研究也报道,松果菊苷可以改善脓毒症大鼠的肝损伤[10]。但松果菊苷能否减轻脓毒症小鼠急性肾损伤尚未见相关报道,因此,本研究采用盲肠结扎穿孔术构建脓毒症小鼠模型,旨在探讨松果菊苷对小鼠脓毒症急性肾损伤的影响,并探讨相应的分子机制,为临床应用提供理论基础和实验依据。
1 材料与方法
1.1 主要试剂和实验动物
清洁级雄性C57BL/6J小鼠40只,6周龄,由西安医学院动物实验中心提供。松果菊苷(echinacoside, ECH)购自美国sigma公司。白细胞介素-1β(interleukin-1β, IL-1β)、白细胞介素6(interleukin-6, IL-6)和肿瘤坏死因子α(tumor necrosis factor-α, TNF-α)ELISA试剂盒购自美国USCN life公司。超氧化物歧化酶(superoxide dismutase, SOD),丙二醛(malondialdehyde, MDA)和谷胱甘肽过氧化物酶(glutathione peroxidase, GSH-Px)检测试剂盒购自上海碧云天生物技术有限公司。二氢乙锭(dihydroethidium, DHE)超氧化物阴离子荧光检测探针购自美国ThermoFisher公司。脱氧核糖核苷酸末端转移酶介导的缺口末端标记法(terminal-deoxynucleotidyl transferase mediated nick end labeling, TUNEL)检测试剂盒购自美国Roche公司。兔抗小鼠核因子κB(nuclear factor kappa-B, NF-κB)抗体、anti-SIRT3、anti-Ac-SOD2、anti-SOD2、anti-cleaved Caspase 3和anti-β-actin抗体抗体购自美国Abcam公司。
1.2 实验方法
1.2.1 动物模型建立及处理 将40只雄性C57BL/6J小鼠随机分为4组:假手术组(sham组)、松果菊苷组(ECH组)、模型组(CLP组)和造模+松果菊苷处理组(ECH+CLP组),每组10只。
采用经典的盲肠结扎穿孔术构建脓毒症小鼠模型[11,12]。具体操作步骤如下:术前所有小鼠禁食12 h,经腹腔注射戊巴比妥钠(50 mg/kg)麻醉后置于无菌操作台上,腹正中线纵行作一长约1 cm切口,逐层分离并暴露盲肠,于距盲肠末端进行环形结扎,采用18G无菌穿刺针贯穿盲肠1次,并轻挤压出少量肠内容物,随后盲肠还纳入腹腔,逐层缝合关闭腹腔。sham组和ECH组小鼠仅打开腹腔暴露盲肠,但不进行结扎和穿刺。术后即刻,小鼠背部皮下注射0.5 ml生理盐水抗休克。ECH组和ECH+CLP组小鼠术后腹腔注射松果菊苷(100 mg/kg)进行治疗。sham组和CLP组小鼠术后给予腹腔注射等体积生理盐水。
1.2.2 肾脏苏木精-伊红(HE)染色 术后24 h,麻醉处死小鼠,取各组小鼠肾组织标本经4%的多聚甲醛固定及石蜡包埋后,制成5 μm厚的肾脏切片,HE染色,光学显微镜下观察肾组织的病理改变,并行形态学评价,采用半定量量表对肾脏损伤进行评分。
1.2.3 肾功能指标测定 术后24 h,采用眼球摘除法收集小鼠血样,离心分离取上清液,采用全自动生化分析仪测定小鼠血清中尿素氮(blood urea nitrogen, BUN)和血肌酐(serum creatinine, Scr)的水平,剩余血清于-80℃低温冰箱保存待用。
1.2.4 肾组织炎性因子水平测定 术后24 h,麻醉处死小鼠,取各组小鼠肾组织标本经PBS洗涤干净后制备成组织匀浆,按照ELISA试剂盒说明书将标准品稀释并依次加入待测样品和生物素标记的IL-1β、IL-6、TNF-α抗体,待反应终止后,用酶标仪测定各孔在450 nm处的吸光度值,通过绘制标准曲线计算小鼠血清中IL-1β、IL-6和TNF-α的水平。
1.2.5 肾组织NF-κB荧光染色 取前述制备成功的肾组织石蜡切片,经脱蜡复水操作和PBS液洗涤后,滴加100 μl兔抗小鼠NF-κB抗体,4 ℃过夜孵育,DAPI复染细胞核后封片,每张切片随机取5个高倍视野观察并拍照,用Image J软件分析各组NF-κB在肾组织中的荧光表达情况。
1.2.6 肾组织氧化应激水平测定 术后24 h,麻醉处死小鼠,取各组小鼠肾组织标本经PBS洗涤干净后制备成组织匀浆,按照试剂盒说明书检测组织匀浆中MDA的含量以及SOD和GSH-Px的活性,以此来评价各组小鼠肾组织的氧化应激情况。
术后24 h,麻醉处死小鼠,取各组小鼠肾组织标本并冻于液氮内,制备厚度为5 μm的肾组织冰冻切片。严格按照试剂盒说明书对组织切片进行二氢乙锭染色,每张切片随机取5个高倍视野观察并拍照。用Image J软件分析各组小鼠肾组织ROS的生成量。
1.2.7 肾组织细胞凋亡检测 取前述制备成功的肾组织石蜡切片,经脱蜡复水操作和PBS液洗涤后,按照TUNEL凋亡检测试剂盒说明书测定肾组织细胞凋亡情况。每张切片随机取5个高倍视野观察并拍照,蓝色荧光代表所有细胞核,绿色荧光代表凋亡细胞核。细胞凋亡指数以凋亡细胞核数/计数的细胞核总数×100%。
1.2.8 Western blot检测SIRT3、SOD2、cleaved Caspase 3蛋白表达水平 术后24 h,麻醉处死小鼠,取各组小鼠肾组织标本经细胞裂解液提取总蛋白,采用BCA法进行蛋白定量。各组组织蛋白(40 μg)依次进行10% SDS-PAGE凝胶电泳分离,湿转法转移至PVDF膜上。经5%的脱脂牛奶室温下封闭2 h后,PVDF膜在SIRT3(1 ∶1 000)、Ac-SOD2(1 ∶1 000)、SOD2(1 ∶1 000)、cleaved Caspase 3(1 ∶1 000)和β-actin(1 ∶3 000)的一抗体管中4 ℃孵育过夜。TBST液洗涤3次,接着加入对应的辣根过氧化物酶偶联的二抗管中室温孵育1 h,滴加ECL发光液并通过Bio-Rad系统成像,以β-actin作为内参,Image Lab软件分析结果。
1.3 统计学分析
用SPSS 22.0程序对实验数据进行统计分析,实验结果以均数±标准差表示,通过单因素方差分析(ANOVA)和LSD-t检验对组间进行比较。以P<0.05表示差异有统计学意义。
2 结果
2.1 各组小鼠的肾组织结构及肾功能比较
小鼠肾组织HE染色结果显示,sham组和ECH组小鼠肾组织结构完整,未见炎性细胞浸润,肾小管上皮细胞无肿胀;CLP组小鼠肾组织可见肾小管肿胀和上皮变性坏死,并伴有大量炎性细胞浸润,肾间质充血严重,肾组织损伤评分明显升高;给予松果菊苷处理后,ECH+CLP组小鼠肾小管肿胀及上皮细胞坏死明显减轻,炎性细胞浸润明显减少,肾间质充血情况显著好转,肾组织损伤评分显著降低(见图1)。
生化分析检测小鼠肾功能指标显示,与sham组相比,CLP组小鼠的BUN和Scr水平均明显升高(P<0.05);给予松果菊苷处理后,与CLP组相比,ECH+CLP组小鼠的BUN和Scr均显著降低(P<0.05);而单纯给予松果菊苷处理对小鼠的肾功能无明显影响(P>0.05,见图1)。

与sham组相比,* P <0.05,* * P <0.01;与CLP组相比,##P <0.01图1 各组小鼠的肾组织HE染色及肾功能指标比较 (×400)Figure 1 HE staining of renal tissue and renal function in each group (×400)
2.2 各组小鼠肾组织炎症反应水平比较
ELISA法检测小鼠肾组织炎症因子水平显示,与sham组相比,CLP组小鼠肾组织中炎症因子IL-1β、IL-6和TNF-α的含量显著增加(P<0.05);给予松果菊苷处理后,与CLP组相比,ECH+CLP组小鼠肾组织中炎症因子IL-1β、IL-6和TNF-α的含量明显降低(P<0.05);而单纯给予松果菊苷处理对小鼠肾组织炎症因子水平无明显影响(P>0.05,见图2A)。免疫荧光染色检测小鼠肾组织NF-κB表达情况并观察其亚细胞定位显示,与sham组相比,CLP组小鼠肾组织中NF-κB表达量显著增加(P<0.05),且多表达于肾小球内;给予松果菊苷处理后,与CLP组相比,ECH+CLP组小鼠肾组织中NF-κB表达量明显降低(P<0.05)。而单纯给予松果菊苷处理对小鼠肾组织NF-κB的表达无明显影响(P>0.05,见图2B)。

与sham组相比,* P <0.05,* * P <0.01;与CLP组相比,##P <0.01图2 各组小鼠肾组织炎症反应水平比较Figure 2 Comparison of inflammatory response levels in renal tissue between groups
2.3 各组小鼠肾组织氧化应激水平比较
试剂盒检测小鼠肾组织氧化应激水平显示,与sham组相比,CLP组小鼠肾组织中抗氧化物SOD和GSH-Px的含量显著减低,膜脂过氧化产物MDA含量显著增加(P<0.05);给予松果菊苷处理后,与CLP组相比,ECH+CLP组小鼠肾组织中抗氧化物SOD和GSH-Px的含量显著升高,膜脂过氧化产物MDA含量显著减少(P<0.05);而单纯给予松果菊苷处理对小鼠肾组织上述指标无明显影响(P>0.05,见图3A)。荧光探针检测小鼠肾组织ROS生成情况显示,与sham组相比,CLP组小鼠肾组织中ROS生成量显著增加(P<0.05);给予松果菊苷处理后,与CLP组相比,ECH+CLP组小鼠肾组织中ROS的产生明显被抑制(P<0.05);而单纯给予松果菊苷处理对小鼠肾组织ROS的生成无明显影响(P>0.05,见图3B)。
2.4 各组小鼠肾组织凋亡水平及SIRT3信号表达比较
TUNEL染色检测小鼠肾组织凋亡情况显示,与sham组相比,CLP组小鼠肾组织凋亡细胞明显增加,且凋亡相关蛋白cleaved Caspase 3表达明显增加(P<0.05);给予松果菊苷处理后,与CLP组相比,ECH+CLP组小鼠肾组织细胞凋亡明显被抑制(P<0.05)。而单纯给予松果菊苷处理对小鼠肾组织凋亡情况无明显影响(P>0.05,见图4)。
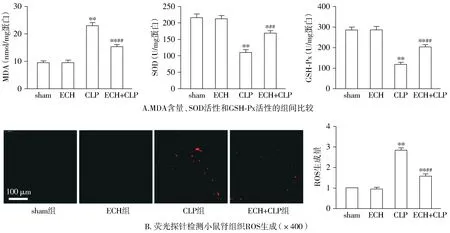
与sham组相比,* P <0.05,* * P <0.01;与CLP组相比,##P <0.01图3 各组小鼠肾组织氧化应激水平比较Figure 3 Comparison of renal oxidative stress level between groups

与sham组相比,* P <0.05,* * P <0.01;与CLP组相比,##P <0.01图4 各组小鼠肾组织凋亡水平比较Figure 4 Comparison of apoptosis level in renal tissue between groups
信号通路蛋白检测显示,与sham组相比,CLP组小鼠肾组织中SIRT3蛋白表达显著减低,SOD2乙酰化程度显著增加(P<0.05);给予松果菊苷处理后,与CLP组相比,ECH+CLP组小鼠肾组织中SIRT3蛋白表达显著升高,SOD2乙酰化程度显著降低(P<0.05);而单纯给予松果菊苷处理对小鼠肾组织SIRT3信号通路的表达无明显影响(P>0.05,图5)。

与sham组相比,* P <0.05,* * P <0.01;与CLP组相比,##P <0.01图5 各组小鼠肾组织SIRT3信号表达比较Figure 5 Comparison of SIRT3 signal expression in renal tissue between groups
3 讨论
脓毒症是一种因免疫系统对感染的反应失调而导致的危及生命的疾病,涉及多器官功能障碍[13]。在脓毒症患者中,急性肾损伤具有较高的发病率,且脓毒症诱发的急性肾损伤被视为与患者死亡率增加和慢性肾病进展加剧相关的一个公共卫生问题[14]。因此,寻找脓毒症急性肾损伤的有效治疗策略对于改善脓毒症患者的预后迫在眉睫。
近年来多项研究显示,一种来源于松果菊属植物根茎的苯乙醇苷类化合物松果菊苷,在肾脏相关疾病中发挥了重要的保护作用。姜瑞凤等[15]报道,松果菊苷对四氯化碳诱导大鼠急性肾损伤起保护作用,相关机制可能与松果菊苷抑制细胞凋亡、抑制炎症产生和抑制TLR4/NF-κB通路有关。并且松果菊苷可通过抑制TGF-β1的表达,抑制肾间质纤维化和肾组织细胞凋亡,从而保护糖尿病肾病大鼠的肾组织,改善肾功能,延缓糖尿病肾病的发展[6-9]。此外,兰戴天等[10]发现,松果菊苷可以显著改善脓毒症大鼠的肝损伤和炎症反应。然而,松果菊苷能否减轻脓毒症急性肾损伤还不明确。本研究中,我们发现,与CLP组相比,ECH+CLP组小鼠肾小管肿胀及上皮细胞坏死明显减轻,炎性细胞浸润明显减少,肾间质充血情况显著好转,肾组织损伤评分显著降低;并且ECH+CLP组小鼠的BUN和Scr均显著降低。以上结果提示,松果菊苷可明显抑制脓毒症引起的急性肾损伤。
实验模型和临床研究的证据均支持炎症反应、氧化应激损伤肾组织细胞凋亡在脓毒症急性肾损伤发生发展过程中的关键作用[16,17]。脓毒症患者组织细胞损伤释放相关的炎症介质,通过激活免疫细胞,可进一步导致远端器官(如肾脏)的炎症反应,且炎症因子在脓毒症后期的多器官功能衰竭中起关键作用[18]。同时,NF-κB被认为是炎症反应的上游调节因子,一旦被激活,可调节多种炎症因子的生成和释放,进而恶化组织损伤。此外,大量研究也表明,ROS的生成可诱导肾小管上皮细胞损伤,并且在脓毒症致急性肾损伤的动物模型中,血清内源性ROS清除物(如超氧化物歧化酶等)的浓度显著降低,而给予ROS清除剂则可明显降低模型动物的死亡率并改善其肾功能不全[19]。因而,开发高效的抗炎与抗氧化治疗方法或药物对减轻脓毒症患者急性肾损伤具有重要的临床意义。
大量研究报道松果菊苷在抗氧化和抗炎方面具有巨大的潜力。松果菊苷可以通过调节体内氧化与抗氧化反应的平衡来保护机体免受氧化应激损伤,且在多种组织器官的损伤模型中得到了验证[5,20,21]。值得注意的是,松果菊苷在内毒素诱导的急性肝损伤和肠上皮细胞损伤中均表现出了显著的抗炎作用[10,22]。在本研究中,我们同样观察到,与CLP组相比,ECH+CLP组小鼠肾组织中炎症因子IL-1β、IL-6和TNF-α的含量明显降低,肾组织中NF-κB表达量明显下降;并且ECH+CLP组小鼠肾组织中抗氧化物SOD和GSH-Px的含量显著升高,膜脂过氧化产物MDA含量显著减少,肾组织中ROS的产生明显被抑制。同时,ECH+CLP组小鼠肾组织细胞凋亡明显减低。以上结果提示,松果菊苷可通过抑制氧化应激损伤、炎症反应和凋亡抵抗脓毒症引起的急性肾损伤。
Sirtuins蛋白是一类进化上保守的烟酰胺腺嘌呤二核苷酸(nicotinamide adenine dinucleotide, NAD+)依赖的组蛋白去乙酰化酶,参与细胞脂质代谢、自噬、细胞凋亡、炎性反应、氧化应激、纤维化及线粒体内稳态等多种细胞功能活动[23]。其中,沉默信息调控因子3(silent information regulator 3, SIRT3)是线粒体内最主要的去乙酰化酶,广泛分布于肾脏近端及远端肾小管细胞[24]。近些年来,SIRT3已被证实具有重要的肾脏保护作用,在急性肾损伤、糖尿病肾病、高血压性肾损害及肾脏衰老等多种肾脏疾病中均表现出了积极的保护效应[25]。特别值得注意的是,最新证据显示,激活SIRT3可明显缓解脓毒症导致的急性肾损伤[26],然而SIRT3能否介导松果菊苷减轻脓毒症急性肾损伤仍有待于进一步探究。本研究结果进一步证实,与sham组相比,CLP组小鼠肾组织中SIRT3蛋白表达显著减低,SOD2乙酰化程度显著增加;给予松果菊苷处理后,与CLP组相比,ECH+CLP组小鼠肾组织中SIRT3蛋白表达显著升高,SOD2乙酰化程度显著降低。以上结果提示,激活SIRT3信号通路可能是松果菊苷减轻脓毒症急性肾损伤的潜在分子机制。
综上所述,松果菊苷可能是通过激活SIRT3信号通路抑制氧化应激损伤和炎症反应,从而减轻了脓毒症小鼠急性肾损伤。我们的研究为临床上应用松果菊苷治疗脓毒症患者肾脏损伤提供了新的理论依据。
