内质网应激在同型半胱氨酸调控巨噬细胞向泡沫细胞转化中的作用
2021-05-20樊贝贝张晓东张艳涛孙梦娜曾广伟
李 炜,刘 静,郭 丽,廉 诚,高 钊,樊贝贝,张晓东,靳 强,张艳涛,孙梦娜,曾广伟*
(1 西安国际医学中心医院心脏病医院心脏内科,西安 710100;2 空军军医大学第二附属医院心脏内科;3 空军军医大学第一附属医院老年科;*通讯作者,E-mail:zengguangwei1026@163.com)
巨噬细胞作为重要的免疫细胞,能分泌大量的炎性因子,在动脉粥样硬化的发生发展中起关键作用。巨噬细胞主要参与Th1细胞介导的炎症反应,在释放的多种炎症因子和趋化因子作用下,吞噬大量脂质,形成泡沫细胞,并在动脉内膜聚集[1]。泡沫细胞的形成是动脉粥样硬化病变发生早期的标志性事件[2]。内皮细胞也可以分化为平滑肌样细胞,这些细胞可能参与并促进动脉粥样硬化性血管重塑[3]。此外,血管平滑肌细胞可分化为巨噬细胞,在脂质摄取后形成泡沫细胞[4]。
同型半胱氨酸(homocysteine, Hcy)是心血管疾病的独立危险因素,能通过多种炎症因子促进动脉粥样硬化的发生发展。实验动物模型和临床研究均表明内质网应激(endoplasmic reticulum stress, ERS)主要参与了动脉粥样硬化晚期斑块的发展过程[5],但在早期泡沫细胞形成中的作用还有待阐明。巨噬细胞、血管内皮细胞和平滑肌细胞在动脉粥样硬化时其ERS相关蛋白的表达增高,最终导致细胞凋亡[6]。然而,ERS在Hcy加重氧化低密度脂蛋白(oxidized low density lipoprotein, oxLDL)诱导巨噬细胞向泡沫细胞转化中的作用还不清楚。本研究采用Thp-1细胞源性巨噬细胞,观察ERS在同型半胱氨酸加重oxLDL诱导巨噬细胞向泡沫细胞转化中的作用。
1 材料与方法
1.1 主要试剂
RPMI-1640培养基购自美国Gibco技术公司;苏木素购自南京建成生物科技公司;佛波酯(PMA)购自美国Sigma公司;胆固醇定量试剂盒购于美国Biovision公司;BCA蛋白定量试剂盒购于西安晶彩生物科技有限公司;NEAA细胞培养添加物购于赛业生物技术公司;油红O染液购自南京建成生物科技公司;人oxLDL-c购自广州奕源生物科技公司。GRP78和GRP94抗体购于Abcam公司;山羊抗鼠及山羊抗兔抗体购于西安中杉生物科技有限公司。
1.2 细胞培养和传代
将购买的Thp-1细胞复苏,用含有Gluta-MAX、1% NEAA和10% FBS的RPMI-1640培养基,并置于37 ℃、5% CO2的恒温孵箱中培养。根据细胞生长情况定期换液。细胞静置12 h,将多余的培养基吸出弃掉后,吸入离心管中常温下1 000g离心5 min后弃去上清并加入培养基重悬,分别种入不同的培养瓶中。
1.3 实验分组
Thp-1细胞是人白血病细胞来源的单核细胞系,经PMA诱导后可分化为巨噬细胞。为了观察Hcy调控巨噬细胞向泡沫细胞转化以及探讨ERS在其中发挥的作用,将密度合适的Thp-1细胞被随机分为:对照组(control)、oxLDL组、Hcy+oxLDL组和4-PBA组。control组细胞在正常培养基中培养;oxLDL组细胞在培养基中加入50 μg/ml oxLDL-c和Thp-1细胞共培养;Hcy+oxLDL组细胞培养基中加入50 μg/ml oxLDL-c和100 μmol/L Hcy和Thp-1细胞共培养;4-PBA组细胞先用5 mmol/L4-PBA处理细胞30 min,再与50 μg/ml oxLDL-c和100 μmol/L Hcy共培养。采用油红O染色检测脂质沉积,ELISA试剂盒检测胆固醇含量,RT-PCR检测GRP78和GRP94的mRNA水平,Western blot检测GRP78和GRP94蛋白表达的变化。
1.4 巨噬细胞脂质染色
Thp-1来源的巨噬细胞贴壁生长后,用预冷的PBS洗涤细胞2次,4%多聚甲醛固定10 min,用60%的异丙醇洗涤细胞2次,加入配制好的油红进行染色,室温下染色1 min,用60%的异丙醇洗涤细胞2次,每次10 s,再用PBS洗涤细胞2次,每次10 s,苏木素复染细胞核,室温下处理30 s,用PBS洗涤细胞3次,置于倒置显微镜下观察并拍照。
1.5 巨噬细胞胆固醇含量测定
采用高效液相色谱法(HPLC)测定Thp-1来源的巨噬细胞内胆固醇含量。方法如下:将培养基倒掉后,加入PBS轻轻吹打细胞,使贴壁的细胞重新悬浮后,使用超声将细胞破碎。使用BCA蛋白定量试剂盒对蛋白定量后,按照说明进行操作:每组样本取200 μl和浓度为15%的KOH/乙醇2 ml进行混合,置于70 ℃水浴锅中反应1 h后,迅速降至室温,加入双蒸水1 ml后,再加入正己烷2.4 ml,异丙醇0.6 ml,振荡器上震荡10 min充分混匀后,3 500g离心5 min后去上清,用40 ℃氮气干燥12 h。所得固体加入100 μl甲醇溶解,震荡混匀后用波长为216 nmol/L进行检测。
1.6 RT-PCR检测GRP78和GRP94的mRNA水平
用RNA分离试剂盒分离总RNA,并使用Revert-Aid First Strand cDNA Synthesis Kit合成第一链cDNA。用Maxima SYBR Green qPCR Master Mix进行qPCR扩增反应。以下引物(购于中国上海)用于RT-PCR:GRP78正义链5′-GATTGGACAAGAGAGAGGGTGA -3′,反义链5′-CCATAACACGCTGGTCAAAGTC-3′;GRP9正义链5′-CAGTTGGATGGGTTAAACGCA-3′,反义链5′-TTCCAGCGAGTGCATTTTCAT-3′;GAPDH正义链5′-TGTGTCCGTCGTGGATCTGA-3′,反义链5′-TTGCTGTTGAAGTCGCAGGAG-3′。GAPDH作为内参对照。使用ΔΔCt方法进行相对定量。
1.7 Western blot检测大鼠主动脉血管中GRP78和GRP94的表达
将血管放入EP管中,加入RIPA裂解液并用眼科剪在冰上剪碎裂解30 min,4 ℃,12 000g离心10 min,取上清液并加入上样缓冲液,沸水煮10 min,分装并冻存于-80 ℃冰箱;10% SDS-PAGE胶每孔上样20 μg,恒压100 V电泳90 min,恒压90 V湿转2 h将蛋白转移至硝酸纤维素膜,将膜放入5%脱脂奶粉中室温封闭2 h,将膜放入GRP78(1 ∶1 000)和GRP94(1 ∶1 000)一抗中4 ℃孵育过夜;TBST洗膜3次,每次10 min,将膜和相应二抗室温孵育2 h,TBST洗膜3次,每次10 min,ECL化学发光,Image图像分析软件分析条带灰度。
1.8 统计学处理
2 结果
2.1 PMA诱导Thp-1细胞分化为M2巨噬细胞
正常Thp-1细胞大多呈圆球形,在培养基中悬浮生长,部分细胞可以聚集在一起形成葡萄样;加入200 nmol/L的PMA 12 h后,光学显微镜下观察可见细胞由悬浮转为贴壁生长,细胞形态由圆球形变为多角梭形或不规则形,部分伸出伪足(见图1)。CD163是巨噬细胞的标志物,提取悬浮生长的Thp-1细胞和分化后贴壁生长细胞mRNA后,RT-PCR方法检测其表达,观察到贴壁生长的细胞CD163表达明显高于悬浮细胞(P<0.05,见图1),这些结果表明PMA诱导Thp-1细胞分化为巨噬细胞。

图1 Thp-1细胞分化为M2巨噬细胞 (×200)Figure 1 THP-1 cells differentiate into M2 macrophages (×200)
2.2 Hcy加剧M2型巨噬细胞分化为泡沫细胞
经油红O和苏木素染色后,光学显微镜下可以观察到,control组细胞内少量颗粒状脂质沉积,加入oxLDL-c的细胞内有部分颗粒状脂质沉积,而加入oxLDL-c和Hcy处理的巨噬细胞可见大量红色颗粒样脂质沉积(见图2)。oxLDL+Hcy组巨噬细胞转化为泡沫细胞阳性率明显高于oxLDL组(见图2)。这一结果提示Hcy可以明显促进巨噬细胞中的脂质积累并将其转化为泡沫细胞。

脂质被油红O和苏木素染色为红色颗粒;与control组对比,* P <0.05;与ox-LDL组相比,#P <0.05图2 光镜下Thp-1细胞来源巨噬细胞进行油红O和苏木素染色结果 (×200)Figure 2 Oil red O and hematoxylin staining of Thp-1 cell-derived macrophages under light microscope (×200)
2.3 Hcy增加巨噬细胞胆固醇含量
为了进一步证明Hcy对巨噬细胞脂质的累积作用,本实验采用HPLC法检测了胆固醇的含量。结果显示,与control组相比,oxLDL组巨噬细胞胆固醇含量明显升高(P<0.05);而与oxLDL组相比,Hcy+oxLDL组巨噬细胞胆固醇含量进一步增加(P<0.05,见图3)。
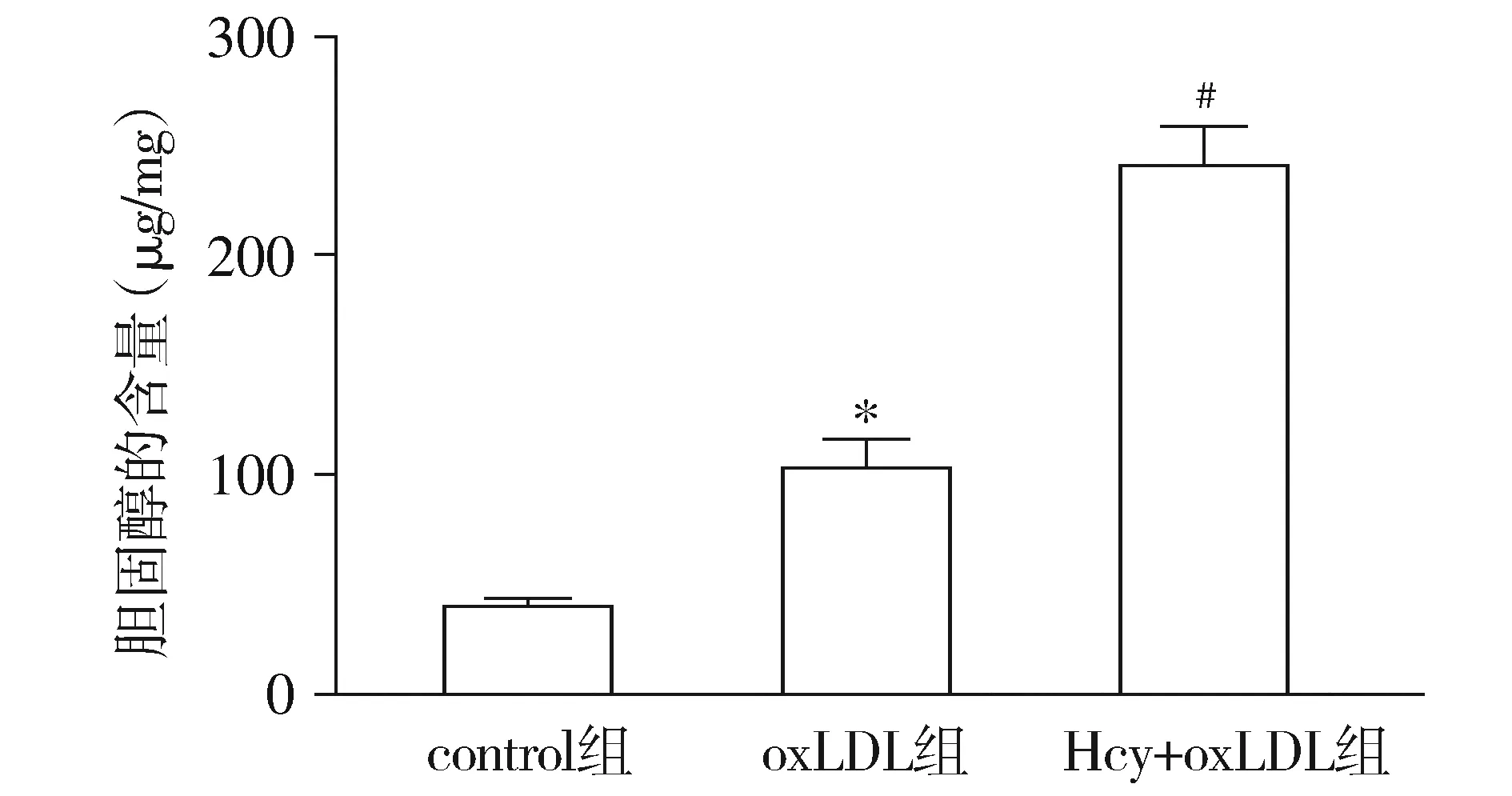
与control组相比,* P <0.05;与oxLDL组相比,#P <0.05图3 各组巨噬细胞胆固醇含量Figure 3 The cholesterol content of macrophages in each group
2.4 Hcy上调内质网应激标志物GRP78和GRP94的mRNA水平
与control组相比,oxLDL组巨噬细胞中GRP78和GRP94的mRNA水平升高(P<0.05);与oxLDL组比较,Hcy+oxLDL组巨噬细胞中GRP78和GRP94的mRNA水平进一步升高(P<0.05,见图4)。
2.5 Hcy上调GRP78和GRP94蛋白表达
除了mRNA水平外,本实验又采用Western blot检测了GRP78和GRP94蛋白水平的变化。Western blot结果显示,与control组相比,oxLDL组巨噬细胞中GRP78和GRP94蛋白表达升高,差异有统计学意义(P<0.05);与oxLDL组比较,Hcy+oxLDL组巨噬细胞中GRP78和GRP94的蛋白表达进一步升高,差异有统计学意义(P<0.05,见图5)。

与control组相比,* P <0.05;与oxLDL组相比,#P <0.05图4 Hcy对巨噬细胞内质网应激分子GRP78和GRP94 mRNA的表达的影响Figure 4 Effect of Hcy on mRNA levels of endoplasmic reticulum stress molecules GRP78 and GRP94 in macrophages

与control组相比,* P <0.05;与oxLDL组相比,#P <0.05图5 Hcy对巨噬细胞内质网应激分子GRP78和GRP94蛋白的表达的影响Figure 5 Effect of Hcy on protein expression of endoplasmic reticulum stress molecules GRP78 and GRP94 in macrophages
2.6 4-PBA抑制巨噬细胞摄取脂质
4-PBA是一种低分子量脂肪酸化合物,具有分子伴侣样活性,是一种特异的内质网应激抑制剂。油红O和苏木素染色结果显示:control组细胞内少量颗粒状脂质沉积;加入oxLDL-c和Hcy后细胞内可见大量颗粒样脂质沉积;4-PBA组的细胞脂质颗粒明显减少,只有部分颗粒状脂质沉积(见图6)。与control组相比,Hcy+oxLDL组巨噬细胞胆固醇含量升高(P<0.05),与Hcy+oxLDL组相比,4-PBA组巨噬细胞胆固醇含量降低(P<0.05,见图6)。

与control组相比,* P <0.05;与Hcy+oxLDL组相比,#P <0.05图6 4-PBA对细胞胆固醇蓄积的影响 (×200)Figure 6 Effect of 4-PBA on cholesterol accumulation (×200)
3 讨论
动脉粥样硬化斑块破裂导致的心脏急性缺血及脑栓塞是当前全球病死的首要原因[7]。单核细胞或巨噬细胞侵入血管内皮下聚集,并摄取脂质转化为泡沫细胞在动脉粥样硬化发生发展的过程中发挥了重要作用[8]。高同型半胱氨酸血症是动脉粥样硬化的独立危险因素[9]。然而,HHcy在脂质代谢紊乱中的具体机制还不清楚。本实验在细胞水平证实,单核细胞来源的M2巨噬细胞在Hcy的作用下经油红O和苏木素染色显示细胞内大量红色颗粒状物质,胆固醇含量测定证实胞质内蓄积了大量的胆固醇,说明Hcy可以诱导巨噬细胞转化为泡沫细胞,这可能是Hcy致血管损伤的机制之一,但是其影响巨噬细胞内胆固醇蓄积的机制还需要进一步阐明。
内质网是细胞内重要的细胞器,负责蛋白质折叠、翻译后修饰和分泌,以及膜蛋白的转运,维持细胞稳态[10]。当蛋白质折叠错误或未折叠蛋白质增多,引起未折叠蛋白反应,减少蛋白的合成,引起内质网应激。而GRP78和GRP94是内质网应激的标志性蛋白[11]。众所周知内质网应激参与多种疾病的发生发展过程,但在Hcy导致巨噬细胞转化为泡沫细胞过程中是否发挥作用还不清楚。在本实验中,我们观察到,Hcy组GRP78和GRP94表达明显高于oxLDL组,提示在泡沫细胞中发生了内质网应激。但是否影响巨噬细胞对胆固醇的摄取仍有待阐明。
为了进一步证实内质网应激调控巨噬细胞转化为泡沫细胞,我们应用了内质网应激抑制剂4-PBA。4-PBA是一种低分子量、无毒的脂肪酸,已被发现具有分子伴侣样活性,其理化性质可以稳定肽结构,减少ER应激过程中保留在细胞中的突变蛋白或未折叠蛋白的数量,并作为分子伴侣发挥抗炎作用,其被认为是一种特异的内质网应激抑制剂[12]。本实验观察到油红O和苏木素染色后对照组的细胞内少量颗粒状脂质沉积,加入oxLDL-c和Hcy作用的细胞染色见大量颗粒样脂质沉积,4-PBA组细胞脂质颗粒明显减少,只有部分颗粒状脂质沉积。与Hcy+oxLDL组相比,4-PBA组细胞胆固醇含量降低,说明抑制内质网应激可以减少巨噬细胞对脂质的摄取,进而阻止其转化为泡沫细胞,证实Hcy致血管损伤的机制之一是通过内质网应激途径调控巨噬细胞转化为泡沫细胞。已有研究表明,在同型半胱氨酸血症大鼠中,激活单核细胞趋化因子、血管细胞黏附分子和E-选择素可以引起单核细胞/巨噬细胞和动脉内皮细胞的黏附,增加动脉壁浸润,促进动脉粥样硬化的发展[13]。综合本实验在细胞水平的结果,我们猜测在体水平Hcy也可通过ERS调控巨噬细胞向泡沫细胞转化并在动脉粥样硬化的发生发展中发挥重要作用,但这仍需进一步的实验证实。
综上所述,Hcy可以诱导巨噬细胞摄取大量胆固醇转化为泡沫细胞,在这一过程中内质网应激被激活并参与其中。这可能是Hcy导致血管损伤的重要机制之一。
