响应面法优化镀镍废水中磷处理工艺的研究
2021-05-19陈艺敏陈建福
陈艺敏,陈建福
(1.漳州职业技术学院,食品工程学院,福建漳州 363000;2.福建省高职院校精细化工应用技术协同中心,福建漳州 363000)
磷是生物体必不可少的元素,但是当水体中含 有大量人为排放的磷元素时,容易导致水体富营养化,造成生态平衡失调。电镀工业使用大量次磷酸盐等作为化学镀剂,导致排放的废水多存在磷超标问题[1]。化学镀镍废液中含有浓度较高的次磷酸根和亚磷酸根离子,微生物无法分解,不容易沉淀,以至于磷无法轻易去除。现有研究一般采用臭氧氧化、Fenton 氧化或者次氯酸钠氧化等方法先把次/亚磷酸盐氧化为正磷酸盐,再添加除磷剂进行化学除磷,以满足日益严格的排放要求[2-5]。随着全球磷资源的萎缩,电镀废水中磷的回收也受到了广泛的关注[6]。其中Fenton 氧化-化学沉淀是实际操作中最常用的除磷方法,不仅可以去除废水中高浓度有机物,还能将次磷酸盐和亚磷酸盐氧化成正磷酸盐,通过回收反应生成的磷酸铁,实现磷的资源利用。
Fenton反应受初始pH值、溶液浓度、Fe2+投加量和H2O2的投加量等多种因素的影响,为科学地寻找最优实验条件组合,同时检验影响因素单独作用和交互作用的显著性,响应曲面法被用于实验[7]。响应面法已被证实能够优化电镀废水中重金属和有机物处理条件[8-11],但用于优化电镀废水中次/亚磷酸盐氧化反应的研究很少。本研究采用响应面法优化Fenton 氧化反应条件,以提高次/亚磷酸盐到正磷酸盐的转化率,再利用氧化钙进行化学沉淀除磷。
1 材料与方法
1.1 实验材料
实验所用镀镍废水取自当地一家电镀企业,测得pH 值为2.4,总磷含量约为50 mg/L,次/亚磷酸盐约占总磷的96%。
实验所用药品包括:FeSO4·7H2O、30%H2O2、浓H2SO4、CaO、NaOH、钼酸铵、酒石酸锑钾、抗坏血酸等均为分析纯。
所用仪器包括:pH 计,磁力加热搅拌器,分析天平,紫外分光光度计,压力锅。
1.2 实验方法
取镀镍废水200 mL 于烧杯中,调节废水的pH值,依次加入一定量的FeSO4·7H2O 粉末和30%的H2O2溶液,用磁力搅拌器搅拌反应60 min。实验反应原理如图1所示。在酸性条件下过氧化氢和亚铁离子反应产生强氧化性·OH,将电镀废水中的次/亚磷酸盐氧化为正磷酸盐。静置沉淀后,取上清液经0.45 μm 滤膜过滤后用钼酸铵分光光度法测量水中正磷酸盐的浓度,并计算氧化率θ,见公式(1)。然后往水中投加生石灰,静置沉淀后,取上清液经0.45 μm滤膜过滤后测量水中的总磷,并计算相应的去除率η,见公式(2)。
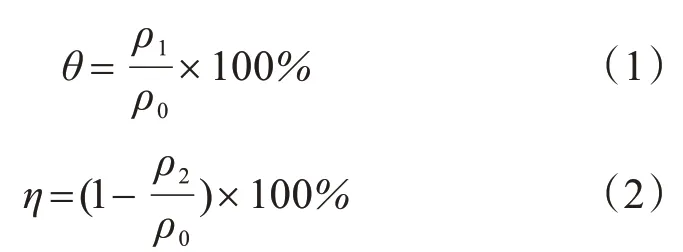
其中:θ 为氧化率,η 为去除率,ρ0为原废水中总磷浓度,mg/L;ρ1为Fenton反应后正磷酸盐浓度,mg/L;ρ2为沉淀反应后总磷浓度,mg/L。
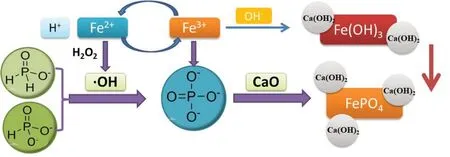
图1 实验原理Fig.1 Experimental principle
1.3 Fenton反应单因素实验
已有研究证实初始pH,Fe2+投加量和H2O2的投加量是Fenton 反应的主要影响因素,反应时间和反应温度也会对反应产生影响。张存芳等[12]发现Fenton反应在前60 min反应基本完成,继续延长反应时间已没有意义。温度对Fenton 试剂这种复杂的反应体系影响复杂,升高温度可以激活羟基自由基,但温度过高会使过氧化氢分解成水和氧气。因此,单因素实验选择在室温下(25 °C)进行,氧化时间60 min,讨论初始pH,Fe2+投加量、H2O2和Fe2+摩尔比(n(H2O2)∶n(Fe2+))的变化对非正磷酸盐氧化为正磷酸盐的影响。
1.4 响应面实验
响应面分析是将反应体系的响应值(非正磷酸盐氧化率)作为多个因素(初始pH、Fe2+投加量、n(H2O2)∶n(Fe2+))的函数,通过方差分析来选择实验中的最优条件。依据单因素实验结果,确定Box-Behnken响应面法的影响因子及水平(表1)。
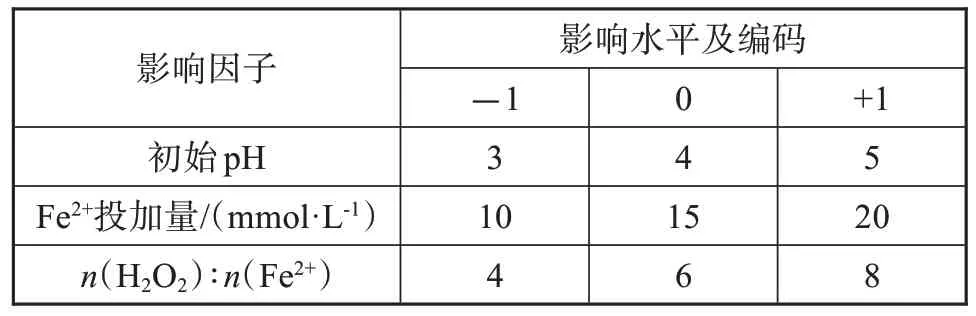
表1 Box-Behnken法的影响因子及水平Tab.1 Impact factors and levels of Box-Behnken design
2 结果与讨论
2.1 单因素实验结果
2.1.1 初始pH值的影响
在酸性条件下,Fenton 试剂中的Fe2+才能催化还原H2O2生成·OH,自身被氧化生成Fe3+,但对于不同的水质,最佳的初始pH 条件并不一样。当初始pH 值在2~6的范围内变化时,分别往废水中加入20 mmol/L 的Fe2+,n(H2O2)∶n(Fe2+)=10 的过氧化氢,非正磷酸盐的氧化率呈先增加后减少的趋势(图2)。初始pH在3~5时Fenton氧化效率较高,初始pH为4时达到峰值,氧化反应后生成红褐色的沉淀。当初始pH 为2 时,溶液中H+浓度过高,抑制Fe3+还原为Fe2+,使得产生的·OH 量减少[13],反应后没有沉淀生成。而当pH 值偏高时,溶液中OH-浓度过高,不仅会抑制·OH 的产生,而且Fe3+会与OH-反应生成沉淀。因此选择初始pH值为4。
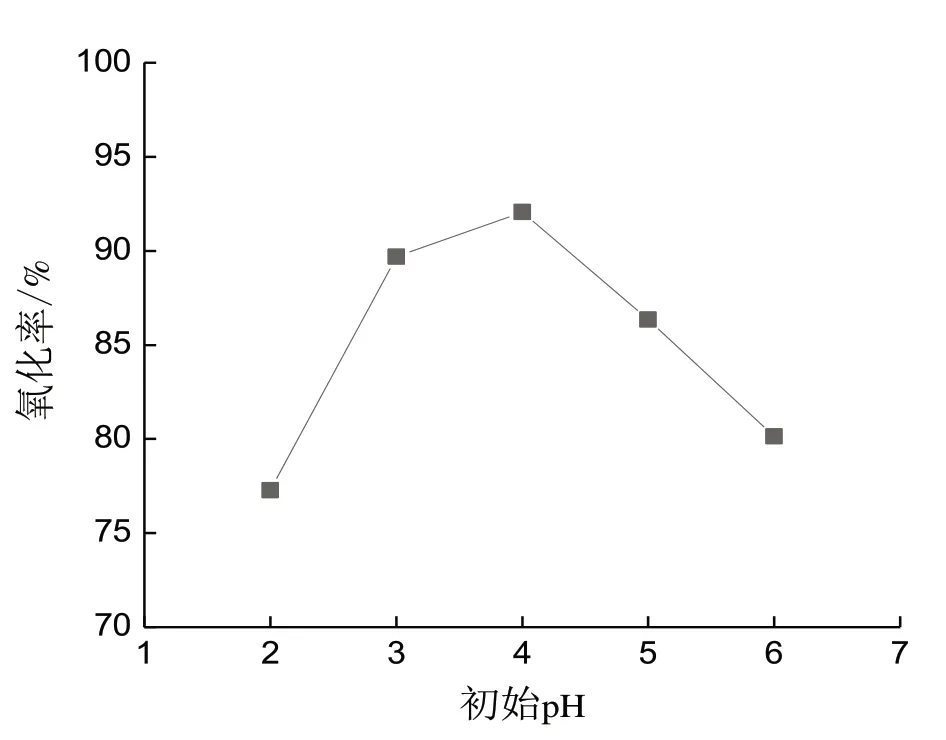
图2 初始pH的影响Fig.2 Effect of the intial pH
2.1.2 Fe2+添加量的影响
调节溶液初始pH 为4,固定n(H2O2)∶n(Fe2+)为10,Fe2+添加量对非正磷酸盐氧化率的影响如图3所示。随着Fe2+添加量的增加,氧化率先迅速增大后略有下降。这是由于当溶液中Fe2+浓度低时,Fenton反应速度较慢;随着水中Fe2+浓度增大,反应速度迅速增加。但是当Fe2+的添加量增加至15 mmol/L后,继续增加Fe2+浓度对氧化率增加的作用变得不明显,甚至略有下降。这是因为过量的Fe2+在还原H2O2的同时,自身氧化为Fe3+,不仅消耗药剂,而且增加出水的色度[14]。因此,选择Fe2+添加量为15 mmol/L。
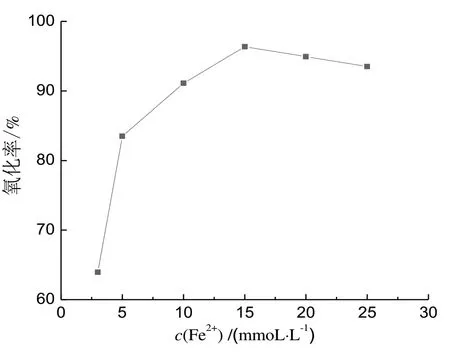
图3 二价铁添加量的影响Fig.3 Effect of the Fe2+dosage
2.1.3 n(H2O2)∶n(Fe2+)的影响
调节溶液初始pH 为4,加入15 mmol/L 的Fe2+,加入H2O2的量对非正磷酸盐氧化率的影响见图4。随着n(H2O2)∶n(Fe2+)的增加,氧化率先是快速增加,然后开始减少。当溶液中H2O2浓度不够时,氧化速度较慢,但是当H2O2过量时,会在反应开始时就迅速将Fe2+氧化成Fe3+,并抑制羟基自由基的产生,反而使氧化效率降低[15]。因此,选择n(H2O2)∶n(Fe2+)为6。
2.2 响应面法优化Fenton氧化实验
2.2.1 模型的建立及分析
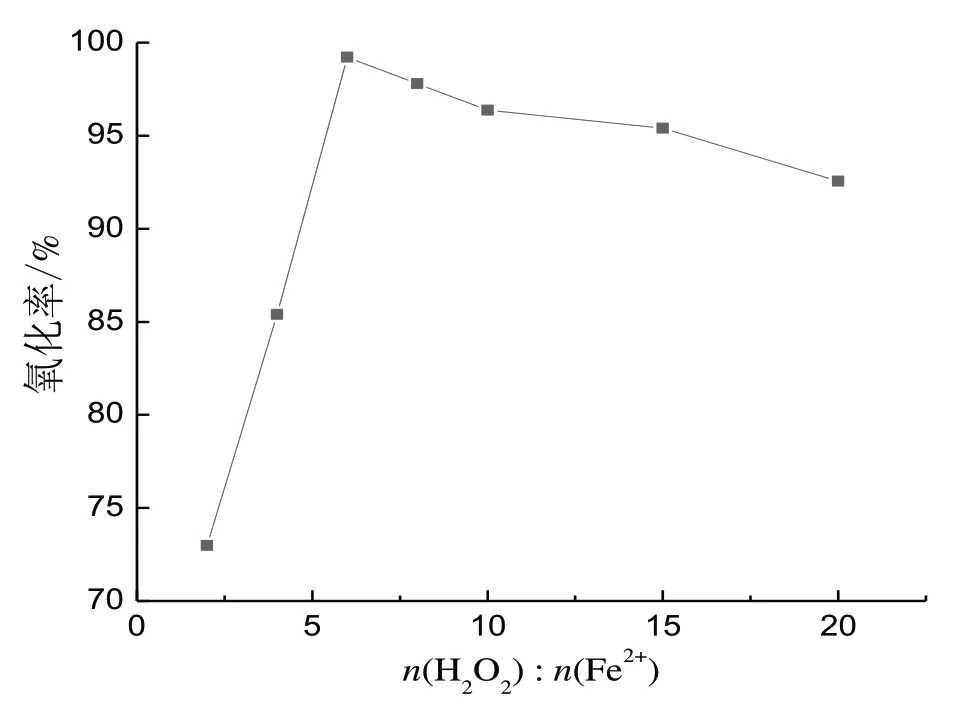
图4 n(H2O2)∶n(Fe2+)的影响Fig.4 Effect of n(H2O2)∶n(Fe2+)
根据响应面设计方案进行实验,得到非正磷酸盐的氧化率(如表2 所示)。应用Design-Expert 10.0.3 对结果进行响应面的分析,建立氧化率θ(y)与初始pH(A)、Fe2+投加量(B)、n(H2O2)∶n(Fe2+)(C)三个变量之间的二次多项式模型,可以得到以下拟合的二次方程:y=99.23-1.55A+3.10B-0.36C+0.36AB+0.12AC-0.60BC-4.11A2-5.55B2-0.54C2(3≤A≤5,10≤B≤20,4≤C≤8)。根据方程中因子的系数的大小,可以识别因子的相对影响。在讨论的范围内,三个影响因子中Fe2+投加量对氧化率的影响最大,其次是初始pH,n(H2O2)∶n(Fe2+)的影响最小。
二次方程的方差分析详见表3,F 表示F 检验值,P表示置信度。结果显示,模型的F值为102.70,说明该模型显著,F 值为噪声的几率小于0.01%。A、B、A2和B2项目的P 值小于0.05,说明它们是模型中的显著影响项。二次方程的决定系数R2=0.9925,且失拟项不显著,说明该模型能够较好地分析和预测Fenton 氧化非正磷酸盐实验的优化条件。校正决定系数,预测决定系数,两者之差小于0.1,说明预测值是合理可信的。从非正磷酸盐氧化率的预测值和实测值的线性回归分析可见(图5),两者的相关性很好,说明用模型来优化Fenton反应条件的可信度较高。
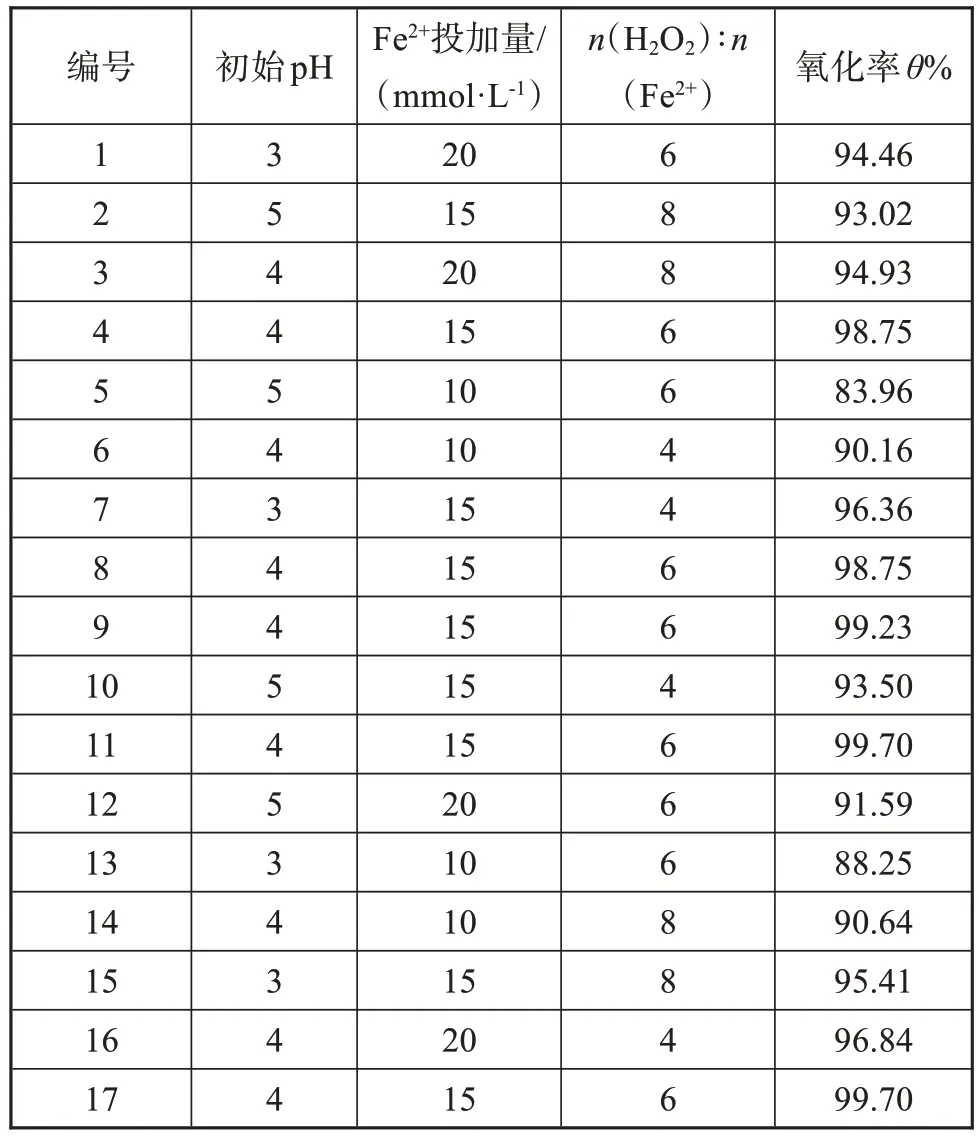
表2 实验方案及结果Tab.2 Experimental design and results
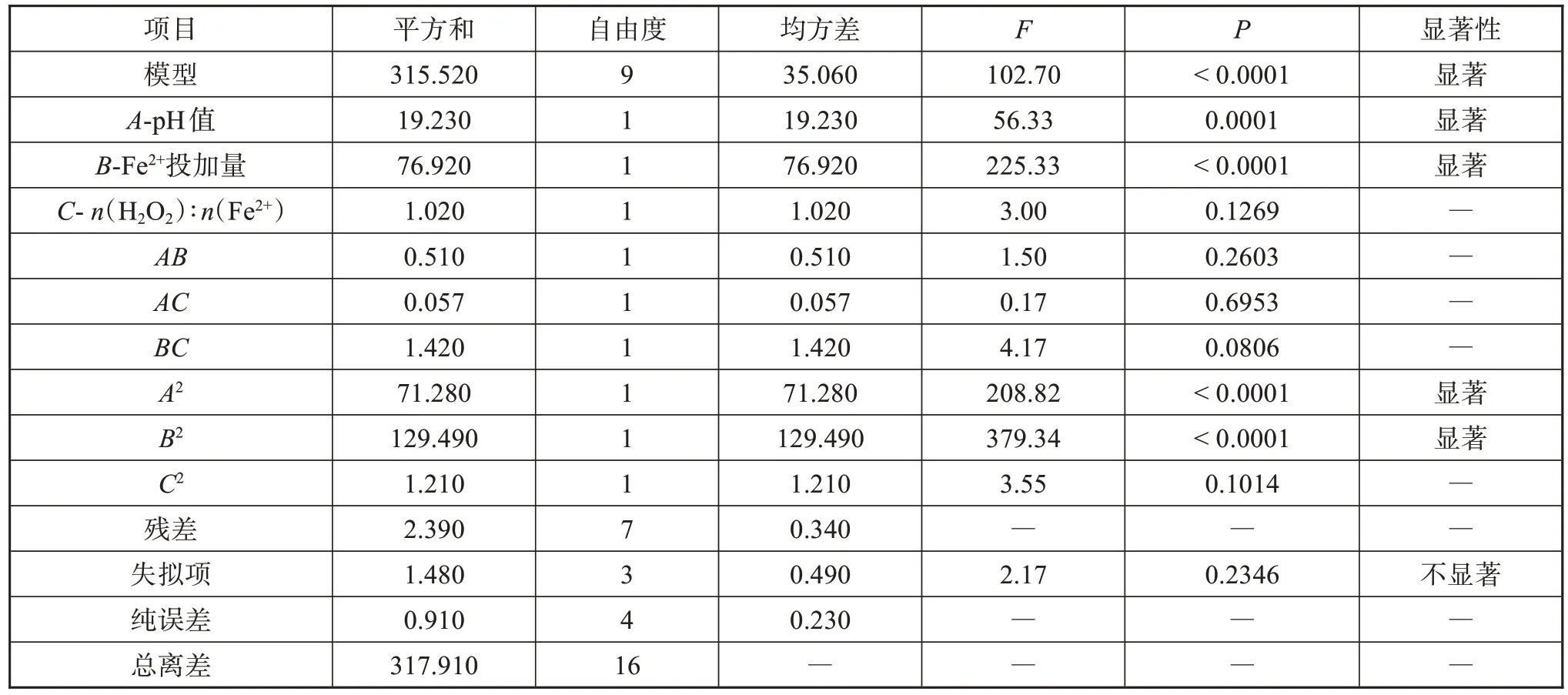
表3 回归方程的方差分析Tab.3 Analysis of variance in regression equation
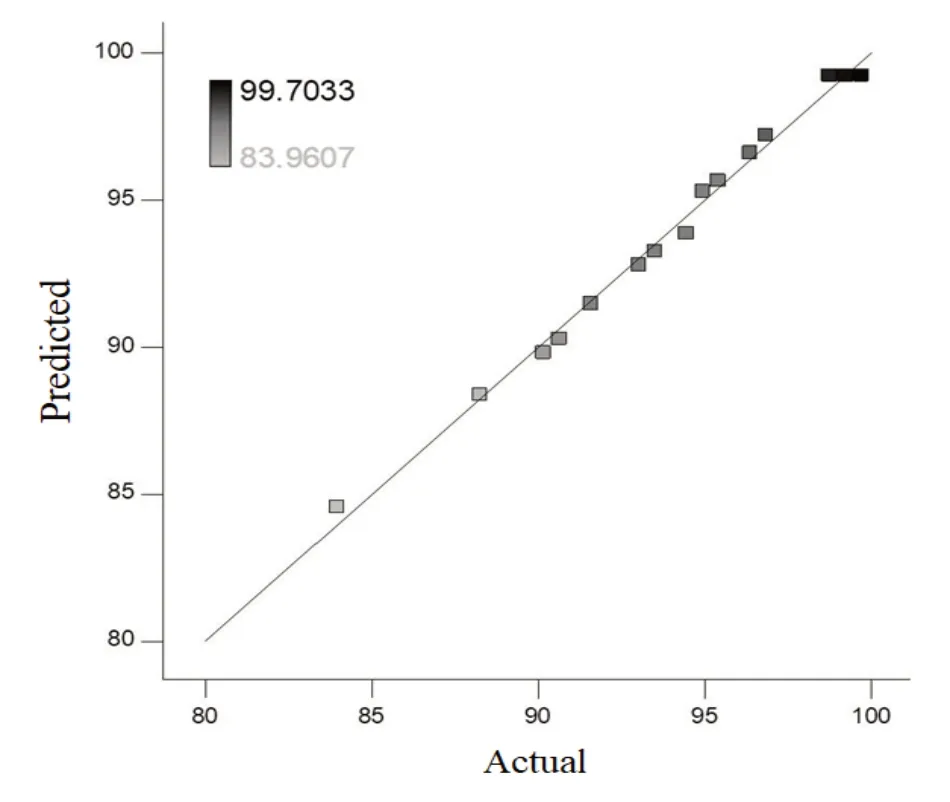
图5 氧化率的预测值与实测值的回归分析Fig.5 Regression analysis of oxidation rates between the predicted and actual values
2.2.2 响应面分析
图6 反映的是各因子在设计空间的中心点对响应值的影响程度。从图中可见,氧化率随初始pH值的增加呈现先增加后迅速减少的趋势,随Fe2+量的增加是先快速增加后减少的趋势,随n(H2O2)∶n(Fe2+)的增加而变化的趋势并不显著。
各因子之间的交互作用可以通过响应面及其等高面图直观地反映出来。当n(H2O2)∶n(Fe2+)=6时,从AB 因子的响应图(图7(a))可以发现,在研究范围内,氧化率随着初始pH的增加呈现先增大再减小的趋势,在pH=4 左右达到峰值。随着Fe2+添加量的增加,氧化率也呈现先增大再减小的趋势,在Fe2+=16 mmol/L 左右达到峰值,但是改变初始pH 对变化趋势的影响很小。因此认为初始pH 和Fe2+添加量的交互作用不明显,但是从图中可以明显得到这两个因素的最佳值。
当Fe2+=15 mmol/L,从AC 因子的响应图(图7(b))可以发现,在研究范围内,氧化率随初始pH 的增加先增大后减小,在初始pH 为4 左右达到最大值。氧化率随着n(H2O2)∶n(Fe2+)的增加也呈现先缓慢增加后减少的趋势,但是改变初始pH值对变化趋势的影响较小。因此认为初始pH 和n(H2O2)∶n(Fe2+)的交互作用不显著。
当初始pH=4,在BC 因子的响应图(图7(c))中,氧化率随Fe2+添加量的增加先迅速增加而后缓慢减少,当Fe2+添加量在16 mmol/L 左右,氧化率达到最大值。Fe2+添加量小于14 mmol/L 时,氧化率随n(H2O2)∶n(Fe2+)的增加变化不明显;Fe2+添加量大于14 mmol/L 时,氧化率随n(H2O2)∶n(Fe2+)的增加呈现先缓慢增大后缓慢减小的趋势。但总体而言,Fe2+添加量与n(H2O2)∶n(Fe2+)的交互作用不显著。
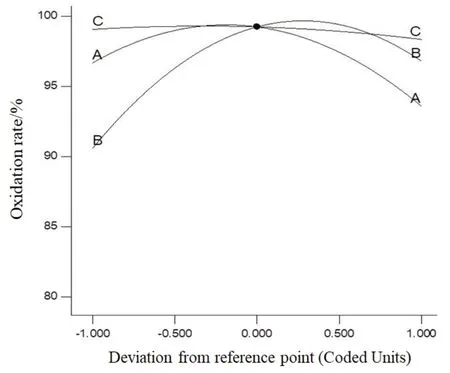
图6 各因子对氧化率的影响Fig.6 Effects of each factor on oxidation rate
2.2.3 最佳实验结果分析与模型验证
Box-Behnken 响应曲面法得到最大Fenton 氧化率最高的最佳反应条件为:初始pH 为3.7,Fe2+投加量为16.2 mmol/L,n(H2O2)∶n(Fe2+)为4,预测非正磷酸盐的氧化率可达到99.72%。根据最佳实验条件,进行三组平行实验取平均值,得到实际的氧化率为99.12%,与模型的预测偏差为0.6%,证明运用响应面法优化Fenton氧化非正磷酸盐的条件是可行的。
2.3 化学除磷
废水经过响应面优化Fenton 氧化反应后,99%以上的次/亚磷被氧化成正磷,此时废水呈酸性,pH值约为2.5。Fenton 反应后水中仍存在大量的Fe3+,利用铁盐化学除磷最佳的pH 范围为5.0~5.5,此时FePO4的溶解性最小而沉淀下来。通过往废水中添加CaO,生成微溶的Ca(OH)2,一方面可以提高废水的pH 值,使氢氧化铁和磷酸铁沉淀;一方面能够附着在水中杂质上使其沉淀下来。当pH 值大于8.5后,沉析作用使溶解的磷酸盐产生不溶性的磷酸钙而沉淀下来。从图8可见,随着CaO 添加量的增加,溶液pH 值升高,测得水中总磷浓度随之下降。当pH 值大于5 后,溶液开始出现明显的沉淀。当pH为中性时,测得水中总磷浓度小于0.5 mg/L,TP 去除率达到99.65%,达到《污水综合排放标准》(GB8978—1996)的一级排放标准。继续加入CaO直至溶液的pH=10,测得溶液中TP 浓度0.041 mg/L,化学除磷率达到99.9%以上。
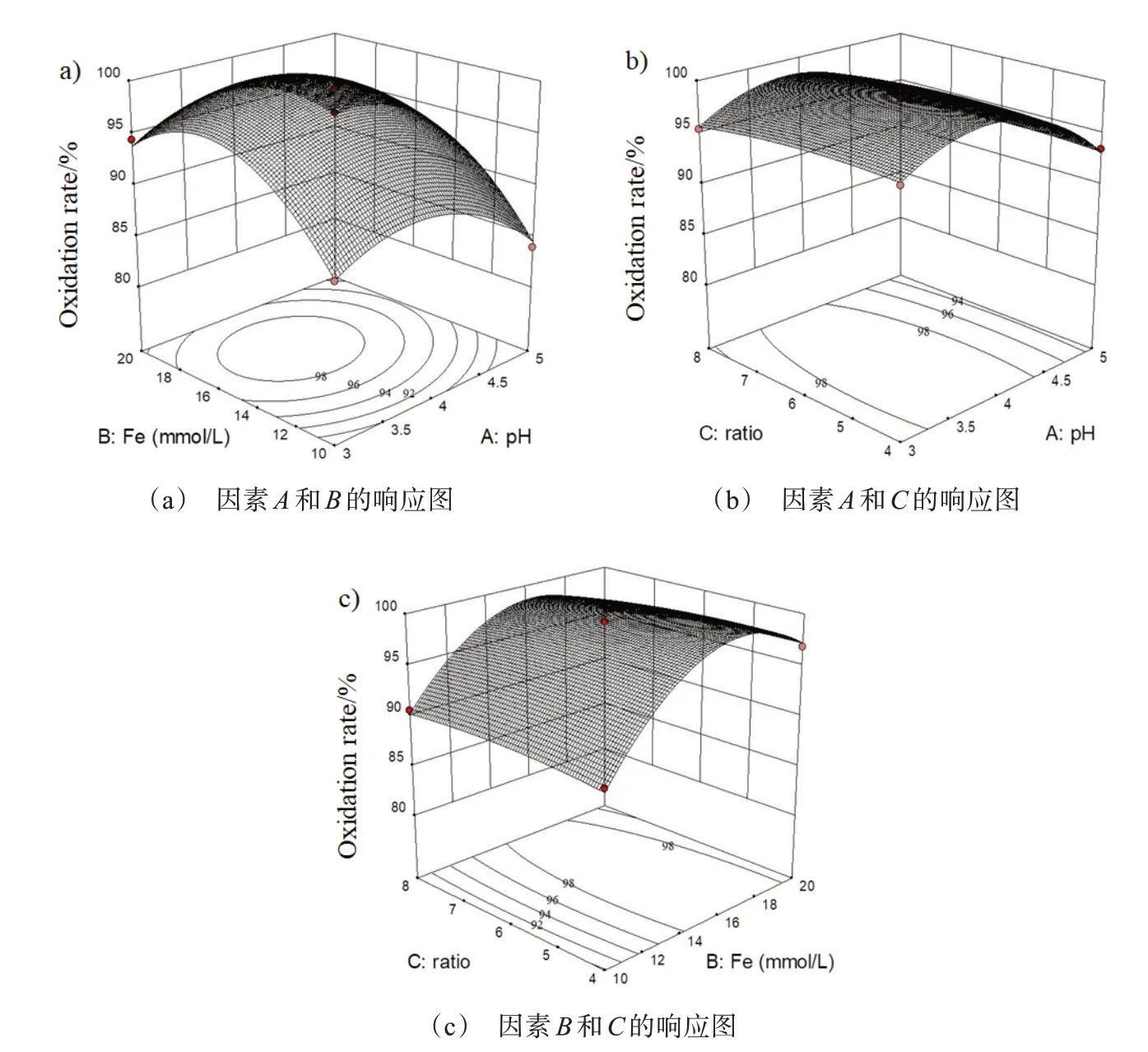
图7 各因素交互影响的响应曲面图Fig.7 Response surface plots of the interaction of each factor
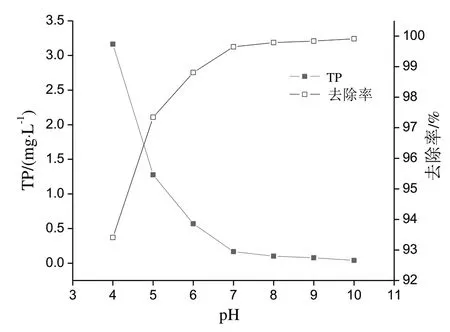
图8 氧化钙化学除磷Fig.8 Chemical phosphorus removal by CaO
3 结论
(1)根据Fenton 氧化非正磷酸盐单因素实验结果,确定Box-Behnken响应面影响水平,建立氧化率(y)与初始pH(A)、Fe2+投加量(B)、n(H2O2)∶n(Fe2+)(C)三个变量之间的二次多项式模型。该模型具有高度显著性(P<0.0001),R2=0.9925 且失拟项不显著,说明与真实情况拟合性良好。模型中的A、B、A2和B2项为显著影响项。
(2)模型预测最佳反应条件:初始pH为3.7,Fe2+投加量为16.2 mmol/L,n(H2O2)∶n(Fe2+)为4 时,非正磷酸盐的氧化率为99.72%。实际实验结果为99.12%,与模型预测结果偏差仅为0.6%。
(3)利用CaO 进行化学除磷,当pH 值为中性时,测得水中总磷浓度小于0.5 mg/L,TP 去除率达到99.65%,达到《污水综合排放标准》(GB8978—1996)的一级排放标准。
