海南新村湾海草促生菌株分离及多样性
2021-05-19林显程董俊德周卫国彭秋颖杨清松唐小玉张燕英
林显程,董俊德,周卫国,彭秋颖,张 健,张 颖,杨清松,唐小玉,张燕英,凌 娟*
(1. 中国科学院南海海洋研究所、中国科学院热带海洋生物资源与生态重点实验室、广东省应用海洋生物学重点实验室,广东 广州 510301; 2. 南方海洋科学与工程广东省实验室,广东 广州 510301;3.中国科学院海南热带海洋生物重点实验站,海南 三亚 572000;4. 中国科学院南海生态环境工程创新研究院,广东 广州 510301; 5. 中国科学院大学,北京 100049)
海草床作为生物多样性和生产力最高的海洋生态系统之一,为海洋生物提供了栖息地和食物来源,并参与到碳、氮、磷和硫等的生物地球化学循环,具有重要的生态服务功能[1]。海草的生长极易受到氮、磷等营养元素的限制,但其根际和叶际共附生大量对宿主有益的微生物[2-5],能将氮气和不溶性磷转化为铵盐和可溶性无机磷供海草吸收利用。此类细菌一般为植物促生菌(Plant Grouth Promoting Bauteria, PGPB),是一类具有促进植物生长、提高植物营养吸收效率和提高植物抗逆性的益生菌群,主要为植物内生菌、根际和叶际附生微生物[6]。PGPB可以通过直接或间接的途径来维持植物的健康生长[7]。间接途径一般是指促生菌通过分泌抗生素、蛋白酶等来帮助宿主植物抵抗病原微生物的入侵,诱导植物产生有效的系统抗性[7-10]。PGPB的直接作用主要包括合成植物激素和促进植物营养物质吸收。如促生菌可通过分泌吲哚乙酸(IAA)、细胞分裂素(CTK)和赤霉素(GA)等植物激素刺激植物生长,也可通过释放磷酸盐和硅酸盐等矿物质中的磷和钾,直接提高植物可吸收营养物质的浓度。
在农业上,PGPB已经作为微生物菌剂开发利用,能有效减少化学肥料的应用、改善盐碱地,帮助农作物对抗干旱、重金属污染和病原菌入侵[11-12]。陈倩等(2011)发现固氮菌Paenibacillussp. 能拮抗小麦和棉花病原真菌,并使小白菜增重52%[13];Patel等(2017)发现内生固氮菌能在小麦根内定殖,并能显著增加小麦鲜重、干重、根长、叶长和促进其光合作用[14];葡萄糖酸杆菌(Gluconacetobacterdiazotrophicus)能缓解干旱胁迫,提高水稻产量和抗性[15]。PGPB作为农业益生菌剂的研究在国内外趋于成熟,但在海草研究领域还是一片空白,国内关于海草益生菌的分离培养及多样性也鲜有报道[16-18]。20世纪以来,由于人类活动和气候变化的影响,全球范围内的海草床正以每年7%的速率发生退化,导致海草床生态服务功能受到损害[1],如海草床捕获的碳以每年299 Tg的速率重新释放[2]。海草植株移植是目前修复海草床的主要方法之一[19],但是移植后海草植株需要一段时间来形成稳定的微生物群落结构。因此,本研究拟通过富集培养和促生特性分析方法筛选出合适的海草促生菌,未来研制成微生物菌剂作用于移植海草根际,为植株提供N、P和Fe等营养物质并提高其适应性,对海草床生态系统修复具有重要意义。
1 材料与方法
1.1 样品采集及处理
采样地新村湾(18°24′34″N,109°57′42″E)位于我国海南省陵水县,其西部与南海相接,为天然泻湖,优势海草种类为泰来草(Thalassiahemperichii)和海菖蒲(Enhalusacoroides)。用无菌铲获得泰来草和海菖蒲的植株及根际沉积物,分装于无菌袋中,立即带回实验室处理。用无菌海水冲洗海草植株,将叶子和根分开。取0.5 g冲洗干净并剪碎的海草叶子或根、0.2 g根际沉积物,分别放入18 mL无菌海水中摇匀,稀释成1×10-1和1×10-22个梯度,直接涂布于固氮菌筛选固体培养基中;取2 g泰来草或海菖蒲根际沉积物至98 mL选择性液体培养基中,28 ℃、180 r/min的培养条件于摇床中富集培养,3 、15 d和30 d后分别取混悬液稀释至一定浓度涂布于选择性固体培养基中。
1.2 培养基
海草固氮培养基[20]:NaCl 25 g, MgSO4· 7H2O 4.8 g, MgCl2· 6H2O 4.0 g,蛋白胨 4.0 g,酵母提取物 2.0 g, KCl 0.56 g, Tris 0.48 g, K2HPO40.01 g, FeSO4· 7H2O 0.001 g,甘油 2.0 mL,去离子水1 L,pH为 8.2,固体培养基加入2%琼脂。
Ashby无氮培养基[20]:D-甘露醇 5.0 g, NaCl 5.0 g, CaCO35.0 g, KH2PO4·H2O 0.2 g, MgSO4·7H2O 0.2 g, CaSO40.1 g,去离子水 1 L,pH为 7.0,固体培养基加入2%琼脂。用于固氮菌的筛选。
改良选择性解磷培养基(PSM)[21]:D-葡萄糖 15.0 g, NaCl 25 g, NH4NO35.0 g, CaCl22.0 g, KCl 0.5 g, MgSO4·7H2O 0.5 g, FeSO4·7H2O 0.01 g, MnSO4·7H2O 0.01 g,植酸钠 4 g(用少量水溶解,单独灭菌),去离子水 1 L,固体培养基加入2%琼脂。用于溶磷菌筛选。
2216E液体培养基:购于青岛海博生物科技有限公司,固体培养基加入2%琼脂。用于细菌纯化后的传代培养、菌种保藏及促生能力验证。
1.3 细菌DNA提取及PCR扩增
划线纯化后的菌株用试剂盒Bacterial DNA Kit(OMEGA)提取基因组DNA。引物27F(5’-GAGTTTGATCMTGGCTCAG-3’)和1492R(5’-GGTTACCTTGTTACGACTT-3’)用来扩增16S rRNA基因,PCR产物用琼脂糖凝胶电泳检测,条带清晰的送广州天一辉远基因科技有限公司进行测序。细菌16S rRNA基因序列导入EzBioCloud(https://www.ezbiocloud.net/)进行比对。
1.4 促生特性测定
1.4.1 固氮能力检测 引物nifHF(5′-ATGTCGGYTGYGAYCCSAARGC-3′)和nifHR(5′-ATGGTGTTGGCGGCRTAVAKSGCCATCAT-3′)用来扩增固氮基因[22],并用乙炔(C2H4)还原法测定菌株固氮酶活性[23]。固氮菌株在装有2216E液体培养基的50 mL锥形瓶中摇瓶生长至对数期,随即转移到带有密封塞的小气瓶中,用注射器抽出5%的空气,同时打入等体积的纯乙炔,反应24 h,用GC112A气相色谱仪检测乙烯和乙炔峰。用不同体积浓度的纯标准乙烯气体和乙烯峰面积制作标准曲线,R2>0.99。
1.4.2 菌株溶磷活性检测 采用钼锑抗比色法测菌株溶磷能力[24]。接种1%活化后的待测菌液(OD值为0.6)至20 mL改良选择性PSM培养基中,置于摇床中28 ℃,160 r/min培养5 d,空白PSM培养基为对照。取1 mL发酵液于4 000 r/min离心30 min,吸取200 μL上清液转入50 mL容量瓶,滴加二硝基酚指示剂,调节pH至溶液微黄,加入5 mL钼锑抗显色剂,摇匀定容。静置4 h后于886 nm处测定吸光度。根据制定的标准曲线计算溶磷量,R2>0.99。
1.4.3 菌株产铁载体测定 菌株产铁载体能力用CAS固体平板法检测[25]。先将待测菌株于2216E固体培养基上活化,用铂金丝挑起单菌落接种在CAS固体培养基上,28 ℃恒温培养箱培养5 d,观察菌落周围是否出现橙黄色晕圈。一般晕圈越大、颜色越深,菌株产铁载体能力越强。
1.4.4 菌株蛋白氨化能力测定 将活化后的菌株接种到装有10 mL蛋白胨溶液(蛋白胨10 g/L,NaCl 25 g/L)的25 mL锥形瓶中,28 ℃恒温培养箱培养3 d,每瓶加入0.5 mL Nessler试剂(阿拉丁,上海),菌液颜色由黄色转为橙色说明菌株具有氨化能力[25]。
1.4.5 菌株产IAA能力测定 菌株产IAA能力用Salkowski显色反应检测[26]。细菌在添加了L-色氨酸(终浓度为200 μg/mL)的2216E液体培养基中28 ℃摇瓶培养3 d,取2 mL培养液10 000 r/min离心15 min,小心吸取1 mL上清液与2 mL Salkowski显色液(50 mL 35%高氯酸与1 mL 0.5% FeCl3溶液混合)混匀,在室温下暗反应30 min,测OD530。以IAA标准品(Sigma)梯度稀释液作标准曲线,空白培养基作对照,R2>0.99。
1.5 数据分析
应用Excel 2016整理数据和制作标准曲线,用Mothur软件对样品进行细菌多样性分析,包括OTU(Operational Taxonomic Unit)数目、Chao、 Shannon和Simpson指数。其中,Chao指数代表物种丰富度,Shannon和Simpson指数代表物种均匀度和多样性[27]。
2 结果与分析
2.1 泰来草和海菖蒲获得菌株初步鉴定及多样性
通过直接稀释涂布法和富集培养法分离筛选,初步从泰来草和海菖蒲根、叶和根际沉积物中分离纯化出可培养细菌131株,隶属于36属61种,芽孢杆菌(Bacillus)、弧菌(Vibrio)和希瓦氏菌(Shewanella)为优势属,分别占14.50%、10.69%和8.49%。获得菌株中有74株分离自泰来草,占27个属,13个属为其特有;海菖蒲有23个属,9个属为其特有。芽孢杆菌和弧菌同样在两种海草中占优势(表1、图 1);两种固氮菌选择性培养基分离获得菌株111株,而只有20株菌分离自溶磷培养基(表1)。基于细菌多样性分析,泰来草样品OTU数目、Chao和Shannon指数均高于海菖蒲样品,表明泰来草分离细菌多样性高于海菖蒲(表2);三种培养基中,PSM培养基获得OTU数目最少,多样性最低,而海草固氮培养基Chao指数最高,多样性指数略高于Ashby培养基。

表1 两种海草分离筛选菌株来源及分布Tab. 1 Source and distribution of the isolated strainson two seagrasses

图1 泰来草和海菖蒲中分离获得菌株在属水平上的组成Fig. 1 Composition of isolated strains in genus level on seagrass T. hemperichii and E. acoroides
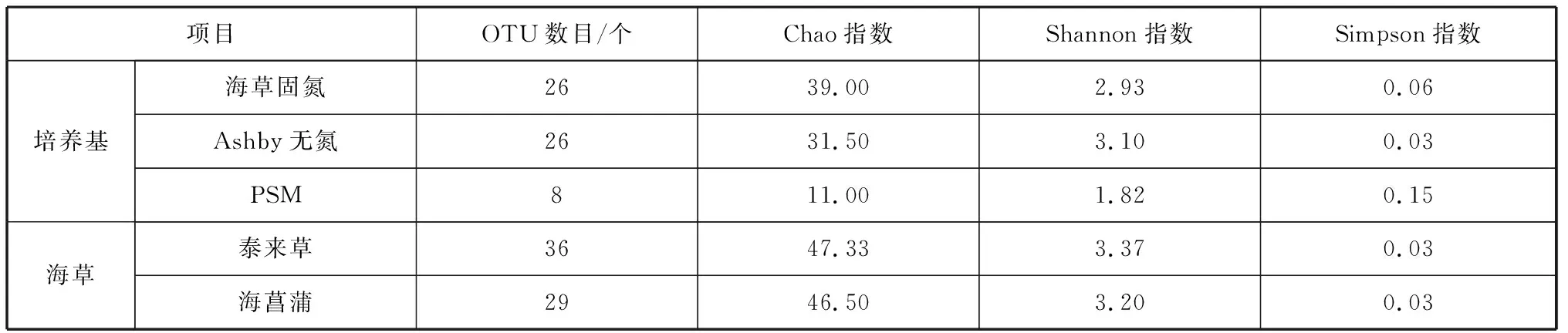
表2 不同海草和培养基分离细菌的多样性指数Tab. 2 Diversity index of bacteria isolated from different seagrass species and mediums
2.2 菌株促生特性验证
2.2.1 菌株固氮能力 仅12株菌能扩增出固氮基因,主要包括弧菌、交替假单胞菌(Pseudoalteromonas)、Breoghania、Oricola和Salipiger5个属。经测定,菌株L-2(Breoghaniacorrubedonensis)以 C2H4计的固氮酶活性达14.27 nmol/(h·mL) 。
2.2.2 菌株溶解无机磷能力 共17株菌在PSM培养基上有明显溶磷圈,基于16S rRNA鉴定主要来自3个种:新加坡克雷伯氏菌(Klebsiellasingaporensis)、解鸟氨酸拉乌尔菌(Raoultellaornithinolytica)和阿氏芽孢杆菌(Bacillusaryabhattai)。经钼锑抗比色法测定,代表菌株XHP-1(K.singaporensis)、XTP-5-1(B.aryabhattai)和XTP-9(R.ornithinolytica)的溶磷量分别为29.92、14.30、44.86 mg/L,溶解无机磷能力较强(图2)。

图2 部分菌株在PSM培养基上产生的溶磷圈Fig. 2 Phosphate dissolving rings produced on PSM medium by some isolated strains
2.2.3 菌株产铁载体、产IAA和蛋白氨化能力 根据CAS固体平板上晕圈的大小和颜色深浅判断菌株产铁载体的能力,结果发现大部分细菌都产铁载体,但有27株细菌产铁载体能力较弱,占总菌株数的44%。另外,只有RS-8、 XTP-5-1、 XTP-9、 XTP-11、 XTN-1和XTN-7这6株菌的产铁载体能力为“+++”(图3),分别属于贝莱斯芽孢杆菌(Bacillusvelezensis)、阿氏芽孢杆菌(B.aryabhattai)、解鸟氨酸拉乌尔菌、嗜丝氨酸副球菌(Paracoccusseriniphilus)、需钠弧菌(Vibrioneocaledonicus)和希瓦氏菌属(Shewanellacarassii)。通过观察显色反应发现,约49%的供试菌(30株)不具有蛋白氨化能力,有9株菌的氨化能力较弱,而弧菌、希瓦氏菌和芽孢杆菌氨化能力最强。经Salkowski法测定,有41株菌产吲哚乙酸能力较弱(<10 μg/mL)或不产,10株菌吲哚乙酸产量大于50 μg/mL,其中7株菌的产量在113.69~179.48 μg/mL之间,具有较强的产IAA能力,主要为弧菌、克雷伯氏菌和芽孢杆菌(表3)。

图3 高产铁载体的菌株Fig. 3 Strains with high siderophore yielding ability
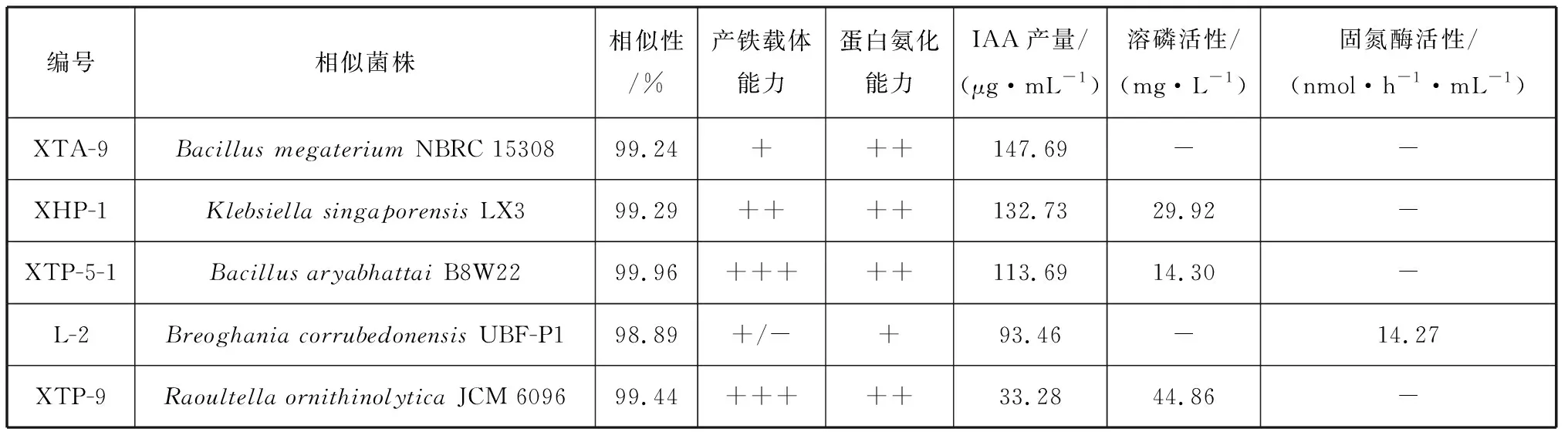
表3 潜在海草促生菌株促生特性分析结果Tab. 3 Results of growth-promoting traits of potential PGPB strains
2.3 根际促生菌系统发育分析
结合固氮活性、溶磷活性及其他促生特性分析,菌株L-2、 XTA-9、 XHP-1、 XTP-5-1和XTP-9至少有3种或以上,促生能力较强,适合作为海草根际促生菌使用(表3)。对5株菌进行16S rRNA基因扩增,并在EzBioCloud数据库进行同源比对,下载序列相似性最高的参考菌株构建系统进化树(图4)。系统发育分析结果表明,L-2、XHP-1、XTP-9分别与BreoghaniacorrubedonensisUBF-P1、新加坡克雷伯氏菌、解鸟氨酸拉乌尔菌同源性最高,而XTA-9与巨大芽孢杆菌(BacillusmegateriumNBRC 15308)相似性为99.24%,XTP-5-1与阿氏芽孢杆菌相似性为99.96%。

图4 潜在海草促生菌株基于邻建法构建的系统进化树Fig. 4 Phylogenetic tree of potential seagrass growth-promoting bacteria by Neighbor-Joining method
2.4 讨论
海草的健康生长和较高的生产力得益于与微生物的共生关系[4,7,28-30]。海草植株通过改变分泌物招募有益微生物,而促生菌可以为海草解除营养限制并减少毒害作用。Crump等(2018)证实鳗草(Zosteramarina)和日本鳗草(Z.japomica)根际及叶际共附生细菌群落中存在丰富的硫氧化还原、固氮和植物激素基因,对维持海草生长有重要作用[4]。本研究利用固氮和溶磷选择性培养基,通过富集培养的方法筛选海南新村湾优势海草泰来草和海菖蒲潜在促生菌,共获得细菌131株,分布于36属61种。泰来草和海菖蒲优势属均为芽孢杆菌和弧菌,但泰来草样品获得了74株菌和36个OTU,而海菖蒲样品只有57株菌和29个OTU,前者细菌多样性明显高于后者。Jiang等(2015)同样发现新村湾泰来草可培养细菌丰度高于海菖蒲[17],优势目为芽孢杆菌目,这与我们的研究一致。另外,虽然海草固氮培养基的细菌多样性高于Ashby和PSM培养基,但5株潜在促生菌中有4株来自Ashby和PSM培养基(XHP-1、 XTP-9、 XTP-5-1和 XTA-9),说明选择性更强的Ashby和PSM培养基更容易分离到功能菌株。
芽孢杆菌、假单胞菌、根瘤菌(Rhizobium)、伯克氏菌(Burkholderia)和克雷伯氏菌等是国内外研究广泛报道的植物根际促生菌,普遍具有溶磷、固氮、产铁载体、产IAA和ACC脱氨酶活性等促生能力和生物防治作用[31]。本研究获得5株促生能力较强的菌株,通过扩增16S rRNA基因鉴定分别为Breoghania(L-2)、克雷伯氏菌(XHP-1)、拉乌尔菌(XTP-9)和芽孢杆菌(XTA-9和XTP-5-1)。两株芽孢杆菌XTA-9和XTP-5-1在16S rRNA基因比对上分别与巨大芽孢杆菌和阿氏芽孢杆菌相似性最高。Liu等(2006)筛选到一株固氮巨大芽孢杆菌C4,用gfp基因标记发现它能很好地定植在水稻和玉米根部[32];吉玉玉等(2019)发现巨大芽孢杆菌粗提物能有效抑制根癌农杆菌(Agrobacteriumtumefaciens)和胡萝卜软腐欧文氏菌(Erwiniacarotovora)等病原菌,主要抑菌成分为亚油酸和亚油酸甲酯等[33]。Park等(2017)用产植物激素的阿氏芽孢杆菌处理大豆植株,结果显示其显著提高了大豆产IAA、GA和茉莉酸(JA)的水平,并提高了大豆热耐受能力[34]。克雷伯氏菌同样具有多种的促生特性,大部分为溶磷菌,可产植物激素,并能拮抗有害重金属[35-37]。此外,Klebsiellavariicola和Klebsiellapneumoniae是报道最广泛固氮菌[37-38],常作为氮循环模型研究。Drancourt等(2001)将拉乌尔菌从克雷伯氏菌中独立出来,归为一个新属,但拉乌尔菌和克雷伯氏菌具有相似的促生特性,同样具有溶磷、固氮和产植物激素能力[39]。Guo等(2015)发现添加K.variicola、Raoultellaplanticola或Pseudomonasfluorescens均使玉米积累胆碱和甜菜碱,从而增加玉米叶水分含量和干重,使得玉米植株对干旱耐受增加[40]。菌株B.corrubedonensis属于粘着杆菌科首次从以多环芳烃芘为唯一碳源的培养物中分离获得,能有效降解石油[41]。本研究分离纯化的菌株L-2与B.corrubedonensis相似性为98.89%,具有固氮能力,IAA产量达93.46 μg/mL,并且还具有产铁载体和氨化能力,具有作为PGPB的巨大潜力。
作为极其脆弱的生态系统,海草床和珊瑚礁、红树林生态系统一样,容易受到人类活动和自然环境变化的影响。海草移植,即从茂盛、健康的海草床中采集植株移栽到待修复的区域里,是海草床生态修复的有效手段。刘燕山等(2015)移植到山东荣成天鹅湖的鳗草植株存活率达76.5%以上,定植时间为1~4个月不等[42]。研究表明,增加营养盐能增加移植海草的根长、叶长及生物量[43-44],而潜在的促生菌正好能提供这些营养物质。例如,固氮菌可以将海草不能直接利用的氮气转化为铵盐,为海草床提供“新氮源”,溶磷菌通过产植酸酶释放可溶性无机盐,而吲哚乙酸可以刺激海草细胞分裂,促进根和叶的伸长。Xiong等(2017)发现施加以芽孢杆菌和木霉菌(Trichoderma)为主的微生物菌剂能够明显抑制玉米镰刀枯萎病的发生,其抑菌机制是通过微生物菌剂改善植物根际微生物群落结构,招募能直接抑制病原菌的细菌Lysobacter[45]。这说明PGPB具有改变宿主植物微生物群落结构的能力,使微生物群落朝着有利于宿主生长的方向演变。因此,促生菌的添加不仅能直接增加移植海草可用营养盐含量,并且有可能帮助移植海草在短时间内重塑附生微生物群落结构,使其更好地在新环境中定植生长,有利于海草生态系统的保护和修复。
3 结论
通过溶选择性磷和固氮培养基的筛选,本研究一共从海南新村湾两种优势海草的根、叶和根际沉积物中获得细菌131株,其中芽孢杆菌、弧菌和假单胞菌为优势属。在可培养细菌多样性方面,泰来草>海菖蒲,海草固氮培养基>Ashby培养基>PSM培养基。综合分析细菌溶磷、固氮、产铁载体、产吲哚乙酸和蛋白氨化能力,最终筛选出5株潜在促生菌L-2(Breoghaniasp.)、XTA-9(Bacillussp.)、XHP-1(Klebsiellasp.)、XTP-5-1(Bacillussp.)和XTP-9(Raoultellasp.)。其中仅菌株L-2具固氮活性,达14.47 nmol/(h·mL)(以C2H4计),而XHP-1、 XTP-5-1和XTP-9具有较强的溶磷能力,溶磷量分别为22.92、14.30、44.86 mg/L。另外菌株XTA-9虽然并不表现出固氮和溶磷活性,但具有较强的产IAA和氨化能力。5株菌均具有3种以上的较强的促生能力,是潜在的PGPB,适合进一步研制成微生物菌剂,应用于海草植株移植和海草床生态系统修复中。
