2-甲基烯丙基氯与乙酸钠的酯化反应动力学研究
2021-05-19陈志荣蔡维玲袁慎峰
陈志荣, 蔡维玲, 王 斌, 袁慎峰, 尹 红
(浙江大学 化学工程与生物工程学院, 浙江 杭州310027)
1 前 言
2-甲基烯丙醇是一种重要的有机中间体,含有羟基和不饱和双键,能溶于有机物、部分溶于水,毒性比烯丙醇更低,反应活性较高,广泛用于农药、医药、香料、树脂和聚羧酸减水剂等的合成[1]。随着我国基础设施建设规模的增长,以2-甲基烯丙醇为原料的羧酸系水泥减水剂需求不断增大。深入研究2-甲基烯丙醇将使以其为中间体的下游产品更为丰富。探究2-甲基烯丙醇的合成方法、优化合成条件、反应机理及动力学对其实际工业生产具有指导意义。目前2-甲基烯丙醇的工业合成大多以2-甲基烯丙基氯为原料,通过直接水解一步法或酯化-水解两步法实现。2-甲基烯丙基氯和羧酸钠反应生成2-甲基烯丙醇羧酸酯后再水解得到2-甲基烯丙醇[2],与碱性条件下2-甲基烯丙基氯直接水解相比,先酯化再水解可以避免生成副产物二-(2-甲基烯丙基)-醚,从而降低分离难度,提高反应收率。固-液酯化反应产物单一、易于分离纯化、不产生含盐废水、可减少设备腐蚀。Devulapelli 等[3]用肉桂酰溴和乙酸钠合成乙酸肉桂酯,探究了不同因素对反应速率的影响,拟合结果表明反应符合拟一级动力学。Vivekanand 等[4]使用四丁基溴化铵在超声辅助下催化邻苯二甲酰亚胺钾盐与1-溴丁烷合成N-丁基邻苯二甲酰亚胺,研究了总反应速率的影响因素,验证了卤代烷与邻苯二甲酰亚胺钾盐在有机溶剂中的反应机理,同样得到拟一级反应动力学规律。固-液酯化反应备受关注,研究结果表明,与均相反应相比,固-液酯化反应具有溶剂用量少、分离速度快、反应收率高和总操作时间短等优点[5-8]。本文研究2-甲基烯丙基氯与乙酸钠的固-液相转移催化酯化反应机理及反应动力学,并探究反应温度、搅拌转速、催化剂用量和种类、溶剂种类等多种因素对反应影响,考察该酯化反应的动力学规律、求取动力学数据,为 2-甲基烯丙基氯与乙酸钠固-液酯化反应的工业化提供参考。
2 实验部分
2.1 实验原料
2-甲基烯丙基氯(质量分数≥99%),安耐吉化学;正丁醇(色谱纯)、无水乙酸钠(分析纯)、氯苯(分析纯)、甲苯(分析纯)、乙腈(分析纯),均购自国药集团化学试剂有限公司;四丁基氯化铵(质量分数≥99%)、四丁基溴化铵(质量分数≥99%)、四丁基碘化铵(质量分数≥99%)、四乙基氯化铵(质量分数≥99%)、十六烷基三甲基溴化铵(质量分数≥99%)、十二烷基三甲基氯化铵(质量分数≥99%),均购自上海麦克林生化科技有限公司;氯仿(分析纯)、十六烷基三甲基氯化铵(质量分数≥99%),均购自阿拉丁试剂有限公司。
2.2 实验方法
称取2-甲基烯丙基氯、乙酸钠、相转移催化剂和溶剂,投入250 mL 三口烧瓶,开启油浴加热和机械搅拌装置,控温精度为 ±0.1 ℃,在反应温度达到设定值并稳定后开始计时,每隔一定时间取样分析原料2-甲基烯丙基氯的转化率。
2.3 分析方法
使用GC-5190 气相色谱仪进行定量分析,内标为正丁醇。气相色谱分析条件:色谱柱为PEG20M 强极性石英毛细管柱 (30 m × 0.25 mm × 0.25 μm),氢火焰离子检测器,柱温初始值为70 ℃,保持6 min,之后以10 ℃·min-1升温至120 ℃并保持3 min,气化温度为250 ℃,检测器温度为280 ℃。
3 实验结果与讨论
3.1 鎓盐类相转移催化剂对固-液酯化反应的影响
分别做有、无相转移催化剂的对照实验。结果表明,反应生成了2-甲基烯丙醇乙酸酯,有相转移催化剂时反应转化率较高、反应完全,而无相转移催化剂存在时反应转化率较低。因此,相转移催化剂必不可少。
3.2 2-甲基烯丙基氯固-液酯化反应动力学
3.2.1 反应机理及动力学模型
根据Melville 等[9]提出的固-液相转移催化机理,由于乙酸钠不溶于有机相,因此催化剂先吸附于乙酸钠表面,进行表面反应,生成可溶性离子对,进入有机相,在有机相中与2-甲基烯丙基氯发生亲核取代反应。反应机理如下:
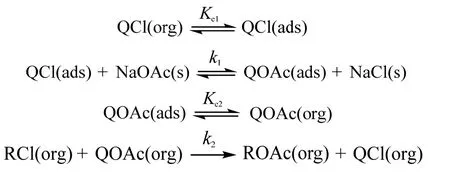
上述反应机理表明有机相是反应场所,反应速率方程可表示为:

再根据质量守恒定律可得:

令分配系数

将式(3)、(4) 代入(2):
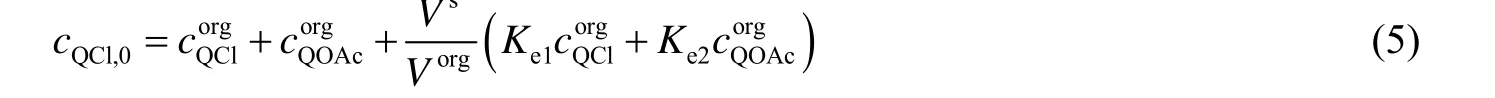

将式 (7) 代入 (6):

将式 (7)代入(1):

反应机理分析表明,η 的影响因素有固相表面积、液相体积、相转移催化剂和离子对在两相的分配系数等。当η 变化可以忽略时,反应速率对2-甲基烯丙基氯的浓度呈现为拟一级。Yang 等[10]通过实验监测有机相中的离子对浓度,发现大量有机溶剂和少量相转移催化剂存在条件下,亲核试剂与卤代烃的摩尔比大于1 即亲核试剂过量时,有机相中离子对浓度经历短暂的诱导期后可视为不变,因此该反应可视为拟一级反应。

将式 (10) 代入(1):

对式 (11) 的左、右两边进行积分得:

3.2.2 动力学参数的估算
氯苯溶剂100 mL、乙酸钠0.15 mol、2-甲基烯丙基氯0.1 mol、十六烷基三甲基氯化铵0.005 mol、搅拌转速600 r·min-1时,分别在353.15、363.15、373.15 和383.15 K 四个温度下进行实验,在未达到所设反应温度时会有少量2-甲基烯丙醇乙酸酯生成,因此从反应温度达到设定值时开始计时,并指定此时的收率为0,其余取样时间点的收率在此基础上进行换算,换算后的2-甲基烯丙醇乙酸酯收率Y随时间的变化数据如表1 所示。不同温度下反应动力学拟合结果如图1 所示。
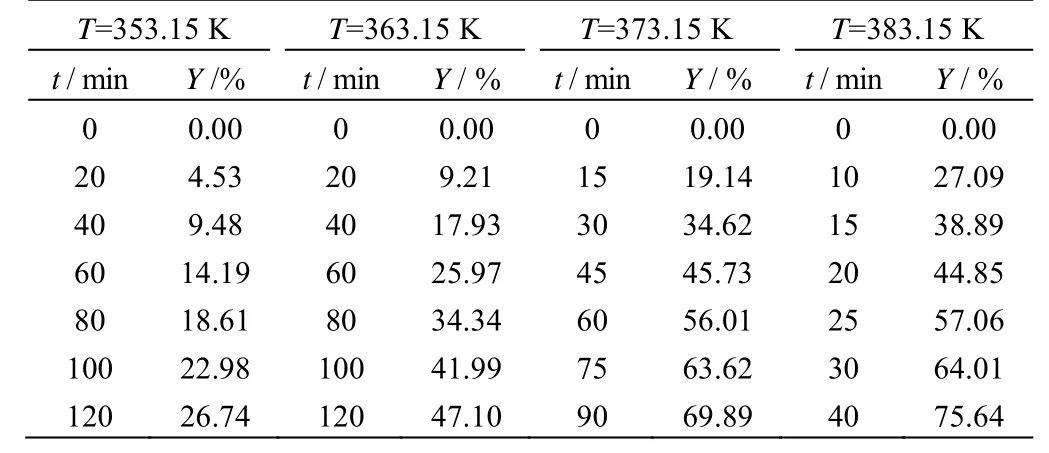
表1 不同温度下2-甲基烯丙基氯与乙酸钠的反应数据Table 1 Reaction results of 2-methylallyl chloride with sodium acetate at different temperatures
不同反应温度下的表观反应速率常数k′ 见表2。根据Arrhenius 方程 ln k ′= ln k0- E /( RT),将不同温度下的ln k′ 对温度的倒数作图 (见图2),并进行反应动力学数据拟合,结果表明,线性程度高且符合拟一级反应动力学假设。根据图中斜率与截距可以得到表观反应活化能为97.61 kJ·mol-1,指前因子为6.498×1011L·(mol·min)-1。
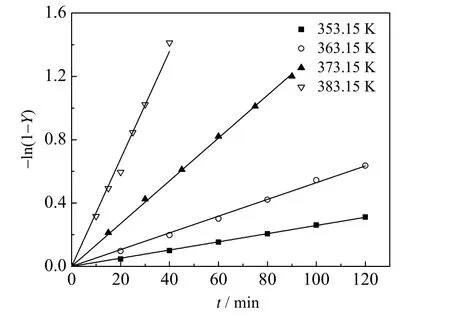
图1 不同温度下反应动力学拟合结果Fig.1 Fitting results of reaction kinetic equations at different temperatures
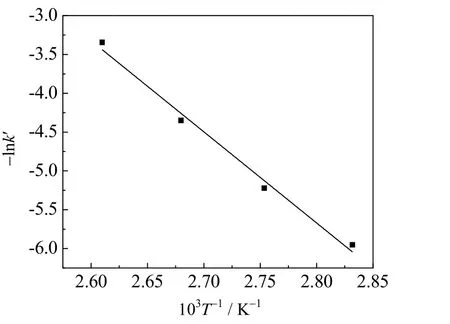
图2 lnk′ 与1/T 关系Fig.2 Plots of lnk′ versus 1/T

表2 不同反应温度下的表观反应速率常数Table 2 Apparent reaction rate constants at different temperatures
3.2.3 动力学模型的验证
在363.15 K、氯苯100 mL、十六烷基三甲基氯化铵0.005 mol、搅拌转速600 r·min-1条件下,使乙酸钠与2-甲基烯丙基氯的摩尔比n(NaOAc):n(RCl)分别为1.5、1.8 和2.0 时进行验证实验,结果如图3 所示。由图可见,乙酸钠用量增加不会显著提高反应收率,表明乙酸钠用量对反应无明显影响。
3.3 搅拌转速对2-甲基烯丙基氯固-液酯化反应的影响
传质阻力是影响两相反应速率的重要因素。在383.15 K、氯苯溶剂100 mL、乙酸钠0.15 mol、2-甲基烯丙基氯0.1 mol、十六烷基三甲基氯化铵0.005 mol 等条件下改变搅拌转速进行实验,2-甲基烯丙醇乙酸酯收率随时间变化如图4 所示。由图可见,随着搅拌转速增加,2-甲基烯丙醇乙酸酯收率增大幅度逐渐减小;搅拌转速大于400 r·min-1时,搅拌转速对2-甲基烯丙醇乙酸酯收率的影响可忽略不计,表明此时传质过程对反应的影响已经排除。

图3 不同原料配比下2-甲基烯丙醇乙酸酯收率随时间变化Fig.3 Yield evolution of 2-methylallyl acetate with time at different molar ratios

图4 搅拌转速对2-甲基烯丙醇乙酸酯收率的影响Fig.4 Effect of stirring speed on the yield of 2-methylallyl acetate
3.4 催化剂用量对2-甲基烯丙基氯固-液酯化反应的影响
在363.15 K、氯苯溶剂100 mL、乙酸钠0.15 mol、2-甲基烯丙基氯0.1 mol、搅拌转速600 r·min-1条件下,改变催化剂用量进行实验,2-甲基烯丙基乙酸酯收率随时间变化如图5 所示。图6 的拟合结果表明,其他条件相同时,在一定催化剂用量范围内,表观反应速率常数k′ 与催化剂用量ncat呈正比。这是因为催化剂用量增加,进入有机相的、由季铵盐阳离子和亲核试剂阴离子形成的反应中间体离子对更多,这与式(11)相吻合,进一步验证了该动力学模型。

图5 不同催化剂用量下动力学拟合结果Fig.5 Fitting results of kinetic equations with different catalyst dosages
3.5 催化剂种类对2-甲基烯丙基氯固-液酯化反应的影响
在363.15 K、100 mL 氯苯、乙酸钠0.15 mol、2-甲基烯丙基氯0.1 mol 和搅拌转速600 r·min-1条件下,分别取0.005 mol的四丁基溴化铵、四丁基氯化铵、四丁基碘化铵、十六烷基三甲基溴化铵、十六烷基三甲基氯化铵、四乙基氯化铵和十二烷基三甲基氯化铵等不同催化剂进行实验,2-甲基烯丙醇乙酸酯收率随时间变化如图7 所示。结果表明,不同催化剂的催化性能由高到低依次为:四丁基氯化铵>四丁基溴化铵>四丁基碘化铵>十六烷基三甲基氯化铵>十六烷基三甲基溴化铵>四乙基氯化铵>十二烷基三甲基氯化铵。
对催化剂的阴离子而言,催化性能从高到低依次为Cl->Br->I-,这是因为催化剂的阴离子亲核性越强,与季铵根阳离子的结合力越强,不利于季铵根阳离子与亲核试剂阴离子结合形成离子对进入有机相,导致催化性能降低。通常催化剂结构相同时,阳离子碳链数越高,催化性能越高,因为碳链越长,亲油性越好,形成的离子对更容易进入有机相。阳离子对称性越好,催化性能越高,如使用四丁基氯化铵催化的反应速率显著高于其他催化剂。离子对的中心原子正电荷越分散,与亲核试剂阴离子的结合就越不牢固,负离子裸露程度越高,亲核性更强,催化效率越高。
3.6 溶剂种类对2-甲基烯丙基氯固-液酯化反应的影响

图6 不同催化剂用量下表观反应速率常数拟合结果Fig.6 Fitting results of apparent reaction rate constants with different catalyst dosages

图7 不同催化剂对2-甲基烯丙醇乙酸酯收率影响Fig.7 Effect of different catalysts on the yield of 2-methylallyl acetate
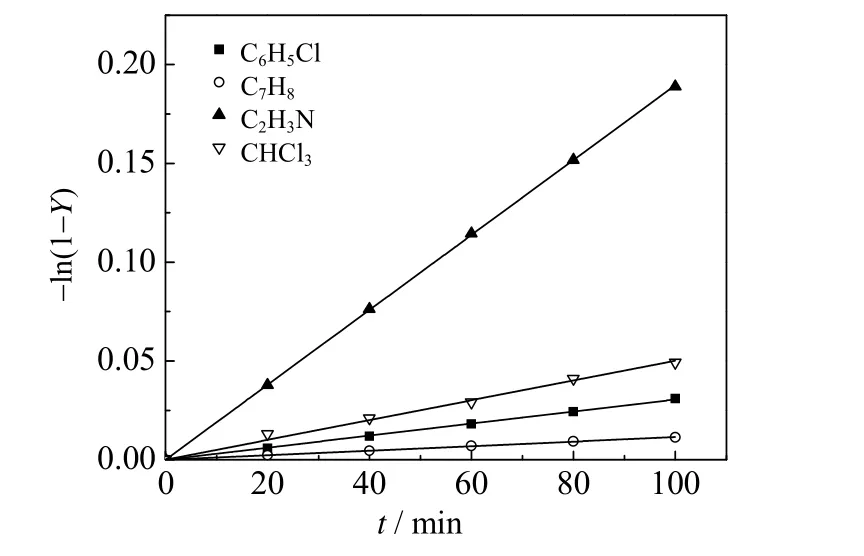
图8 不同溶剂对2-甲基烯丙醇乙酸酯收率的影响Fig.8 Effect of different solvents on the yield of 2-methylallyl acetate
在333.15 K (由于氯仿的沸点为61~62 ℃,本实验选择较低反应温度)、乙酸钠0.15 mol、2-甲基烯丙基氯0.1 mol、溶剂用量100 mL、催化剂0.005 mol 和搅拌转速600 r·min-1时,使用氯苯、甲苯、乙腈和氯仿探究溶剂种类对2-甲基烯丙基氯固-液酯化反应速率的影响,2-甲基烯丙基乙酸酯收率随时间变化如图8 所示。由图可见,不同溶剂进行反应时表观反应速率从大到小依次为:乙腈>氯仿>氯苯>甲苯,这与四种溶剂的极性高低顺序一致。这是因为溶剂极性越高,离子对在溶剂中的溶解度越大,高极性溶剂有利于离子对从固体表面扩散进入有机相。此外,对于底物不带电荷的双分子亲核取代反应(SN2 反应)而言,溶剂会与过渡态形成偶极-偶极键;溶剂极性越强,形成偶极键的能力越强、过渡态的能量越低、SN2 反应活化能越低,越有利于反应进行。这和Wang 等[11-12]的研究结果一致,即溶剂极性是固-液反应速率的主要影响因素。除了溶剂极性,相关研究还表明,溶剂的电导率、表面张力等因素也可能影响反应速率[10,13-14]。
4 结 论
(1) 相转移催化剂对2-甲基烯丙基氯与乙酸钠的酯化反应是必不可少的;催化剂的阴离子亲核性越弱、阳离子的碳链数越长、对称性越好,则催化性能越好;在一定催化剂用量范围内,表观反应速率和催化剂用量呈正比;
(2) 吸附于固体表面的催化剂与亲核试剂进行表面反应,生成可溶性离子对进入有机相,再与2-甲基烯丙基氯发生亲核取代反应,该反应遵循SN2 反应机理,对催化中间体离子对、卤代烃的浓度均呈拟一级。在大量有机溶剂和少量相转移催化剂存在条件下,当乙酸钠与2-甲基烯丙基氯的摩尔比大于 1 时,有机相中离子对浓度经过短暂的诱导期后可视为不变。固定催化剂种类、用量时反应遵循拟一级反应动力学规律,即在353.15~383.15 K、催化剂十六烷基三甲基氯化铵用量为0.005 mol 时,反应动力学方程可表示为:(3) 溶剂极性是2-甲基烯丙基氯与乙酸钠的固-液酯化反应速率的主要影响因素之一。

符号说明:
ci— 反应物或产物的浓度,mol·L-1,i 为NaOAc、
QCl、QOAc、ROAc、RCl
E — 活化能,kJ·mol-1
k0— 指前因子,L·(mol·min)-1
k1,k2— 反应速率常数,L·(mol·min)-1
k′ — 表观反应速率常数,min-1
Ke1,Ke2— 分配系数
n — 物质的量,mol
NaOAc — 乙酸钠
QCl — 相转移催化剂
QOAc — 离子对
rRCl— RCl 反应速率,mol·(L·min)-1
R — 普适气体常数,8.314 J·(mol·K)-1
RCl — 2-甲基烯丙基氯
ROAc — 2-甲基烯丙醇乙酸酯
t — 反应时间,min
T — 反应温度,K
V — 有机相或固体相体积,L
Y — 收率
η — 有机相中的离子对与相转移催化剂比值
上标
ads — 固体表面
org — 有机相
s — 固相
下标
0 — 反应初始量
cat — 催化剂
