肾透明细胞癌CYP4A11、Ki-67表达及与患者临床病理特征的关系
2021-05-19杨丹丹何冰卢晓郭芷含李玉军
杨丹丹 何冰 卢晓 郭芷含 李玉军
(青岛大学附属医院病理科,山东 青岛 266003)
肾透明细胞癌起源于近曲小管,是成人肾脏原发恶性肿瘤中最常见的类型[1]。虽然根治或部分肾切除术以及靶向治疗等在肾透明细胞癌患者治疗中取得显著效果,但仍有部分患者会复发、转移甚至死亡[2]。了解肾透明细胞癌独特的代谢途径是诊断和治疗肾透明细胞癌的关键[3]。因此,对肾癌发生机制进行研究,寻找新的生物标志物及治疗靶点对改善肾透明细胞癌患者的预后具有重要意义。细胞色素P450 4(CYP4)家族是由CYP4A和CYP4F两种亚型组成,它们催化所有形式的脂肪酸的ω-羟基化[4]。其中,CYP4A亚型在炎症的激活和消解中具有双重作用,并介导肿瘤生长和血管生成的关键调节物类二十烷酸(20-HETE)的形成[5]。研究发现,CYP4A11是CYP家族的主要成员之一,受PPARα调控,在人体肝脏和肾脏中含量最高[6]。Ki-67是一种参与核糖体RNA转录的核蛋白,目前常被作为细胞增殖活性的敏感指标。研究表明,Ki-67的表达与肿瘤的侵袭性及恶性程度相关,可用来评价肿瘤生物学行为[7]。本研究旨在观察CYP4A11及Ki-67在肾透明细胞癌组织中的表达情况及相关性,并探讨其与临床病理学因素及患者预后的关系。
1 材料与方法
1.1 材料来源
收集我院2010年1月—2015年12月手术切除的151例肾透明细胞癌的组织标本,另取48例癌旁组织标本作为对照。所有纳入的病例标本均为原发病灶,术前均未接受放化疗。纳入本研究的151例患者中,男95例,女56例;年龄28~87岁,平均年龄58.04岁,中位年龄59岁;肿瘤最大径≤7 cm 127例,>7 cm 24例;WHO/ISUP核分级:Ⅰ级~Ⅱ级76例,Ⅲ级~Ⅳ级75例;临床分期Ⅰ期~Ⅱ期126例,Ⅲ期~Ⅳ期25例;未发生远处转移129例,发生远处转移22例。
1.2 抗体与试剂
兔抗人多克隆CYP4A11抗体(克隆号ab3573,稀释度1∶200)购自英国Abcam公司,Ki-67抗体(工作液)购自丹麦DAKO公司,其他试剂(工作液)为瑞士ROCHE公司产品。
1.3 检测方法
使用ROCHE VENTANA全自动免疫组化染色机检测肾透明细胞癌组织中CYP4A11及Ki-67的表达,按照说明书进行操作。用PBS代替一抗作为阴性对照。
1.4 结果判读
CYP4A11免疫组化检测结果采用Histoscore法进行评分[8]。Ki-67指数判读按照相关文献报道的标准[2]。
1.5 统计学方法
采用SPSS 23.0软件进行统计学分析处理。CYP4A11在癌与癌旁表达比较采用Mann-Whitney检验;CYP4A11及Ki-67的表达与临床病理特征的关系采用χ2检验;CYP4A11与Ki-67相关性应用Spearman等级分析;采用Cox回归分析进行生存分析,以P<0.05为差异有显著性。
2 结 果
2.1 CYP4A11在肾透明细胞癌和癌旁组织中的表达情况
肾透明细胞癌组织中CYP4A11定位表达于细胞膜或细胞质(图1A),在肾透明细胞癌伴肉瘤样变区域中CYP4A11定位表达于细胞质(图1B),在癌旁组织中定位表达于细胞质(图1C)。151例肾透明细胞癌组织中,51例呈高表达,100例呈低表达,而48例癌旁组织中,27例呈高表达,21例呈低表达,两者比较差异有显著性(Z=-2.100,P<0.05)。
2.2 CYP4A11表达与肾透明细胞癌临床病理特征的关系
151例肾透明细胞癌中低级别肾透明细胞癌76例,高级别肾透明细胞癌75例。CYP4A11在低级别肾透明细胞癌中低表达60例,高表达16例,在高级别肾透明细胞癌中低表达40例,高表达35例。高级别肾透明细胞癌组织中CYP4A11的高表达率要显著高于低级别肾透明细胞癌(χ2=11.072,P<0.05)。
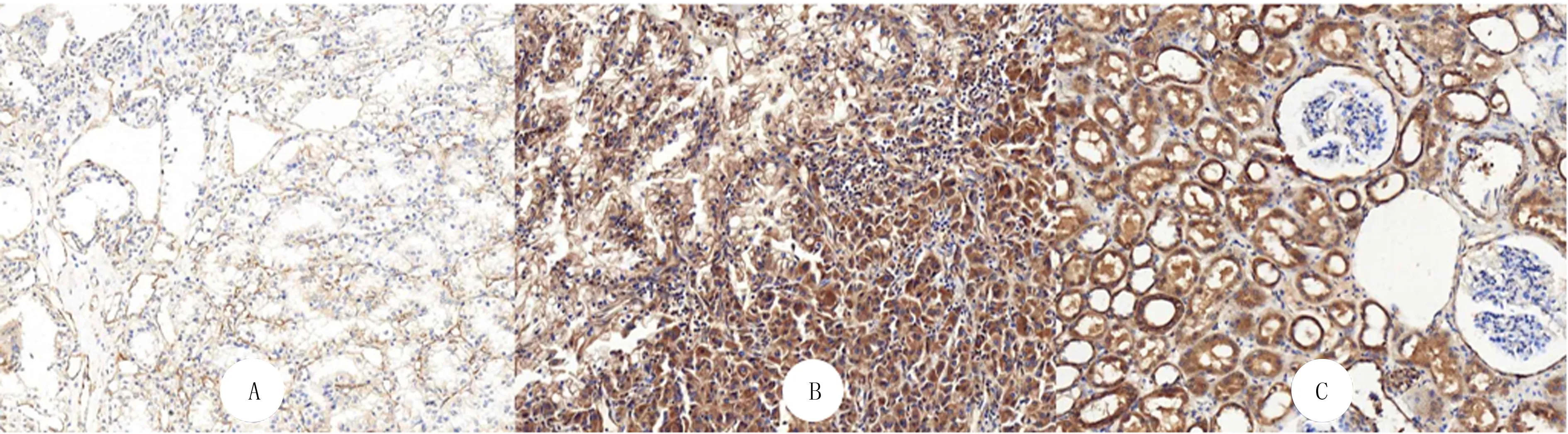
A:CYP4A11在肾透明细胞癌中呈低表达,B:CYP4A11在肾透明细胞癌及伴肉瘤样变区域中呈高表达,C:CYP4A11在癌旁组织中呈高表达。En Vision法染色,200倍图1 CYP4A11在肾透明细胞癌及癌旁组织中的表达
CYP4A11的表达与患者性别及肿瘤最大径、临床分期、肉瘤样变以及远处转移有关(χ2=4.438~10.930,P<0.05);而与患者年龄无关。见表1。
2.3 Ki-67表达及其与肾透明细胞癌临床病理特征的关系
Ki-67在低级别肾透明细胞癌中低表达69例,高表达7例,在高级别肾透明细胞癌中低表达34例,高表达41例。Ki-67在高、低级别肾透明细胞癌组织中的表达差异有显著意义(χ2=35.971,P<0.05)。
Ki-67的表达与肿瘤最大径、临床分期、肉瘤样变、远处转移有关(χ2=4.365~10.833,P<0.05);而与患者性别、年龄无关。见表1。

表1 肾透明细胞癌CYP4A11及Ki-67表达与临床病理学参数的关系
2.4 CYP4A11与Ki-67表达的相关性
151例肾透明细胞癌中,CYP4A11和Ki-67均高表达者26例,CYP4A11高表达Ki-67低表达者25例,CYP4A11低表达Ki-67高表达者22例,CYP4A11和Ki-67都低表达者78例。Spearman相关性分析显示,肾透明细胞癌组织中CYP4A11与Ki-67表达呈显著正相关(rs=0.231,P<0.05)。
2.5 肾透明细胞癌组织中CYP4A11及Ki-67表达与患者总生存时间的关系
本研究中151例肾透明细胞癌患者中随访成功138例,失访13例,失访率8.6%。单因素Cox回归分析显示,性别与肿瘤最大径、WHO/ISUP核分级、临床分期、肉瘤样变、远处转移以及CYP4A11、Ki-67水平对患者总生存时间有影响。对上述指标进行多因素Cox回归分析显示,临床分期、远处转移为影响肾透明细胞癌患者总生存时间的独立危险因素。见表2。

表2 单因素和多因素Cox回归模型分析肾透明细胞癌患者总体生存时间的影响因素
3 讨 论
约70%肾透明细胞癌中VHL基因突变或者高甲基化导致pVHL表达失活,使得缺氧诱导因子-1α(HIF-1α)大量增加并激活下游一系列缺氧反应基因,如血管内皮生长因子(VEGF)等,诱导血管生成、促进糖酵解及脂质沉积等,使其具有不同于正常肾小管上皮细胞的代谢特征。因此,典型肾透明细胞癌组织富含血管、糖原和脂质[9-12]。CYP4A11是CYP家族的主要成员之一,参与脂肪酸分解代谢以及催化20-HETE的形成,在调节血管张力、肾血流量和肾小管钠转运等方面发挥重要作用,并与肿瘤血管生成、增殖和转移相关[13-19]。CYP4A11基因的启动子区域中含过氧化物酶体增殖物激活受体-α(PPARα)反应元件,PPARα调控CYP4A11。既往研究表明,PPARα基因在肾透明细胞癌、前列腺癌、肾乳头状细胞癌中均明显下调,PPARα蛋白在透明细胞癌组织中的表达水平明显低于癌旁正常组织,而且与生存不良密切相关,可作为临床诊断和预后指标[20]。同时有研究表明,PPARα在高级别肾透明细胞癌组织中较低级别组织中表达增高[21]。CYP4A11在人体肝中含量最高,其次是肾脏,在其他器官中表达较低[6]。研究表明CYP4A11在肝癌中表达水平明显低于正常组织,且与肝癌转移和预后相关,而CYP4A11在三阴性乳腺癌、胰腺癌、结肠癌等组织中表达水平高于正常组织,其代谢产物20-HETE表达也增加[18,22-25]。20-HETE已被公认为是癌症进展的关键调节因子,与VEGF等共同作用,促进细胞增殖、新生血管形成、肿瘤生长以及转移[5,26-27]。CYP4A11参与细胞脂肪酸代谢,并促进非酒精性脂肪肝的形成[28]。本研究结果显示,CYP4A11在肾透明细胞癌组织中的表达水平明显低于癌旁组织,CYP4A11表达水平的变化提示其受PPARα的调控,而在肾透明细胞癌组织当中,CYP4A11在高级别肾透明细胞癌中的高表达率显著高于低级别肾透明细胞癌,这可能表明CYP4A11在正常肾小管细胞和肾透明细胞癌细胞的脂肪酸代谢中发挥不同作用。具体机制有待于进一步探索。本研究评估CYP4A11在不同组织学级别的肾透明细胞癌中的表达,分析其表达与临床病理特征的关系,发现CYP4A11与患者性别及肿瘤最大径、临床分期、肉瘤样变、远处转移有关,提示CYP4A11可能参与肾透明细胞癌的恶性生物学行为过程,并对患者的生存及预后具有提示意义。肾透明细胞癌伴肉瘤样分化是一种恶性程度更高的类型[29]。本研究结果发现CYP4A11在肉瘤样区域中表达于细胞质且表达程度明显高于周围透明细胞癌区域。提示CYP4A11可能参与肾透明细胞癌的上皮间质转化(肉瘤样变)过程,这有待于进一步探索。
目前Ki-67通常被作为细胞增殖活性的敏感指标[2]。本研究结果显示,Ki-67在肾透明细胞癌中的表达程度与肿瘤组织学级别、最大径、临床分期、肉瘤样变、远处转移有关,而与患者性别、年龄无关。Spearman相关性分析显示,肾透明细胞癌组织中CYP4A11与Ki-67表达呈正相关。CYP4A11以及Ki-67可以作为预测肾透明细胞癌患者生物学行为的有效指标,对肾透明细胞癌的预后评估具有指导意义。
本研究单因素分析显示,性别与肿瘤最大径、WHO/ISUP核分级、临床分期、肉瘤样变、远处转移以及CYP4A11、Ki-67水平对患者总生存时间有影响。对上述指标进行多因素分析显示,临床分期、远处转移为影响肾透明细胞癌患者总生存时间的独立危险因素。以上生存分析结果说明肾透明细胞癌的转移进展及预后不良与CYP4A11及Ki-67表达程度有关,两者在判断肾透明细胞癌患者预后中有潜在的价值。
