白介素-36α在烟曲霉感染的人角膜上皮细胞免疫反应中的作用及其机制
2021-05-19张子悦郑恒睿马玉娜吴媛王谦徐强张杰林静
张子悦 郑恒睿 马玉娜 吴媛 王谦 徐强 张杰 林静
(青岛大学附属医院眼科,山东 青岛 266003)
真菌性角膜炎是一种高致盲率的感染性角膜病变。近年来,真菌性角膜炎发病率逐年升高,广谱抗生素、糖皮质激素以及角膜接触镜的不规范使用,都增加了真菌性角膜炎的发病风险[1]。烟曲霉菌是我国真菌性角膜炎主要致病真菌之一[2],而在烟曲霉菌感染中适当的炎症反应对致病病原体的清除至关重要[3]。白细胞介素-36(IL-36)是近年来新发现的IL-1细胞因子家族成员,可以与特异性IL-36受体(IL-36R)结合,激活胞内信号传导通路,发挥促炎作用。IL-36由IL-36α、IL-36β和IL-36γ组成,与多种炎症性疾病有关[4]。在流感病毒小鼠肺炎模型中,肺泡上皮细胞中IL-36α表达量高于IL-36γ,并且IL-36α能够加速炎症细胞因子和趋化因子的分泌[5]。IL-36α可与IL-36R特异性结合,激活丝裂原活化蛋白激酶(MAPKs)和核因子κB(NF-κB)信号转导途径[6],促进趋化因子等多种细胞因子分泌[7],在溃疡性结肠炎或肾炎等多种炎性疾病中起到促炎作用[8-10]。已有研究证明,念珠菌感染后口腔黏膜上皮细胞中IL-36α以及IL-36γ的表达增加,经IL-36R信号通路生成IL-17、干扰素-γ(IFN-γ)、肿瘤坏死因子α(TNF-α)等促炎因子,发挥促炎作用[11-13]。GUO等[14]研究显示,铜绿假单胞菌感染的小鼠角膜中IL-36α的表达显著升高,促进上皮细胞分泌多种炎症因子并促进细菌清除,提示IL-36α在感染性角膜炎中高表达并起到促炎作用。但IL-36α在烟曲霉菌感染的角膜上皮细胞中的表达情况及其作用机制,尚未见相关研究报道。本研究通过体外实验探讨IL-36α在烟曲霉菌感染的角膜上皮细胞中的表达情况,以进一步揭示IL-36α在真菌性角膜炎免疫反应中的作用及机制。
1 材料与方法
1.1 材料
永生化人角膜上皮细胞(HCEC)由广州市中山眼科中心眼表实验室提供,烟曲霉菌(菌株3.0772)购自中国微生物中心,人IL-36α重组蛋白(rhIL-36α)、人IL-36Ra重组蛋白(rhIL-36Ra)均购自美国R&D System公司,IL-36α、IL-36R多克隆抗体购自美国圣约翰公司,磷酸化NF-κB p65(pNF-κB p65)、NF-κB p65抗体购自美国Cell Signaling Tecnology公司,RNA裂解液购自中国大连TaKaRa生物公司,IL-8、TNF-α ELISA试剂盒购自武汉伊莱瑞特生物科技有限公司。
1.2 方法
1.2.1烟曲霉菌灭活菌丝的制备 取冷冻保存的烟曲霉菌标准菌株,具体培育方式参考FAN等[3]的实验。使用DMEM高糖培养液将烟曲霉菌灭活菌丝终浓度调整为1.0×108CFU/L。
1.2.2HCEC细胞的培养及烟曲霉菌菌丝刺激实验 将HCEC细胞均匀接种于含有体积分数0.1的胎牛血清以及体积分数为10 g/L的青链霉素的DMEM细胞培养基的6孔或者12孔培养板中,于37 ℃含体积分数0.05 CO2无菌培养箱中培养6~8 h,当HCEC细胞汇合度约为80%时,以无菌PBS洗涤以后更换为无血清DMEM培养基,2 h以后再加入5×108CFU/L烟曲霉菌灭活菌丝刺激HCEC细胞。
1.2.3RT-PCR实验检测HCEC细胞中IL-36α、IL-36R、IL-8及TNF-α mRNA表达水平 以烟曲霉菌灭活菌丝刺激HCEC细胞0、4、8、12、16 h后,检测各个时间点HCEC细胞中IL-36α、IL-36R mRNA表达。将HCEC细胞分为A、B、C组,A组仅给予100 μg/L的IgG重组蛋白处理HCEC细胞8 h,而B、C组分别给予100 μg/L IgG重组蛋白、100 μg/L rhIL-36α预处理细胞1 h后加入烟曲霉菌灭活菌丝刺激HCEC细胞8 h,检测A、B、C组HCEC细胞中IL-8及TNF-α mRNA表达水平。按照实验需要将HCEC细胞分为G、H、I组,G组为单纯DMEM培养基培养8 h的HCEC细胞,H组给予烟曲霉菌灭活菌丝刺激8 h,I组给予Dectin-1中和抗体预处理HCEC细胞2 h后,加入烟曲霉灭活菌丝刺激HCEC细胞8 h后,检测G、H、I组中IL-36α mRNA的表达水平。将细胞收集于500 μL RNA裂解液中,以分光光度法测得RNA样本浓度后计算逆转录加样量。根据诺维赞逆转录试剂盒说明书的要求逆转录获得cDNA原液20 μL,使用DEPC水按照1∶25稀释后,取2 μL稀释液用于RT-PCR实验,最终总反应体积为20 μL。PCR反应条件为:95 ℃预变性30 s,95 ℃变性 45 s,60 ℃退火、延伸 30 s,95 ℃溶解15 s。实验重复3次,计算mRNA的表达水平。搜索GeneBank中人类β-actin、IL-36α、IL-36R、IL-8以及TNF-α对应的mRNA序列,委托中国大连TaKaRa生物公司设计合成引物。引物序列见表1。
1.2.4Western Blot方法检测HCEC细胞中IL-36α、IL-36R、NF-κB p65及pNF-κB p65蛋白的表达接种于6孔板中的HCEC细胞以烟曲霉菌灭活菌丝刺激0、8、12、24 h,检测各个时间点HCEC细胞中IL-36α、IL-36R蛋白表达变化。按照实验需要将HCEC细胞分为D、E、F组,D组为DMEM培养基培养12 h的HCEC细胞,E、F组分别给予100 μg/L rhIL-36α+rhIL-36Ra及100 μg/L rhIL-36α处理细胞12 h,检测D、E、F组细胞中NF-κB p65、pNF-κB p65蛋白的表达变化。按照实验需要将HCEC细胞分为G、H以及I组,G组为DMEM培养基培养12 h的HCEC细胞,H组给予烟曲霉菌灭活菌丝刺激12 h,I组给予Dectin-1中和抗体预处理HCEC细胞2 h后,加入烟曲霉灭活菌丝刺激HCEC细胞12 h后,检测G、H、I组细胞中IL-36α蛋白表达的变化。收集HCEC细胞于提前配制好的RIPA/PMSF蛋白裂解液中,每孔100 μL。冰上裂解2 h后,提取总蛋白并测定蛋白浓度,计算上样量,加入SDS-蛋白上样缓冲液并于109 ℃恒温加热器中加热7 min。另根据目的条带的相对分子量,制备体积分数为0.15的SDS-PAGE胶。跑胶的条件为:80 V恒压电泳60 min,转110 V恒压电泳90 min。低温250 mA湿转2 h后,使用PBST溶液洗膜,室温封闭2 h。4 ℃条件下孵育IL-36α、IL-36R、NF-κB p65、pNF-κB p65(phospho-NF-κB p65)及内参β-actin一抗(稀释浓度均为1∶1 000)12 h,复温1 h后PBST洗膜,加入1∶5 000倍稀释后羊抗兔来源二抗室温孵育2 h,使用ECL Western Blot方法检测试剂显影目的条带,采用Image J软件统计各组灰度值,结果取3次重复实验的均值。
1.2.5ELISA实验检测HCEC细胞中IL-8以及TNF-α在不同处理条件下蛋白表达的变化 HCEC细胞接种于12孔板上,A组仅给予100 μg/L的IgG重组蛋白处理HCEC细胞12 h,B、C组分别给予100 μg/L IgG重组蛋白、100 μg/L rhIL-36α预处理细胞1 h以后,加入烟曲霉菌灭活菌丝刺激HCEC细胞12 h,收集细胞上清液离心后取上清液,根据试剂盒说明书检测各组细胞中IL-8以及TNF-α蛋白的表达水平。所有样本均通过双复孔检测,具体操作按试剂盒说明书进行,用酶标仪在波长450 nm处测量的各个孔的吸光度值后减去在波长570 nm处测量的吸光度值,计算出各例标本中所测因子蛋白的含量。
1.3 统计学方法
2 结 果
2.1 IL-36α在烟曲霉菌刺激的HCEC细胞中表达比较
RT-PCR检测结果显示,烟曲霉灭活菌丝刺激HCEC细胞,0、4、8、12、16 h后IL-36α mRNA的表达量分别为1.13±0.42、3.47±0.16、3.59±0.90、4.34±0.73、7.89±0.44,各时间点比较差异具有显著性(F=21.88,P<0.05)。IL-36R mRNA在0、4、8、12、16 h的表达量分别为0.43±0.17、1.21±0.50、6.45±0.17、6.17±0.68、5.46±1.32,各时间点比较差异均具有显著意义(F=92.76,P<0.05)。Western Blot方法检测结果示,0、8、12、24 h时IL-36α蛋白的表达量分别为7.61±0.30、10.04±0.41、10.73±0.42、14.15±0.51,IL-36R蛋白的表达量则分别为2.41±0.24、5.30±0.26、5.98±0.17、6.83±0.16,各时间点比较差异具有显著意义(F=249.74、260.18,P<0.05)。
2.2 IL-36α对烟曲霉感染的HCEC细胞促炎细胞因子表达的影响
各组细胞中IL-8和TNF-α蛋白与mRNA水平比较差异有显著性(F=11.54~95.42,P<0.05);C组中IL-8、TNF-α蛋白与 mRNA的表达水平较B组升高,差异有显著性(P<0.05)。见表2。
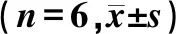
表2 各组HCEC细胞中IL-8、TNF-α蛋白和mRNA表达水平比较
2.3 各组细胞中pNF-κB p65及NF-κB p65蛋白表达的比较
Western Blot方法检测结果显示,D、E、F组中HCEC细胞中pNF-κB p65蛋白的相对表达量分别为3.18±0.35、4.33±0.29、4.72±0.10,差异具有显著性(F=26.51,P<0.05);与D、E组相比,F组中pNF-κB p65蛋白表达水平明显增高(P<0.05)。D、E、F组中NF-κB p65蛋白的相对表达量分别为0.70±0.12、1.28±0.07、1.60±0.08,差异具有显著性(F=37.96,P<0.05);与D组相比,E、F组中NF-κB p65蛋白的表达水平明显升高(P<0.05)。
2.4 各组细胞中IL-36α蛋白以及mRNA表达水平的比较
RT-PCR结果显示,G、H、I组HCEC细胞中IL-36α mRNA相对表达量分别为0.69±0.21、4.31±0.28、1.28±0.46,差异具有显著性(F=70.99,P<0.05);与H组相比,I组IL-36α mRNA表达水平明显下降(P<0.05)。Western Blot实验结果显示,G、H、I蛋白相对表达量分别为1.30±0.07、2.85±0.15、2.10±0.14,差异具有显著性(F=34.26,P<0.05);与H组相比,I组HCEC细胞IL-36α蛋白表达水平明显降低(P<0.05)。
3 讨 论
烟曲霉菌感染引起的真菌性角膜炎是一种严重的感染性眼病,因缺乏有效的治疗方式,致盲率一直居高不下[15-17]。IL-36α是新型细胞因子IL-1家族成员,在多种炎性疾病中与IL-36R结合后激活下游信号通路,诱导促炎因子的产生[4,7,18]。在烟曲霉菌引起的HCEC细胞的感染中,IL-36α表达升高并起到促炎作用,加重了角膜的炎症反应。
本研究结果显示,经烟曲霉菌刺激的HCEC细胞与正常HCEC细胞相比,IL-36α和IL-36R的蛋白及mRNA水平均明显升高。已有研究证实,在正常生理条件下,IL-36α在皮肤、脑、外周血细胞、肺、肠等多种细胞、组织和器官中均有表达,当受到LPS、微生物等病原体刺激后[19-21],如白色念珠菌感染的口腔黏膜上皮等组织中[11],IL-36α表达升高,引起组织炎症反应。本实验结果显示,IL-36α在烟曲霉菌灭活菌丝刺激的HCEC细胞中表达升高,提示IL-36途径可能参与烟曲霉感染引起的免疫炎症反应,IL-36α可能在烟曲霉菌感染的早期免疫反应中起着重要的作用。
本实验进一步检测了经rhIL-36α预处理后,烟曲霉菌感染的HCEC细胞中促炎因子的表达情况。结果显示,rhIL-36α显著上调了烟曲霉菌感染的角膜组织中促炎因子IL-8、TNF-α的表达。IL-8以及TNF-α是免疫反应中重要的趋化因子和炎症因子,可以激活免疫细胞。实验中外源性使用IL-36α重组蛋白增加了烟曲霉菌引起的HCEC细胞促炎因子的产生,进一步说明IL-36α诱导促炎因子的产生并加重烟曲霉菌感染后HCEC细胞中的炎症反应。GUO等[14]的研究证实,IL-36α在铜绿假单胞菌角膜炎中表达显著增高,并促进HCEC细胞分泌多种促炎因子。本实验证明烟曲霉菌的刺激可以引起HCEC细胞当中IL-36α表达水平升高,外源性的rhIL-36α的加入上调了炎症因子的表达,因此在真菌性角膜炎中IL-36α起到促炎作用。
在肾小管上皮细胞中IL-36细胞因子可以通过IL-36R激活NF-κB,在IL-36R基因敲除小鼠肾组织中NF-κB的活化降低[13]。NF-κB是炎症级联反应的关键调节因子,可以快速响应炎性刺激并控制炎症细胞因子的转录(如IL-1β、IL-6、IL-8以及TNF-α)[22-23]。NF-κB的激活涉及自身磷酸化和随后的抑制蛋白IκB蛋白的水解,随后磷酸化的NF-κB易位至细胞核并启动下游炎性递质的转录[24-25]。已有研究证明,诸如烟曲霉等细胞外刺激可促进IκB的水解,然后实现NF-κB易位到细胞核中并与邻近“靶标”基因序列结合,IL-36α可以通过IL-36R激活NF-κB[7,23,26]。另外与IL-36α不同,IL-36Ra是IL-36R的负调控因子,IL-36Ra竞争性结合IL-36R从而抑制IL-36胞内信号的转导[27]。本研究Western Blot方法检测结果显示,与E组相比,F组HCEC细胞中NF-κB p65蛋白的磷酸化水平明显增强,rhIL-36Ra的加入则明显抑制了NF-κB的磷酸化。于急性肾损伤(AKI)模型中,外源性加入IL-36α可以上调肾小管上皮细胞中NF-κB活性,从而促进下游炎症因子的产生[6]。在本实验中,外源性加入人IL-36α重组蛋白显著上调了NF-κB的磷酸化水平,提示IL-36α的促炎作用可能是通过活跃的NF-κB信号途径起作用。
在人外周血单个核细胞(PBMC)中,烟曲霉对于IL-36α的诱导是通过Dectin-1/Syk和TLR4途径介导的[13,28-30]。本次实验中,在烟曲霉菌刺激HCEC细胞之前用Dectin-1中和抗体预处理阻断Dectin-1通路后,RT-PCR及Western Blot方法检测结果表明,Dectin-1中和抗体预处理组烟曲霉菌灭活菌丝刺激引起的IL-36α的表达显著降低。或许可以推断,在HCEC细胞中烟曲霉菌诱导的的IL-36α表达升高可能是通过Dectin-1途径介导的。
总之,本实验的研究结果证明了烟曲霉菌刺激的HCEC细胞通过Dectin-1介导的信号通路提高了IL-36α的表达,并诱导炎症因子加重炎症反应。同时,在HCEC细胞中,IL-36α可通过IL-36R/NF-κB信号通路进一步发挥促炎作用,IL-36α可提高炎症因子的表达,炎症因子TNF-α等的刺激还可以使IL-36α的表达进一步上调,形成正反馈通路,放大炎症反应。
