盘县火腿深度腐败的微生物及挥发性风味化合物表征
2021-05-19母应春
母 雨,苏 伟,*,母应春
(1.贵州大学酿酒与食品工程学院,贵州 贵阳 550025;2.贵州大学 贵州省农畜产品贮藏与加工重点实验室,贵州 贵阳 550025)
干腌火腿是一种传统发酵肉制品,有数千年的消费历史。已经证明干腌火腿富含多种营养物质并具有潜在健康益处[1-2]。盘县火腿是我国著名干腌火腿之一,于2012年获得“国家地理标志”称号[3]。它的加工工艺包括鲜腿老化、腌制、堆码翻压、静置和成熟,周期长达12~24 个月,长时间的成熟和独特的地理环境赋予其鲜明的品质特征。然而,盘县火腿的生产采用自然发酵,且不使用任何防腐剂,其稳定性完全依赖于盐的渗透和成熟过程的脱水。因此,一些腐败微生物很可能在加工早期生长繁殖,并最终导致产品的腐败变质。
干腌火腿的变质是一个长期性、世界性的难题。据报道,西班牙每年有大约3 000万 只火腿腐败变质,造成的经济损失高达数千万美元[4]。干腌火腿常见的腐败类型有“深度腐败”和“静脉缺陷”。其中,“深度腐败”是最重要的一种变质类型,其特征是糊状质地和令人讨厌的臭味,这种臭味常见于邻近骨骼结构的大块肌肉中[5]。研究认为这种类型的腐败是由微生物菌群,特别是细菌造成的,且已基于培养法分离出相应菌株[6]。“静脉缺陷”属于表层腐败,腐败区域通常具有较高的盐含量,已从此类腐败中培养分离出一些嗜盐菌,如肉杆菌(Carnobacterium)、棒状杆菌(Corynebacterium)、弧菌(Vibrio)和海生乳杆菌(Marinilactibacillus)[7-8]。然而,由于可存活但不可培养状态,培养法仅能分离出完整微生物种群的一部分[9]。相比之下,高通量测序可以对复杂的微生物群进行更深入、更精确的评估,已用于揭示干腌火腿的群落组成[10]。此外,由于“深度腐败”的主要缺陷在于异味,采用固相微萃取结合气相色谱-质谱(solid phase microextraction-gas chromatography-mass spectrometry,SPME-GC-MS)法检测腐败火腿的标志性风味。
本研究旨在表征与盘县火腿“深度腐败”有关的微生物和挥发性风味,其丰度和含量可用作确定盘县火腿变质的指标,有助于发现和控制早期的腐败。
1 材料与方法
1.1 材料与试剂
盘县火腿样品(正常和腐败火腿各3 只)由贵州省盘州市火腿加工厂提供,所有样品均取自相同工艺、环境下生产的同一批次火腿。为尽可能减少影响因素,正常火腿取样部位与腐败火腿一致。取样完成后立即装入无菌袋,并置于低温泡沫盒中12 h内送回实验室,贮存于-80 ℃直至分析。
Power Soil®DNA提取试剂盒 美国MP Bio公司;琼脂糖 西班牙Biowest公司;DNA聚合酶 大连宝生物工程有限公司;正反引物 深圳市英俊生物技术有限公司;DNA纯化磁珠 南京诺唯赞生物科技有限公司;MinElute®聚合酶链式反应(polymerase chain reaction,PCR)纯化试剂盒 德国Qiagen公司。
1.2 仪器与设备
Veriti™ 9902 PCR仪 美国ABI公司;Nanodrop 2000超微量分光光度计、Trace1300-TSQ8000 GC-MS联用仪 美国Thermo Fisher Scientific公司;Illumina MiSeq测序仪 美国Illumina公司。
1.3 方法
1.3.1 理化指标的测定
水分含量测定:利用直接干燥法;盐含量测定:采用GB 5009.44—2016《食品中氯化物的测定》方法;水分活度(aw)测定:水分活度仪;pH值测定:pH计。所有实验重复3 次。
1.3.2 高通量测序
1.3.2.1 总DNA提取与PCR扩增
每个样品在无菌条件下取10 g并充分研磨,然后根据说明书使用Power Soil DNA试剂盒提取样品总DNA。DNA的质量和数量以OD260nm/OD280nm和OD260nm/OD230nm的比值进行评估。然后将DNA保存在-80 ℃,直到进一步处理。利用引物(338F:5′-ACTCCTACGGGAGGCAGCA-3′和806R:5′-GGACTACHVGGGTWTCTAAT-3′)结合适配器序列和条形码序列扩增细菌16S rRNA的V3-V4区。
PCR扩增体系的总量为50 μL,包括10 μL缓冲液、0.2 μL Q5 High-Fidelity DNA聚合酶、10 μL高GC增强剂、1 μL核苷酸、正反引物各10 μmol/L和60 ng的基因组DNA。扩增程序为:95 ℃预变性5 min;95 ℃变性1 min,50 ℃退火1 min,72 ℃延伸1 min,共15 个循环;72 ℃扩展7 min。利用VAHTSTM DNA磁珠纯化第1轮PCR扩增产物。第2轮PCR扩增体系为40 μL,包括20 μL 2×Phusion HF MM、8 μL ddH2O、正反引物各10 μmol/L以及第1轮扩增的PCR产物10 μL。扩增程序为:95 ℃预变性30 s;98 ℃变性10 s,65 ℃退火30 s,72 ℃延伸30 s,10 个循环;72 ℃扩展5 min。利用PCR纯化试剂盒对琼脂糖凝胶回收的PCR产物进行纯化,然后用Nanodrop 2000超微量分光光度计定量并按每个样本的测序要求进行混合,最后使用Illumina HiSeq 2500平台对纯化的混合样本进行细菌rRNA基因的高通量测序分析。
1.3.2.2 测序数据处理
根据双端测序之间的overlap关系,利用FLASH v1.2.7软件,通过overlap对每个样品的序列进行拼接,得到的拼接序列即原始序列数据;然后利用Trimmomatic v0.33软件对拼接后的原始数据进行过滤,得到高质量的序列数据;最后,使用UCHIME v4.2软件,鉴定并去除嵌合体序列,得到有效数据。利用QIIME v1.8.0对有效数据在97%的相似度水平下进行聚类、获得操作分类单元(operational taxonomic units,OTU),并基于Silva分类学数据库对OTU进行分类学注释,设置比对阈值为70%。
1.3.3 挥发性风味化合物分析
1.3.3.1 风味化合物的提取与检测
参照Marušić等[11]的方法提取和检测挥发性风味化合物,并略作修改。准确称取5.00 g切碎的火腿样品置于25 mL饱和食盐水中,均质2 min以制备火腿匀浆。取10 mL匀浆置于20 mL顶空瓶中并用PTFE隔膜盖紧,然后使用已老化的50/30 μm DVB/CAR/PDMS萃取头在40 ℃振摇提取180 min。萃取完成后,立即将SPME纤维插入进样口,在230 ℃解吸5 min。
色谱条件:毛细管柱为DB-5MS(30 m×0.25 mm,0.25 μm),载气为氦气,流速为1.0 mL/min,不分流模式。柱升温程序:50 ℃保持5 min,然后以5 ℃/min的速率升至200 ℃,最后以20 ℃/min的速率升至250 ℃并保持10 min。
质谱条件:电子电离源,电子能量为70 eV,传输线和离子源温度为280 ℃和230 ℃,扫描范围m/z50~450,扫描速率为1 scan/s。
1.3.3.2 风味化合物的定性与定量
定性:实验结果与NIST数据库进行比对,仅保留正反匹配度均大于800的化合物。在相同的色谱条件下运行C6~C30正构烷烃混合标品,以计算化合物的保留指数(retention index,RI)。计算公式如下:
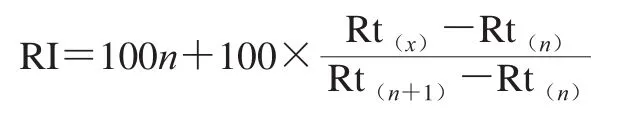
式中:Rt(x)、Rt(n)及Rt(n+1)分别为待测挥发性成分、含n个碳原子正构烷烃及(n+1)个碳原子正构烷烃的保留时间。
定量:峰面积归一化法。
1.4 数据分析
SPSS Statistics 20.0用于数据的统计分析,数据均以表示,利用单因素方差分析确定显著性(P<0.05)。基于获得的OTU表格,利用QIIME计算样品的α多样性,包括丰富度指数(ACE和Chao1)和多样性指数(Shannon和Simpson)。挥发性风味化合物的LEFSe(LDA Effective Size)分析在Galaxy网站上进行(http://huttenhower.sph.harvard.edu/galaxy/)。环境因子与细菌属之间的冗余分析(redundancy analysis,RDA)基于R v3.6.1软件的vegan包执行。基于Pearson相关系数(r>0.7,P<0.05)建立微生物属与挥发性风味物质间的相互关系,并利用Cytoscape v3.2.1软件进行网络可视化。
2 结果与分析
2.1 物理化学特性

表1 正常与腐败盘县火腿理化特性Table 1 Physicochemical characteristics of normal and spoiled Panxian hams
如表1所示,腐败火腿的pH值、aw、水分含量显著高于正常火腿,而NaCl含量显著低于正常火腿(P<0.05)。Blanco等[4]在腐败西班牙火腿中发现了类似的情况。人工上盐易导致盐分布和渗透不均匀,因此低NaCl含量可能与腌制工艺有关。较高的pH值是产品变质的指标之一,腐败火腿中pH值的上升可能与其较低的盐含量有关。据报道,盐质量分数5%~6%即可抑制肌肉组织蛋白酶活力,因此,较低浓度的NaCl导致过度的蛋白水解,从而产生糊状和升高pH值[12]。另外,pH值越高持水能力越强[13],这使得腐败火腿的水分含量高于正常火腿。aw与NaCl含量密切相关,腐败火腿中较低的NaCl含量导致较高的aw,Losantos等[14]报道了aw的下降对腐败干腌火腿中肠杆菌科微生物的抑制作用。
2.2 细菌多样性分析
利用Illumina MiSeq平台从6 个样品中获得282 148 个高质量16S rRNA序列,平均每个样品产生47 024.67 个序列。如表2所示,正常和腐败火腿在OTU数目和丰富度指数上不存在显著差异(P>0.05),但在多样性指数上存在显著差异(P<0.05)。表明腐败盘县火腿中存在的细菌种类可能低于正常火腿。另外,正常和腐败火腿覆盖率均为0.999,表明该抽样方案已经基本覆盖了样本的细菌多样性,数据可用于后续分析。

表2 正常与腐败盘县火腿的α多样性分析Table 2 α-Diversity analysis of bacterial communities in normal and spoiled Panxian hams
为进一步了解正常和腐败火腿的细菌群落结构,在门和属水平上对测序数据进行分类。在门水平上(图1A),鉴定出变形菌门(Proteobacteria)、厚壁菌门(Firmicutes)、放线菌门(Actinobacteria)和拟杆菌门(Bacteroidetes)。其中,厚壁菌门是正常火腿中的优势菌门,而变形菌门主导腐败火腿。在属水平上(图1B),仅显示丰度前10的优势微生物,分别为葡萄球菌属(Staphylococcus)、norank_Enterobacteriaceae、unclassified_Enterobacteriaceae、盐单胞菌属(Halomonas)、沙雷氏菌属(Serratia)、段杆菌属(Brevibacterium)、色盐杆菌属(Chromohalobacter)、涅斯捷连科氏菌属(Nesterenkonia)、Solitalea和盐水球菌属(Salinicoccus)。

图1 正常和腐败盘县火腿在门水平(A)和属水平(B)上的细菌群落组成Fig. 1 Bacterial community structures of normal and spoiled Panxian hams at phylum (A) and genus (B) levels
与大多数干腌火腿一样[15-16],葡萄球菌属是正常火腿中最丰富的。由于较强的外源酶活力,包括蛋白酶、脂肪酶、过氧化氢酶和硝酸盐还原酶[17],凝固酶阴性葡萄球菌被认为是肌肉酶之后导致干腌火腿风味、颜色和质地发展的重要因素[18]。盐单胞菌属是正常火腿中的次要优势菌,与之前的报道一致[19]。在腐败火腿中,肠杆菌科微生物(norank_Enterobacteriaceae、unclassified_Enterobacteriaceae和沙雷氏菌属)占样品总丰度的80%以上。肠杆菌科被认为是各类腐败干腌火腿中的优势菌群,特别是沙雷氏菌属和变形杆菌属(Proteus)[20-21]。Losantos等[14]从腐败的塞拉诺和伊比利亚火腿中分离出液化沙雷氏菌(S. liquefaciens)和奇异变形杆菌(P. mirabilis),并认为它们的蛋白水解能力可能是臭味形成的原因。类似地,观察到肠杆菌科微生物与肌钙蛋白和原肌球蛋白的强烈负相关[6]。
2.3 挥发性风味化合物分析
表3显示正常和腐败盘县火腿的挥发性风味组成。共检出60 种挥发性风味物质,正常火腿39 种,腐败火腿34 种。其中27 种为正常火腿独有,21 种为腐败火腿独有。按种类将60 种风味物质分为醛类(23 种)、酮类(13 种)、醇类(6 种)、烃类(6 种)、含苯化合物(6 种)、酸类(2 种)、含硫化合物(2 种)及含氮化合物(2 种)。

表3 正常与腐败盘县火腿的挥发性风味物质种类和相对含量Table 3 Types and relative contents of volatile flavor compounds in normal and spoiled Panxian hams

续表3
为进一步筛选正常和腐败火腿之间的显著鉴别因子,进行LEFSe分析,阈值设置为LDA>4,结果如图2所示。共鉴定出20 种具有显著差别的鉴别因子,其中正常火腿12 种,腐败火腿8 种。除酸类和含氮化合物外,其余6大类物质在正常和腐败火腿之间存在显著差异。正常火腿含有丰富的醛类和醇类,包括壬醛、己醛、十六醛、辛醛、2-十一烯醛、十五醛、(E)-2-癸烯醛、庚醛和1-辛烯-3-醇;而高含量的烃类、酮类、含苯和含硫化合物是腐败火腿的特征,特别是苯酚、苯乙醛、二甲基二硫醚、1-十五烯和3-甲基丁酸。

图2 正常与腐败火腿中的特征挥发性风味化合物Fig. 2 Characteristic volatile flavor compounds in normal and spoiled Panxian hams
醛类物质可以由脂质氧化和氨基酸的Strecker反应产生,对干腌火腿的整体风味有重要贡献。在正常火腿中,检测到23 种醛,占风味物质总面积84.37%,而在腐败火腿中仅检出5 种,占总面积的6.05%。正常盘县火腿中含量较大的醛为壬醛、己醛和十六醛。其中,壬醛和己醛是许多干腌火腿中最丰富的醛类物质,其低气味阈值有助于增加甜味和青草香气[22];而具有肉香味的十六醛是巴马火腿[23]和伊斯特拉火腿[24]的典型特征。相反,腐败火腿中的酮类物质在种类和含量(11 种,14.75%)上均高于正常火腿(6 种,1.27%)。García等[25]报道了类似的结果,认为伊比利亚火腿中酮类物质的增加与腐败微生物的活动有关。另外,酮也可以通过游离脂肪酸的化学自动氧化形成[26]。
醇类物质的形成与脂质氧化、氨基酸代谢、甲基酮还原和微生物繁殖密切相关。与之前的报道不同[27],醇类物质在正常火腿中的含量高于腐败火腿。醇类物质的嗅闻阈值通常比醛酮类物质低,但由花生四烯酸氧化形成的1-辛烯-3-醇经常从干腌火腿中检出,且具有较低的阈值,被认为是盘县火腿[19]、金华火腿[28]及如皋火腿[29]的特征风味。在本研究中,1-辛烯-3-醇是正常火腿中最丰富的醇,也是正常与腐败火腿之间的鉴别因子。
烃类物质在种类和含量上的差异也有助于区分正常和腐败盘县火腿。正常和腐败盘县火腿中的烃类物质分别占样品风味总面积的0.54%和13.51%。Martín等[27]在未变质(3.98%)和变质伊比利亚火腿(12%)中发现了类似的结果。通常,烃类化合物因其较高的阈值而对火腿风味贡献较小,但一些烯烃类物质可能会影响整体风味。1-十五烯是腐败盘县火腿中的特征化合物,占风味总面积11.05%。据报道,它也是异味薏仁米中最主要的挥发性成分[30]。
含苯化合物是腐败盘县火腿中最主要的风味成分,51.66%的峰面积由这类化合物代表。其中,含量较高的苯酚和苯乙醛是腐败火腿的标志性风味。苯酚是一种具有特殊臭味的化合物,适量的苯酚似乎有助于发酵肉制品的风味[31],但高含量的苯酚会影响金华火腿的风味[32]。同时,苯酚具有毒性,已被世界卫生组织列入致癌物质清单。苯乙醛是一种具有花香的氨基酸衍生物,经常发现于国内外干腌火腿中[33-34]。然而,高含量的苯乙醛已被认为是伊比利亚火腿腐败的特征之一[35]。
与之前研究结果一致[19],在正常盘县火腿中未检出含硫化合物。两种含硫化合物(二甲基二硫醚和二甲基四硫化物)仅存在于腐败火腿中,占风味总面积的6.52%。硫化物代表烧焦和臭鸡蛋的不愉快气味,通常来自于微生物对含硫氨基酸的降解[36]。如图2B所示,二甲基二硫醚被鉴定为腐败盘县火腿的特征风味化合物。尽管二甲基二硫醚已被描述为金华和如皋火腿的主体风味成分[28-29],但这类化合物在变质伊比利亚火腿中的含量远高于未变质火腿[25,35]。
3-甲基丁酸也是腐败盘县火腿的特征风味。在伊比利亚火腿中,3-甲基丁酸的气味被描述为像脚的、酸的和变质火腿的味道,且仅在腐败火腿中检测到[35]。腐败火腿中高含量的3-甲基丁酸可以通过以下两方面解释:1)3-甲基丁醛氧化形成3-甲基丁酸;2)肠杆菌科的高蛋白酶活性促进游离氨基酸的释放,氨基酸通过微生物发酵生成3-甲基丁酸。对于含氮化合物,四甲基吡嗪仅存在于正常火腿中,而N,N-二甲基-4-吡啶仅在腐败火腿中检测到。虽然有研究提出应该将一些吡嗪类化合物视为检测伊比利亚火腿初期腐败的指标,但不包括四甲基吡嗪[27]。
2.4 环境因子对微生物群落的影响
物理化学性质的改变显著影响微生物群落的结构和组成。合适的温度、水分和盐含量不仅有助于火腿独特风味的形成,还可以抑制有害微生物的生长繁殖[37]。因此,应用RDA揭示优势菌属与环境因子间的关系。锐角表示菌属与环境因子之间呈正相关,而钝角表示呈负相关,结果如图3所示。水分含量、aw和pH值与未分类肠杆菌科微生物呈显著正相关,而与沙雷氏菌属(Serratia)的正相关较弱。同时,NaCl浓度显示出对沙雷氏菌属的强烈抑制,这种显著负相关已在腐败伊比利亚火腿中观察到[6]。相反,NaCl浓度与其余优势菌属呈正相关,特别是色盐杆菌(Chromohalobacter)和盐单胞菌(Halomonas)。这两个属的大多数成员具有嗜盐性,经常从高盐发酵食品中分离出来[38-39],具有蛋白酶和脂肪酶活性[40]。据报道,色盐杆菌是韩国酱油品质形成的关键[41],而盐单胞菌的成员具有降解生物胺的能力[42]。正常火腿中最丰富的葡萄球菌与NaCl浓度的正相关较弱,但与水分含量、aw和pH值呈强烈负相关。类似地,最近一项研究揭示了肉类发酵过程中pH值对葡萄球菌群落结构的显著影响[43]。

图3 优势细菌属与环境因子之间的RDAFig. 3 RDA of the relationship between dominant bacterial genera and environmental factors
2.5 优势菌属与挥发性风味化合物之间的网络关系
干腌火腿加工过程中伴随着一系列的生化和酶促反应,包括蛋白质水解、脂质氧化、糖原分解和美拉德反应等,这些反应对火腿风味的形成至关重要。众所周知,肌肉内源酶,特别是组织蛋白酶主导这些反应,而微生物的酶促作用也有助于风味化合物的产生[44]。据报道,微生物或未知来源的挥发性风味物质占伊比利亚火腿总挥发性化合物的5.7%[29]和6.9%[45]。另外,郇延军等[46]认为微生物是影响不同等级金华火腿风味的关键因素。因此,基于Pearson相关系数构建优势菌属与挥发性风味物质之间的相关性网络。如图4所示,代表正常火腿的7 种细菌属和主导腐败火腿的3 种细菌属构成两个单独的网络,分别促进32 种和21 种风味化合物的产生。与图2结果一致,正常火腿以醛类和醇类物质为主,而腐败火腿以酮类、烃类、含苯和含硫化合物为代表。然而,在图4A中观察到苯甲醛和3 种酮的存在。虽然腐败火腿中更高含量的苯甲醛已被报道[27],但这种具有苦杏仁和橡子气味的化合物在干腌火腿中经常发现,并且被认为是伊比利亚火腿的气味活性成分[47]。如图4B所示,2 种未知的肠杆菌科微生物与腐败火腿的5 种特征风味(苯酚、苯乙醛、1-十五烯、3-甲基丁酸和二甲基二硫醚)密切相关,而沙雷氏菌属只与苯酚、苯乙醛和3-甲基丁酸的产生有关。同时,沙雷氏菌属仅占腐败火腿总丰度的8.85%(图1B)。因此,尽管许多研究认为沙雷氏菌属是造成干腌火腿腐败的主要肠杆菌科微生物[6,21],但它可能并不是导致盘县火腿腐败的关键因素。造成这种差异的原因之一可能是此前的研究均采用培养法,大部分微生物无法培养的局限性导致研究者得出值得商榷的结论。有必要应用准确性更高、测序深度更深的宏基因组进行下一步研究。

图4 优势细菌属与挥发性风味化合物的相关性网络Fig. 4 Correlation network between dominant bacterial genera and volatile flavor compounds
3 结 论
本研究揭示了正常与腐败盘县火腿在理化特性、微生物多样性和挥发性风味物质之间的差异,确定了与腐败火腿高度相关的几种特征,即高比例的肠杆菌科和高含量的苯酚、苯乙醛、1-十五烯、3-甲基丁酸及二甲基二硫醚,这对预防和减少盘县火腿的腐败具有重要意义。然而,目前基于16S rRNA的高通量测序未能准确鉴定出主导盘县火腿腐败的微生物。因此,后续研究中,应该使用基于第3代测序的宏基因组进一步在属水平和/或物种水平上表征这些微生物,并利用多组学技术(如蛋白组学、转录组学和代谢组学)验证它们与挥发性风味物质之间的关系。
