人参皂苷Rh2-壳聚糖纳米粒子制备及对A549细胞的抑制作用
2021-05-19张建梅杨晓君胡卫成
顾 倩,周 静,2,张建梅,尚 志,沈 婷,杨晓君,胡卫成,
(1.淮阴师范学院 江苏省区域现代农业与环境保护协同创新中心,江苏 淮安 223300;2.新疆农业大学食品科学与药学学院,新疆 乌鲁木齐 830052)
肺癌具有高发率和高致死率,已经成为当今严重威胁人类健康和生命的恶性肿瘤之一。非小细胞肺癌是最常见的肺癌类型,由基因和环境因素共同作用引发,与吸烟关系密切[1],占所有肺癌病例的80%。非小细胞肺癌对多数抗癌药物呈现出低敏感度,导致通过开发特殊药物治愈非小细胞肺癌的方法很难成功[2]。
人参是一种名贵的药食同源中药材,根茎花果实均可食用,生物活性广泛,有“百草之王”的美称[3]。人参的主要活性成分是人参皂苷,在提升免疫力、抗氧化、抗衰老、降糖降脂[4]等方面有显著功效,广泛应用于保健食品[5]。人参皂苷Rh2是红参提取物的主要活性成分之一,具有抑制肿瘤生长、抗病毒感染[6]等多种药理学活性,能够抑制前列腺癌[7]、结肠直肠癌[8]、脑胶质瘤[9]、肝癌[10]等多种肿瘤细胞的增殖,是一种潜在的抗癌药物。研究发现非小细胞肺癌细胞A549对人参皂苷Rh2具有较高的敏感性[11]。Rh2能够下调周期蛋白水平和激酶活性,上调pRb2/p130的活性,导致A549细胞G1期阻滞,抑制A549细胞增殖、诱导细胞凋亡。人参皂苷Rh2具有C20立体异构(S/R),张春晶等[12]研究表明人参皂苷Rh2具有构效效应,20(S)-Rh2对细胞增殖的抑制作用更为显著。
尽管具有上述生物活性功效,但是人参皂苷Rh2属于脂溶性小分子,故扩散速率快、水溶性较差,且Rh2的生物相容度低、毒副作用大[13],制约了其在临床上的广泛运用。因此,提升Rh2的溶解性和延长体内滞留时间是实际应用Rh2的首要难题。
纳米粒子是微米级的聚合胶体粒子系统,直径在10~500 nm之间[14],已经广泛应用于包载并递送生物活性物质。纳米粒子具有良好的缓释性能,能够增加药物的溶解度,提升药物的稳定性,通过胞吞作用被细胞摄取而增强药物在体内的吸收,提升药物在机体循环中的生物活性[15]。此外,肿瘤的微环境区别于正常细胞,具有高渗透和滞留效应,肿瘤组织血管丰富、通透性强、淋巴回流少,纳米载体因易在特定的微环境中聚集而具有一定的靶向性[16]。
壳聚糖(chitosan,CS)由虾蟹类甲壳素脱乙酰化而成,具有良好的抑菌性、抗病毒性[17],同时有一定的成膜性,可以起到防腐保鲜的作用,用于食品包装中可以提高产品保存品质[18]。研究表明CS能够被人体内的特定酶(如溶菌酶等)水解,具有良好的生物可降解性。此外,CS能够打开上皮组织间的紧密连接而加强渗透作用[19]。肿瘤细胞外环境呈酸性,CS能够在酸性条件下溶解,保证了包载药物在特定的pH值条件下响应性释放[20]。CS纳米粒子能够控制药物释放,提升药物的生物相容性,其来源广泛、价格低廉,已经被广泛应用于构建药物递送载体。制备CS纳米粒子的方法有乳化交联法、离子交联法、溶剂蒸发法等[21]。其中离子交联法最为常用。离子交联法制备工艺简单、反应条件温和,无需有机溶剂和催化剂,且安全无毒。三聚磷酸钠(sodium tripolyphosphate,TPP)的负电荷密度较高,是一种常用的交联剂,CS主链上含有氨基,可提供大量交联位点,两者借助静电作用形成可逆的物理交联,制备的纳米粒子具有较强的交联度,稳定性好[19]。
本研究设计一种纳米药物载体,通过离子交联法制备CS载药纳米粒子,递送人参皂苷20(S)-Rh2,并对其制备条件、结构表征和抗肿瘤活性进行研究,为递送难溶性药物提供新思路。
1 材料与方法
1.1 材料与试剂
(S型)人参皂苷Rh2(相对分子质量为622.87,纯度大于98%) 成都曼斯特生物科技有限公司;CS(脱乙酰度为91.5%) 青岛云宙生物科技有限公司;TPP(相对分子质量为367.86) 上海麦克林生化科技有限公司;非小细胞肺癌细胞A549 武汉大学中国典型培养物保藏中心;MEM培养基、胎牛血清、胰蛋白酶-EDTA、抗生素 加拿大Gibco公司;4’,6-二脒基-2-苯基吲哚(4’,6-diamidino-2-phenylindole,DAPI) 美国Sigma公司;Cy5.5-N-羟基琥珀酰亚胺酯(N-hydroxysuccinimide,NHS) 西安瑞禧生物科技有限公司;3-(4,5-二甲基-2-噻唑基)-2,5-二苯基-2H-四唑溴化物(3-(4,5-dimethylthiazol-2-yl)-2,5-diphenyl-2H-tetrazolium bromid,MTT) 德国Biofroxx公司;所有有机溶剂均为分析纯。
1.2 仪器与设备
Zetasizer Nano ZS90粒度仪 英国Malvern公司;1260高效液相色谱仪 美国Agilent公司;Infinite M200 Pro酶标仪 瑞士Tecan公司;LSM700激光共聚焦显微镜德国Zeiss公司;X’Pert Pro MPD型X射线衍射光谱仪荷兰PANalytical公司;JY88-IIN型超声波破碎仪 宁波新芝生物科技股份有限公司;5810R台式高速冷冻离心机德国Eppendorf公司;JEM-1230透射电子显微镜 日本JEOL公司;Alpha 1-2 LD plus型真空冷冻干燥机 德国Christ公司;BS224S分析天平 北京赛多利斯仪器系统有限公司。
1.3 方法
1.3.1 CS纳米粒子制备及工艺的考察
1.3.1.1 空白纳米粒子的制备
CS粉末溶于体积分数1%乙酸溶液,搅拌溶解,配制成1 mg/mL CS溶液,用2 mol/L NaOH溶液调节pH值至5左右。分别称取0.5、0.25、0.125、0.1 mg TPP溶于与上述CS溶液等体积的超纯水中,将其以20 滴/min的速率滴加到CS溶液中,待TPP溶液全部滴加完毕后,搅拌交联反应30 min。反应结束过0.45 μm滤膜,冷冻干燥,4 ℃保存。
1.3.1.2 空白纳米粒子制备工艺的筛选
按照1.3.1.1节方法,固定其他反应条件,改变m(CS)∶m(TPP)(2∶1、4∶1、8∶1、10∶1)(固定CS分子质量为50 kDa)、CS的分子质量(50、80、212 kDa)(固定m(CS)∶m(TPP)为4∶1),制备空白纳米粒子,探究CS分子质量、m(CS)∶m(TPP)对纳米粒子粒径、Zeta-电位等成球特性的影响。
1.3.1.3 载药纳米粒子投药量的筛选
称取4 mg CS,溶于4 mL体积分数1%乙酸溶液,待CS全部溶解后,用2 mol/L NaOH溶液调节pH值至5。称取0.25、0.5、0.75、1 mg的人参皂苷Rh2溶于500 μL无水甲醇,以20 滴/min的速率滴加到CS溶液中。滴加完毕后,逐滴加入等体积的1 mg/mL TPP溶液,搅拌交联反应30 min,制成CS-Rh2-TPP纳米粒子。反应结束后溶液过0.45 μm滤膜,冷冻干燥,置于4 ℃保存。
1.3.2 纳米粒子的粒径、Zeta-电位的测定
取1.5 mL左右样品溶液,过0.22 μm微孔滤膜,采用Zetasizer Nano ZS90粒度仪测定粒径和Zeta-电位。
1.3.3 载药量与包封率的测定
采用高效液相色谱法测定CS载药纳米粒子中包载的人参皂苷Rh2质量浓度。称取冻干的载药纳米粒子样品溶解于蒸馏水,制备成1 mg/mL溶液,超声15 min,使人参皂苷Rh2充分释放,离心后取上清液过0.22 μm微孔滤膜,高效液相色谱法检测其质量浓度。色谱条件:ZORBAX SB-C18反向色谱柱(3.0 mm×50 mm,1.8 μm);流动相为体积分数65%乙腈溶液;柱温为35 ℃;运行时间为20 min;进样量为10 μL。结合标准曲线换算Rh2质量,分别按式(1)、(2)计算载药量和包封率。

式中:m1为纳米粒子中包载的Rh2质量/μg;m2为载药纳米粒子的质量/μg;m3为Rh2的总投药质量/μg。
1.3.4 CS载药纳米粒子的结构表征
1.3.4.1 透射电子显微镜观察微观形态
取一滴样品溶液置于碳包覆铜栅上,磷钨酸负染,空气干燥后用JEM-1230型透射电子显微镜进行观察。
1.3.4.2 原子力显微镜观察微观形态
取5 μL样品溶液置于云母片上,室温下干燥,用NTEGRA Prima型原子力显微镜观察样品的表面形貌,经NanoScope Analysis软件分析获得图像。
1.3.5 X射线衍射光谱分析晶型变化
采用X射线衍射仪分别对人参皂苷Rh2、CS及CS-Rh2-TPP载药纳米粒子冻干粉末进行光谱扫描分析,扫描角度范围5°~90°,扫描速率为2(°)/min。
1.3.6 体外细胞毒性实验
1.3.6.1 细胞培养
在含体积分数5% CO2、37 ℃及饱和相对湿度条件下,用含10%(质量分数,下同)胎牛血清、1%青霉素和链霉素的MEM培养基培养人非小细胞肺癌A549细胞,细胞密度达到80%~90%时,按体积比1∶4进行传代培养。取对数生长期、生长状态良好的细胞用于实验。
1.3.6.2 MTT测试
A549细胞经胰酶消化30~40 s后,加入适量MEM培养基轻轻吹打成细胞悬液,台盼蓝染色后在倒置显微镜下观察计数,以每孔2×105个细胞的密度接种于96 孔板,在CO2培养箱(37 ℃、体积分数5% CO2)中培养。其中,空白组加培养基,处理组每个孔加入不同质量浓度(5、10、20、40 μg/mL)的人参皂苷Rh2和CS-Rh2-TPP(质量浓度以Rh2为准)溶液孵育。24 h后,弃除培养基,每孔加入100 μL MTT溶液,培养4 h,加100 μL终止液继续培养16~20 h后于酶标仪550 nm波长处测定光密度值。按照式(3)计算细胞增殖抑制率。
式中:OD1为实验组OD值;OD2为空白组OD值。
1.3.7 A549细胞对纳米粒子的摄取实验
1.3.7.1 包载荧光探针纳米粒子的制备
称取一定量的Cy5.5-NHS溶于无水甲醇,制备成1 mg/mL的荧光探针储备液,避光4 ℃保存。荧光纳米粒子的制备方法参考1.3.1.3节载药纳米粒子的制备,调节溶液pH值至5附近,向溶液中逐滴滴加荧光探针储备液50 μL,保持避光。
1.3.7.2 细胞摄取
取对数生长期A549细胞以5×104个/孔接种于24 孔板中,培养16~20 h。空白对照组加新鲜MEM培养基,3 个处理组加5 μL CS-Rh2-TPP溶液,分别处理1、3、6 h。磷酸盐缓冲液清洗后以质量分数4%多聚甲醛室温固定15 min,再次清洗后加0.5% Triton X-100透化处理10 min,清洗后用含DAPI的抗猝灭封片剂封片,避光保存。在激光共聚焦显微镜下观察不同孵育时间下细胞对纳米粒子的摄取情况。
1.4 数据处理与分析
采用SPSS 19.0统计软件进行数据分析,结果以平均值±标准差表示,组间差异采用单因素方差分析比较,P<0.05表示差异显著。
2 结果与分析
2.1 m(CS)∶m(TPP)对纳米粒子成球特性的影响

表1 CS/TPP不同质量比对纳米粒子粒径和Zeta-电位的影响Table 1 Effect of CS-to-TPP mass ratio on size and zeta potential of nanoparticles
由表1可知,在等体积反应体系中,纳米粒子粒径随着CS添加量的增加而逐渐减小。这是由于溶液中CS添加量较少时,CS与TPP交联形成疏松的结构,在水溶液中的粒径较大;随着CS添加量的增加,未中和的氨基数量增多,导致更强的分子内交联,使得纳米粒子的粒径逐渐减小[22]。如果粒子的交联程度过高,药物释放会受阻,不利于药物缓释。当m(CS)∶m(TPP)较低时(2∶1),过量的TPP使得更多的CS参与单个纳米粒子的形成,纳米粒子表面电荷密度较低,无法维持大颗粒的稳定性,从而导致颗粒沉淀。
Zeta-电位与胶体分散体系的稳定性成正比,粒子表面电势能够反映纳米分散体系的物理稳定性[23]。当表面电势较高时,单个纳米粒子之间同种电荷相互排斥,保持稳定,可以有效防止聚集沉淀,且带正电荷的胶体粒子能够通过与黏膜表面带负电荷的粒子相互作用提升生物利用度。CS与TPP在质量比4∶1条件下的Zeta-电位在25 mV左右,带正电荷,相比于其他质量比条件下制备的纳米粒子以更稳定的状态存在,因此后续实验在该条件下开展。
2.2 CS分子质量对纳米粒子成球特性的影响
如表2所示,随着CS分子质量的增加,纳米粒子的粒径呈现增加的趋势。这是由于CS主链上存在大量的氨基和羟基基团,在水溶液中存在较强的氢键和静电相互作用。低分子质量CS在特定的质量浓度下,分子内氢键的吸引力和静电相互作用产生的排斥力处于一个平衡的状态,易形成单个的纳米粒子。高分子质量CS具有更多的分子间氢键,使得表面张力大于低分子质量CS。在其他条件保持不变的情况下,溶液体系的表面张力越小,纳米粒子的粒径越小[24]。

表2 不同CS分子质量对纳米粒子粒径和Zeta-电位的影响Table 2 Effect of the molecular mass of chitosan on size and zeta potential of nanoparticles
纳米粒子在体内的分布取决于其粒径[25],粒径较小的纳米粒子在递送药物至靶组织或靶细胞时通常具有更高的效率,所以选取分子质量为50 kDa的CS进行后续实验,以提高所载药物的利用度。
2.3 投药量对载药纳米粒子成球特性的影响

表3 不同投药量对纳米粒子粒径、Zeta-电位、载药量和包封率的影响Table 3 Effect of Rh2 levels on size, zeta potential, encapsulation and loading efficiencies of nanoparticles
如表3所示,纳米粒子粒径随Rh2投药量的增加而增大。粒径影响纳米粒子在体内的分布,不同投药量制备的CS纳米粒子粒径在129~353 nm之间,能够通过肿瘤组织的高渗透和长滞留效应聚集在病变部位附近。
Zeta-电位是评估胶体分散体系稳定性的重要指标,一般来说,对于分散稳定的胶体溶液,理想的表面电势的绝对值应大于30 mV[25]。纳米粒子表面电势越高越稳定,正电荷能够增强纳米粒子对组织的黏附性和渗透性[26]。如表3所示,不载药的CS纳米粒子Zeta-电位为26.90 mV,随着投药量的增加,Zeta-电位明显增加,绝对值均大于30 mV,表明包载药物后CS纳米粒子具有良好的分散性[27]。
当CS与人参皂苷Rh2的质量比从8∶0.5减少至8∶1.5时,载药量从1.70%增加到了7.89%,包封率从18.95%增加到了49.54%,表明投药量影响药物的载药量和包封率,这时药物主要以包埋的方式存在于纳米粒子内部;当CS与Rh2的质量比从8∶1.5减少至8∶2时,载药量和包封率增幅不大,而粒径从(222.70±17.34)nm增加到了(353.27±7.17)nm,这可能是由于药物负载过多,多余的药物吸附在CS纳米粒子表面,引起纳米粒子粒径突然增加,纳米粒子不能维持较小的表面张力,容易引起聚集沉淀[28]。所以一味地增加投药量,并不能获得更高的包封率。综合考虑粒径、包封率,为利于药物运载,选择m(CS)∶m(Rh2)∶m(TPP)=8∶1.5∶2的比例进行后续研究。
2.4 载药纳米粒子的粒径与Zeta-电位分布

图1 CS-Rh2-TPP载药纳米粒子的粒径(A)和Zeta-电位(B)分布Fig.1 Size (A) and zeta potential (B) distribution of CS-Rh2-TPP nanoparticles
如图1A所示,载药纳米粒子粒径呈正态分布,具有良好的分散性和稳定性。结合表3和图1B可知,载药纳米粒子较空白纳米粒子有较高的Zeta-电位,正电荷间的排斥作用保证了纳米粒子具有较好的稳定性,即较低的分散度。
2.5 载药纳米粒子形态观察结果
2.5.1 透射电子显微镜形态观察结果

图2 CS-Rh2-TPP载药纳米粒子透射电子显微镜图Fig.2 CS-Rh2-TPP nanoparticles observed by transmission electron microscopy
如图2所示,载药纳米粒子呈圆球形或类球形,分布均匀,无明显的黏连现象。可能由于粒度仪测量的是纳米粒子水合状态下的尺寸,而透射电子显微镜的图像是在样品干燥状态下获得的,所以透射电子显微镜观察到的粒径比粒度仪测量到的粒径尺寸要小一些[29]。
2.5.2 原子力显微镜形态观察结果
原子力显微镜具有纳米级的分辨率,为非破坏性成像,是表征纳米水平粒子表面拓扑结构的有力工具,被广泛用于生物大分子及高分子的形态观察[30]。图3和图4分别为CS-Rh2-TPP原子力显微镜的二维和三维图像。载药纳米粒子呈圆球形,分散均匀,与透射电子显微镜结果一致;载药纳米粒子平均直径在200 nm左右,与粒度仪测定结果一致,符合肿瘤靶向药物递送载体的要求。

图3 原子力显微镜CS-Rh2-TPP载药纳米粒子二维图像Fig.3 2D atomic force microscopic image of CS-Rh2-TPP nanoparticles
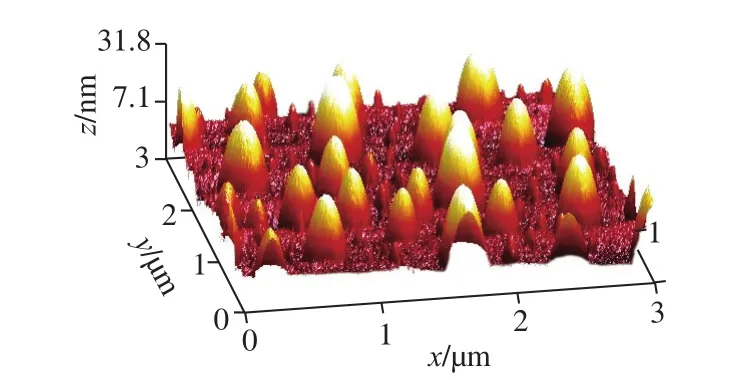
图4 原子力显微镜CS-Rh2-TPP载药纳米粒子三维图像Fig.4 3D atomic force microscopic image of CS-Rh2-TPP nanoparticles
2.6 纳米粒子X射线衍射分析结果
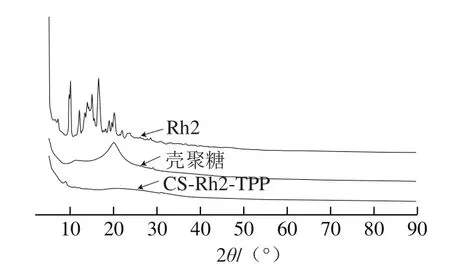
图5 人参皂苷Rh2、CS、CS-Rh2-TPP纳米粒子的X射线衍射图Fig.5 X-ray diffraction curves of ginsenoside Rh2, chitosan,and CS-Rh2-TPP
如图5所示,CS的X射线衍射显示在2θ为20.16°处有一个明显的特征峰,制备成球后,该特征峰消失;且2θ为27.72°、12.06°处特征峰强度和位置发生改变,可能是由于交联过程中CS晶型结构破坏[31]。药物Rh2呈现许多尖锐的晶体衍射峰,在CS-Rh2-TPP纳米粒子体系中,衍射图谱中没有出现明显的药物晶体衍射峰。上述结果表明Rh2不是简单地与CS混合在一起,而是以无定形的形式存在于CS纳米微粒中,形成了固相包合物。
2.7 细胞毒性实验分析结果
如图6所示,随着给药质量浓度的增加,游离Rh2和CS-Rh2-TPP载药纳米粒子对A549细胞的增殖抑制作用增强。在各个质量浓度条件下,CS-Rh2-TPP载药纳米粒子较游离的Rh2呈现出更高的细胞毒性,这可能是载药纳米粒子对药物的持续释放引发的。游离的Rh2是通过自由扩散进入细胞发挥作用的,CS的生物黏附性能够促进细胞摄取药物,将纳米粒子递送至胞内缓慢释放Rh2[32]。Chen Chao等[20]研究指出CS纳米粒子可能通过内吞作用被细胞摄取,质子化的CS能够通过静电相互作用与细胞膜上的糖萼相互作用,加速纳米粒子的内化过程,提高包载药物的渗透性和细胞毒性。

图6 不同质量浓度的人参皂苷Rh2和CS-Rh2-TPP载药纳米粒子对A549细胞的毒性Fig.6 Cytotoxicity of different concentrations of Rh2 and CS-Rh2-TPP on A549 cells
2.8 A549细胞对纳米粒子的体外摄取结果
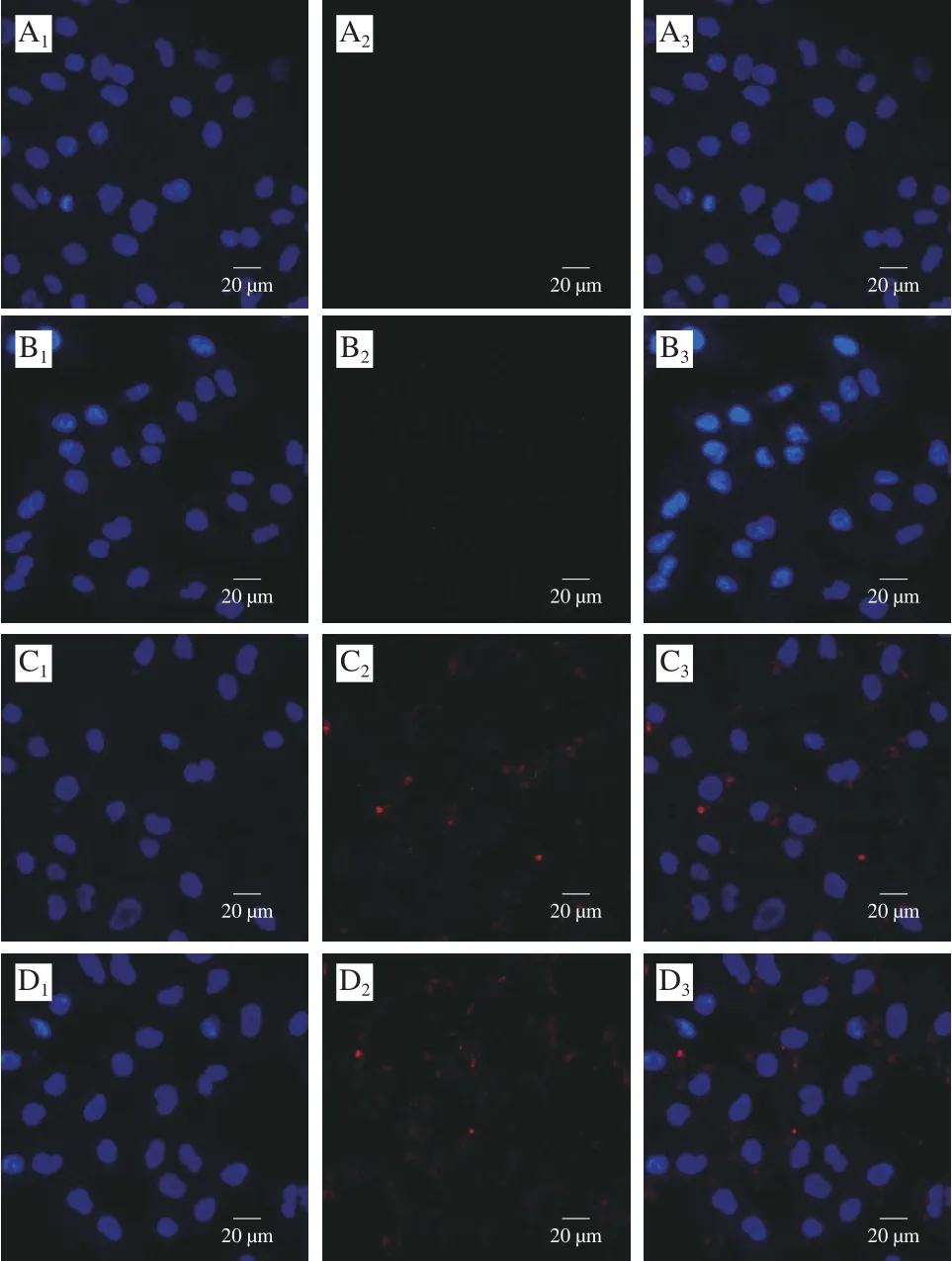
图7 A549细胞对CS-Rh2-TPP载药纳米粒子的摄取Fig.7 Cellular uptake of CS-Rh2-TPP nanoparticles by A549 cells
在激光共聚焦显微镜下,CY5.5-NHS标记的纳米粒子呈红色荧光,DAPI标记细胞核呈蓝色荧光。如图7所示,相对于空白对照组,药物处理过的A549细胞核周围出现红色荧光,说明纳米粒子能够内化进入细胞;孵育1 h后,细胞核附近荧光极其微弱,红色荧光随着孵育时间的延长不断增强,表明更多的纳米粒子被摄取进入细胞,摄取过程呈时间依赖型。
3 结 论
本研究选用CS为载体,通过离子交联法构建了CS-Rh2-TPP纳米粒子,实现对人参皂苷Rh2的包载,以提升药物的溶解性和生物活性。实验通过优化CS、TPP质量比,CS的分子质量以及投药量等制备工艺,得到了粒径可控、性能稳定的纳米粒子。CS-TPP纳米粒子包载Rh2后,粒径和Zeta-电位发生变化,当载药量适当时,纳米粒子呈圆球形,结构规整、分布均一,具有较高的载药量和包封率。X射线衍射图谱表明药物被成功地包被于纳米粒子中。体外细胞实验结果表明CS-Rh2-TPP纳米粒子能够被细胞吞噬摄取,较游离的药物具有更强的细胞毒性,综上,该纳米粒子有望成为肿瘤治疗中递送Rh2的理想载体。
