一水肌酸及共轭亚油酸对大鼠肌纤维相关基因和酶活性的影响及机理
2021-05-19李慧姣侯艳茹赵雅娟白艳苹赵丽华
苏 琳,李慧姣,侯艳茹,赵雅娟,白艳苹,孙 冰,赵丽华,靳 烨
(内蒙古农业大学食品科学与工程学院,内蒙古 呼和浩特 010018)
肌纤维的生长发育是决定畜肉产量和品质的重要因素,而纤维类型的异质性是动物肌肉组织的重要特征[1]。根据肌球蛋白重链(myosin heavy chain,MyHC)的多态性可将肌纤维划分为4 种肌纤维类型。I型(慢速氧化型肌纤维)肌纤维线粒体数量较多,具有较高的肌红蛋白含量及有氧代谢酶活力,但ATPase活性较低,故收缩速率慢且持久;IIa型(快速氧化型肌纤维)肌纤维含有一定数量的肌红蛋白,糖原含量较高,具有有氧代谢和糖酵解代谢两种供能途径;IIb型(快速酵解型肌纤维)肌纤维线粒体数量少,糖原含量高,ATPase活性高,糖酵解酶活力高,收缩速率快且短;IIx型(中间型肌纤维)肌纤维的线粒体数量、肌红蛋白含量、一系列酶活性以及代谢和收缩特性均介于IIa型和IIb型肌纤维之间。因此当氧化型肌纤维比例高时,肌肉的肉色、pH值、大理石纹评分和肌内脂肪含量均较高,肌肉细嫩,保水性能较高,肉质好[2-3]。
一水肌酸(creatine monohydrate,CMH)一般在动物的肝脏或胰腺中由甘氨酸、精氨酸和蛋氨酸合成,机体中约95%的肌酸储存在骨骼肌中。夏伟光等[4]认为在肉鸡饲粮中补充肌酸对肉鸡的生长发育尤其是骨骼肌的生长发育具有重要作用;其主要机理是饲粮中添加CMH对肉鸡骨骼肌能量代谢的影响可能与一磷酸腺苷活化蛋白激酶(AMP-activated protein kinase,AMPK)的激活有关。而共轭亚油酸(conjugated linoleic acid,CLA)是一类具有共轭双键亚油酸各种构象和位置异构体的总称。有研究者发现,在妊娠母猪日粮中添加CLA,所产仔猪慢肌纤维比例更高,MyHC I、MyoG和MyoD基因表达量升高,推测CLA影响猪生长发育早期肌肉形成和肌纤维类型[5]。
AMPK被称为细胞的“能量监测器”,能促进线粒体生物合成及氧化型肌肉表型的代谢变化[6]。目前,AMPK激活的途径主要有以下3 种:运动激活、激活剂以及特殊饲料诱导激活[7]。营养是保证动物肌肉发育的基础,如何通过饲粮营养途径改善肉质是人们较为关注的问题。因此,本实验用CMH和CLA饲喂大鼠,并对AMPK活力及肌纤维相关基因mRNA相对表达量进行测定,以探寻饲粮添加CMH和CLA对大鼠肌纤维类型组成的影响,及其与AMPK代谢通路的关系。
1 材料与方法
1.1 材料与试剂
CMH、CLA(异构体c9,t11和t10,c12质量分数分别为28.5%和30%) 青岛澳海生物有限公司。
RNAiso Plus RNA提取裂解液、PrimeScript™ RT Reagent Kit with gDNA Eraser (Perfect Real Time)反转录试剂盒、SYBR®Premix ExTaq™ II实时荧光定量检测试剂盒 宝生物工程(大连)有限公司;DNase/RNase-Free无菌水 天根生物技术(北京)有限责任公司;Tris-HCl(分析纯) 美国Amresco公司;乳酸脱氢酶(lactic dehydrogenase,LDH)、琥珀酸脱氢酶(succinate dehydrogenase,SDH)、苹果酸脱氢酶(malate dehydrogenase,MDH)活力检测试剂盒 南京建成生物工程研究所。
1.2 仪器与设备
CFX96™实时定量聚合酶链式反应(polymerase chain reaction,PCR)仪、凝胶成像分析系统 美国Bio-Rad公司;NanoDrop2000核酸蛋白分析仪 美国Thermo Fisher Scientific公司;Veriti96 Well Thermal Cycler PCR仪美国Applied Biosystems公司;水平电泳槽、BG-power 3500型稳压稳流电泳仪 北京百晶生物技术有限公司;5417R低温台式冷冻离心机 德国Eppendorf生物公司;TU-1810紫外-可见分光光度计 北京普析通用仪器有限责任公司;LRH-250生化培养箱 上海一恒科学仪器有限公司;XHF-DY高速分散器 宁波新芝生物科技股份有限公司;PB-10 pH计 北京赛多利斯仪器系统有限公司;ELX800型酶标仪 美国Bio-Tek Instruments公司。
1.3 方法
1.3.1 实验动物分组与样品采集
选取符合实验要求的3 周龄健康雌性Wistar大鼠40 只(购自内蒙古大学动物实验中心,生产许可证号:SCXK(蒙)2016-0001,使用许可证号:SYXK(蒙)2020-0002),分5 组进行饲养。分组如下:对照组,饲喂基础饲料;CMH低剂量组,饲喂0.5%(以基础饲料质量计,下同)CMH+基础饲料;CMH高剂量组,饲喂1% CMH+基础饲料;CLA低剂量组,饲喂0.5% CLA+基础饲料;CLA高剂量组,饲喂1% CLA+基础饲料。将大鼠分别置于40 个笼中,于相对湿度(55±5)%、温度(22±2)℃,每12 h明暗交替的环境中,持续饲喂4 周。
大鼠日粮基础饲料组成配比为:玉米43.15%(质量分数,下同)、小麦粉23.59%、大豆粕18.21%、麸皮11.78%、食盐0.28%、石粉0.83%、豆油0.49%、酵母0.22%、预混料1.00%。主要营养水平为:粗蛋白质量分数9%、粗脂肪质量分数23%、碳水化合物质量分数68%、代谢能计算值为14.21 MJ/kg。
大鼠饲喂4 周后,麻醉、断颈处死,3 min内迅速脱皮,取完整的腓肠肌切分成若干份迅速放入标记好的无酶无菌冻存管中,并立即放入液氮速冻,置于-80 ℃冰箱保存备用。
1.3.2 实验大鼠生长性能的测定
整个实验周期记录大鼠体质量增长情况和日摄入量,并计算大鼠日增体质量。
1.3.3 AMPK活力的测定
采用生物素双抗体夹心酶联免疫吸附法测定样品中p-AMPK蛋白含量,反映AMPK磷酸化水平。AMPK活力以p-AMPK蛋白质量浓度表示,即p-AMPK蛋白质量浓度越高,磷酸化程度就越高,相应AMPK活力就越高。
1.3.4 肌纤维相关基因mRNA相对表达量的测定
1.3.4.1 总RNA提取及引物设计
用RNAiso Plus RNA提取裂解液对肌肉组织的总RNA进行提取。利用核酸蛋白分析仪检测所提取总RNA浓度和纯度(A260nm/A280nm);采用质量分数1%的琼脂糖凝胶电泳检测完整性。将提取的RNA质量浓度稀释为500 ng/μL,按照反转录试剂盒说明书进行反转录操作,合成cDNA,置于-20 ℃冰箱备用。实验所需大鼠引物序列参照文献[8-9],由艾博生物技术有限公司设计合成。具体序列如表1所示。

表1 实时定量PCR引物Table 1 Primer sequences used for real-time polymerase chain reaction
1.3.4.2 实时荧光定量PCR检测
采用嵌合荧光法,以合成的cDNA为模板,使用实时荧光定量试剂盒进行扩增。管家基因和目的基因分别做3 个平行和2 个阴性对照。反应体系:SYBR®Premix ExTaq™ II 12.5 μL;上下游引物各1.0 μL;DNA模板(10 ng/μL)2.0 μL;dH2O 8.5 μL;共25.0 μL。实时荧光定量PCR条件:95 ℃预变性30 s;95 ℃变性5 s,60 ℃退火30 s,72 ℃延伸30 s,共35 个循环;72 ℃延伸10 min。产物保存于4 ℃冰箱。采用2-ΔΔCt法计算目的基因相对表达量,计算公式[10]如下。

1.3.5 相关代谢酶活力的测定
LDH、SDH、MDH活力的测定分别按照相应检测试剂盒说明书步骤进行操作,结果以蛋白质量计。
1.4 数据统计与分析
利用SPSS 20.0软件进行数据统计分析,结果均以平均值±标准差表示。用单因素方差分析法进行显著性差异分析,用Preason’s法进行相关性分析,采用t检验评估相关系数。当P<0.05时,表示差异显著。
2 结果与分析
2.1 饲粮添加CMH和CLA对大鼠生长性能的影响
由图1可知,饲粮添加CMH和CLA后,CMH低、高剂量组大鼠的生长速率高于对照组,而CLA低、高剂量组则低于对照组,但各组间无明显差异。由图2可知,饲粮添加CMH和CLA后,大鼠的日摄入量较对照组均显著降低(P<0.05),但CMH低、高剂量组和CLA低、高剂量组间无显著差异(P>0.05)。已有研究发现,饲粮添加CLA对猪平均日增体质量无显著影响,但总体来说,日摄入量随着CLA添加量的增加呈线性下降[11],这与本实验研究结果一致,可能是因为随着CLA添加量的增加,饲粮能量也在增加,当饲粮能量大于大鼠需要量时,会影响采食量,进而使得日摄入量降低。
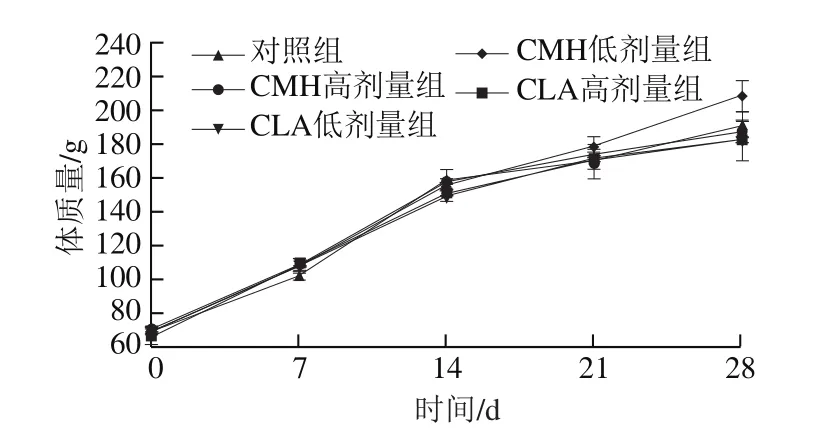
图1 饲粮添加CMH和CLA对大鼠体质量的影响Fig.1 Effect of CMH and CLA on body mass of rats

图2 饲粮添加CMH和CLA对大鼠日摄入量的影响Fig.2 Effects of CMH and CLA on daily feed intake in rats
2.2 饲粮添加CMH和CLA对大鼠肌纤维类型组成的影响
Chang等[12]根据肌纤维特有的MyHC类型将猪肌纤维分为4 种,并研究了猪骨骼肌MyHC I、MyHC IIa、MyHC IIb和MyHC IIxmRNA的表达。建立在MyHC表达基础上的分子分型较组织化学评定更为准确、可靠[13]。因此,本实验在大鼠基础饲料中添加不同剂量CMH和CLA,研究大鼠腓肠肌中肌纤维MyHCmRNA相对表达量变化。

图3 饲粮添加CMH和CLA对大鼠腓肠肌MyHC mRNA相对表达量的影响Fig.3 Effects of CMH and CLA on MyHC mRNA expression in rat gastrocnemius
由图3可知,与对照组相比,CMH低剂量组MyHC IIa及CMH低、高剂量组MyHC IIbmRNA相对表达量显著增加(P<0.05);同时各实验组MyHC IIxmRNA相对表达量降低,且CMH低、高剂量组间差异不显著(P>0.05)。因此,饲粮添加CMH增加了大鼠腓肠肌MyHC IIa、MyHC IIbmRNA相对表达量,且低剂量的CMH对肌纤维类型组成的影响较高剂量更为明显。门小明等[14]研究表明,日粮中添加0.5% CMH能显著降低猪背最长肌MyHC IIamRNA相对表达量,与本实验结果相反,造成此差异的原因可能是因为动物的品种、添加量、肌肉部位等因素的不同。
饲粮添加CLA有增加MyHC ImRNA相对表达量的趋势,其中CLA高剂量组显著高于对照组(P<0.05)。CLA低、高剂量组MyHC IIamRNA相对表达量均显著高于对照组(P<0.05)。与对照组相比,CLA低、高剂量组MyHC IIb、MyHC IIxmRNA相对表达量均有所降低,但仅CLA低剂量组MyHC IIxmRNA相对表达量发生显著变化(P<0.05),CLA低、高剂量组间MyHC IIa、MyHC IIbmRNA相对表达量差异不显著(P>0.05)。因此,饲粮添加CLA可以增加大鼠腓肠肌氧化型肌纤维的表达,降低酵解型肌纤维的表达,提示饲粮添加CLA可以促进肌纤维由酵解型向氧化型转变,并且与添加CMH相反,高剂量的CLA对于肌纤维类型组成的影响较低剂量更明显。有研究指出,在生长育肥猪日粮中添加1.5%的CLA,可显著提高MyHC I和MyHC IIa的mRNA相对表达量,同时显著降低MyHC IIb和MyHC IIx的mRNA相对表达量[15]。Huang等[16]也发现,饲粮添加CLA能显著提高育肥猪肌肉中MyHC I和MyHC IIa的mRNA相对表达量,降低MyHC IIxmRNA相对表达量,但对MyHC IIbmRNA相对表达量影响不显著。以上研究结果与本实验研究结果一致,即饲粮添加CLA对MyHC I和MyHC IIa型肌纤维有积极影响。
2.3 饲粮添加CMH和CLA对大鼠腓肠肌LDH、SDH、MDH活力的影响
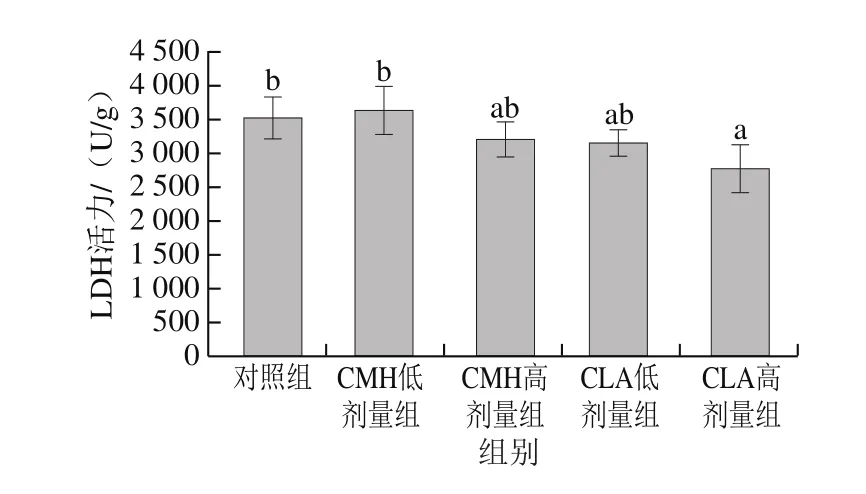
图4 饲粮添加CMH和CLA对大鼠腓肠肌LDH活力的影响Fig.4 Effects of CMH and CLA on LDH activity in rat gastrocnemius

图5 饲粮添加CMH和CLA对大鼠腓肠肌SDH活力的影响Fig.5 Effects of CMH and CLA on SDH activity in rat gastrocnemius

图6 饲粮添加CMH和CLA对大鼠腓肠肌MDH活力的影响Fig.6 Effects of CMH and CLA on MDH activity in rat gastrocnemius
不同肌纤维类型组成的肌肉,其能量代谢类型也存在差异,氧化型肌纤维中线粒体含量丰富,有较高活性的有氧代谢酶,主要通过有氧代谢途径供能;酵解型肌纤维中线粒体含量较少,但含有较高活性的酵解型酶,主要通过糖酵解方式供能[17-18]。LDH在糖酵解过程中起着重要作用,是糖酵解产生乳酸的催化酶,其活性高低能够反映细胞内无氧酵解的活跃程度[19]。由图4可知,与对照组相比,饲粮添加高剂量CMH、CLA可以降低大鼠腓肠肌中LDH活力,其中CLA高剂量组与对照组差异显著(P<0.05)。说明饲粮添加CMH和CLA后,大鼠腓肠肌酵解酶活力减弱。SDH和MDH是葡萄糖有氧氧化过程中的限速酶,可以反映线粒体有氧代谢程度,评价肌肉氧化活性[20]。由图5可知,CMH低剂量组和CLA低、高剂量组SDH活力均显著高于对照组(P<0.05),由图6可知,CLA低剂量组MDH活力显著高于对照组(P<0.05),总体来看,饲粮添加CMH和CLA后,大鼠腓肠肌SDH和MDH活力均有不同程度的提高,这说明大鼠腓肠肌氧化酶活力升高。这与添加CMH和CLA后氧化型肌纤维比例升高、酵解型肌纤维比例下降这一结果一致。
2.4 饲粮添加CMH和CLA对大鼠腓肠肌AMPK活力的影响
有研究表明,饲粮添加CMH可以激活AMPK信号通路,并降低糖酵解酶活性[21],添加不饱和脂肪酸能够提高猪肌肉中AMPK的表达,增加氧化型肌纤维的比例[8]。AMPK在肌肉能量代谢方面发挥重要作用,与肌纤维类型转化密切相关。AMPK基因缺陷型小鼠肌纤维类型在由酵解型向氧化型转变时会受到阻碍[22],这表明AMPK对氧化型肌纤维有正反馈作用。侯艳茹等[23]研究表明不同的饲喂环境会导致苏尼特羊背最长肌AMPK活性不同。也有研究表明,不同肌肉中(如比目鱼肌、腓肠肌、四头肌)因I、IIa、IIb型和IId/x型肌纤维比例差别较大,AMPK活性也有较大差异[24]。因此,在大鼠基础饲料中添加不同剂量的CMH和CLA后,测定大鼠腓肠肌AMPK活力变化。
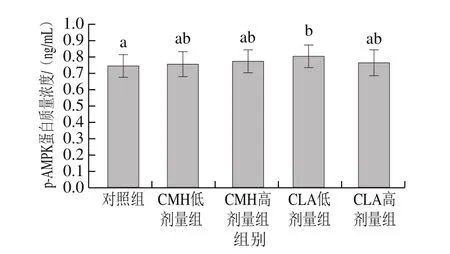
图7 饲粮添加CMH和CLA对大鼠腓肠肌AMPK活力的影响Fig.7 Effects of CMH and CLA on AMPK activity in rat gastrocnemius
由图7可知,饲粮添加CMH和CLA后,CMH和CLA低、高剂量组大鼠腓肠肌AMPK活力均高于对照组,且CLA低剂量组显著高于对照组(P<0.05)。有报道称,日粮添加多不饱和脂肪酸可以促进AMPK基因的表达[25],对小鼠饲喂不饱和脂肪酸后发现,AMPK基因表达量显著增加[9],李蛟龙等[21]认为饲粮添加CMH对AMPKmRNA表达有显著促进作用,这与本实验研究结果相似。因此,饲粮添加CMH和CLA很可能激活了AMPK信号通路,进而导致大鼠腓肠肌肌纤维类型的改变。
过氧化物酶增殖体激活受体γ辅激活因子1α(peroxisome proliferator-activated receptor γ coactivator 1α,PGC-1α)已被证明是线粒体生物发生的主要调节器,很多研究表明PGC-1α基因表达可通过运动以及AMPK的激活来诱导[22]。为进一步研究饲粮添加CMH和CLA对大鼠腓肠肌肌纤维类型组成的影响机制,本实验对肌纤维相关基因表达量进行测定。
2.5 添加CMH和CLA对大鼠PGC-1α、MEF2C和GLUT4 mRNA相对表达量的影响
PGC-1α是一种转录共激活因子[26],在线粒体生物发生中发挥重要作用[27],其表达量与氧化型肌纤维比例呈正相关,小鼠体内过表达PGC-1α后,小鼠肌肉中线粒体数量和功能均增强,同时I型肌纤维比例增加[28]。在小鼠成肌细胞中,AMPK可以直接或间接调控PGC-1αmRNA的表达[29]。肌细胞增强因子2C(myocyte enhancer factor 2C,MEF2C)是PGC-1α的一个主要辅助活化因子,可直接调控PGC-1αmRNA的表达,提高氧化代谢[30]。任阳[9]的研究结果表明,饲喂不饱和脂肪酸的小鼠比目鱼肌中MEF2C基因表达显著增加。葡萄糖转运子4(glucose transporter 4,GLUT4)是MEF2C的上游因子,MEF2C可以和PGC-1α结合诱导GLUT4的表达,促进葡萄糖转运[31]。

图8 饲粮添加CMH和CLA对大鼠腓肠肌肌纤维类型转化相关基因表达量的影响Fig.8 Effects of CMH and CLA on muscle fiber type transition-related gene expression in rat gastrocnemius
由图8可知,CMH低剂量组和CLA低、高剂量组大鼠腓肠肌PGC-1αmRNA相对表达量显著高于对照组(P<0.05);对于MEF2CmRNA相对表达量,与对照组相比,CMH低、高剂量组显著增加(P<0.05),CLA高剂量组显著下降(P<0.05);CMH低、高剂量组和CLA高剂量组与对照组相比,大鼠腓肠肌GLUT4mRNA相对表达量显著增加(P<0.05)。总的来说,除高剂量的CLA显著降低MEF2CmRNA相对表达量外,饲粮添加CMH和CLA均能增加PGC-1α、MEF2C和GLUT4mRNA相对表达量,与上述AMPK活力增加这一结果相一致,同时CMH对于肌纤维类型转化相关基因的影响较CLA更显著。有研究表明,当激活AMPK时,GLUT4和PGC-1α的表达显著提高,并且氧化酶活性增强,糖酵解酶活性降低[32-33],这与本实验结果一致。综上所述,饲粮添加CMH和CLA后大鼠腓肠肌肌纤维类型的转化很可能是由于AMPK被激活,进而促进PGC-1α的表达,PGC-1α结合并辅助激活了MEF2C,提高氧化代谢,促进GLUT4基因的表达。
2.6 MyHC表达水平与AMPK活力、肌纤维转化相关基因表达水平及酶活力的相关性分析结果

表2 MyHC表达水平与AMPK活力、肌纤维转化相关基因表达水平及酶活力相关性Table 2 Correlation analysis of MyHC expression with AMPK activity,muscle fiber transformation-related gene expression and enzyme activities
由表2可知,AMPK活力与MyHC I、MyHC IIa和MyHC IIx相对表达量之间呈正相关,与MyHC IIb相对表达量呈负相关;LDH活力与MyHC I、MyHC IIb和MyHC IIx相对表达量之间呈正相关,与MyHC IIa相对表达量呈显著负相关(P<0.05);SDH和MDH活力与MyHC I和MyHC IIa相对表达量之间呈正相关,与MyHC IIb相对表达量呈负相关。PGC-1α、MEF2C和GLUT均对MyHC I和MyHC IIa型肌纤维存在正向调控作用,对MyHC IIb和MyHC IIx型肌纤维存在负向调控作用。
3 结 论
通过对饲粮中添加了CMH和CLA的大鼠生长性能进行测定及分析,结果表明,饲粮中添加CMH和CLA对大鼠生长速率无显著影响,但能显著降低大鼠日摄入量,这说明CMH和CLA对提高饲料转化率有积极作用。本研究结果显示,饲粮添加CMH,上调了大鼠腓肠肌中MyHC I、IIa、IIbmRNA相对表达量,同时肌肉中氧化酶(SDH、MDH)活力及AMPK活力和PGC-1α、MEF2C、GLUT4mRNA相对表达量升高,但降低了MyHC IIxmRNA相对表达量及酵解酶(LDH)活力。饲粮添加CLA提高了大鼠腓肠肌中氧化型肌纤维比例,同时提高了MDH、SDH、AMPK活力和PGC-1α、GLUT4mRNA基因表达量,但降低了酵解型肌纤维比例和LDH活力。这说明饲粮添加CMH和CLA能够增加AMPK活力,上调AMPK通路相关基因表达,增强肌肉氧化代谢能力,使肌纤维类型发生转变。因此,未来畜牧业养殖过程可通过饲喂CMH和CLA,激活AMPK信号通路来调控肌纤维类型的转化,从而提高畜肉品质。
