离子液体-球磨法制备柠檬籽纤维素纳米纤丝及其结构表征
2021-05-19戴宏杰高焕秋张宇昊
张 欢,戴宏杰,陈 媛,高焕秋,刘 姣,马 良,余 永,张宇昊
(西南大学食品科学学院,重庆 400715)
天然纤维素由无定形区和结晶区域组成,经过机械、化学或酶法处理后,高分子纤维素被分解形成直径小于100 nm的纳米纤维素[1]。纳米纤维素来源广泛,主要可从棉花、稻草、小麦秸秆以及果蔬皮渣等植物原料中获得,因具有宏观纤维素和纳米材料的优异特性(如低热膨胀系数、生物降解性、高比表面积和可持续性等)而受到越来越多的关注[2]。纳米纤维素通常由物理法(高压均质、微射流、超细研磨等机械手段)、化学法(酸水解、氧化等)和生物法(酶水解及细菌、合成)获得[3]。一般来说,根据原料来源及制备方法等差异,纳米纤维素又可分为纤维素纳米晶、纤维素纳米纤丝(cellulose nanofibrils,CNF)和细菌纤维素[3]。CNF作为纳米纤维素的一种,长度为几微米,具有较高的机械性能以及低密度和高亲水性等特性,在包装、复合材料和生物医学等方面具有广阔的应用前景[4]。
目前制备CNF的方法主要包括高压均质、超细研磨、超声波处理和低温破碎等手段[4],这些手段大多为机械操作方式,存在能耗高、操作繁琐、仪器系统易堵塞等缺陷,因而限制了其应用。球磨是一种在材料和研磨介质之间施加能量将材料的尺寸减小到纳米水平的机械技术[5]。与其他机械方式相比,球磨法除了操作更简便、不会造成堵塞外,还可在室温和常压下大量生产纳米纤维素,但仅采用球磨操作所需的能耗也不低。马海珠等[6]通过亚临界乙醇预处理漂白阔叶木浆后再球磨获得CNF,但需要在150 ℃下进行1 h的加热处理,且球磨时间也较长。Rao Xianmeng等[7]也以二甲基甲酰胺为介质进行球磨后获得分散的CNF,但该介质的高毒性使其不适宜应用于食品工业中。因而寻找合适介质与球磨结合形成一种节能、绿色、高效的方式来获得CNF意义重大。
离子液体因具有出色的溶解能力、高热稳定性、可回收性及低毒性等特性,是溶胀和加工纤维素的“绿色溶剂”[8]。它是完全由离子组成的物质,一般是由有机阳离子和无机阴离子结合组成,且大多在较低温度下(<100 ℃)呈现液态[9]。离子液体1-丁基-3-甲基咪唑氯化物(1-butyl-3-methylimidazolium chloride,[BMIM]Cl)以氯离子和1-丁基-3-甲基咪唑鎓分别作为阴、阳离子,是溶胀纤维素时使用最多的离子液体之一,在处理纤维素时可破坏其分子链强大的氢键网络,然后从分散的纤维素分子链中分离出纳米纤维素且不产生任何衍生作用[10]。本课题组前期利用[BMIM]Cl在90 ℃高温下预处理菠萝皮渣,再通过低体积分数(10%)硫酸水解获得菠萝皮渣纤维素纳米晶[11]。而目前关于离子液体在获取CNF方面的应用研究还很少,本研究则考虑将离子液体的溶胀功能与球磨处理结合,以期在室温下即可获得大量柠檬籽纳米纤维素,拓展离子液体在纤维素中的应用,同时也希望达到减少能耗、简化操作的目的。
柠檬作为世界上第三大重要的柑橘品种(仅次于橙和宽皮橘)[12],除了鲜销外,还用于生产加工如柠檬汁、柠檬精油和干柠檬片等产品。目前对柠檬渣的利用主要集中在果胶、精油及活性物质等的提取研究方面[13]。而榨油后的柠檬籽(lemon seed,LS)作为柠檬残渣的一部分,通常被丢弃,造成了一定的资源浪费和环境污染。在本课题组的前期研究中发现,LS中纤维素、半纤维素和木质素的相对含量分别约为20%、13%和9%[14],可作为纤维素资源开发利用。本研究以榨油后的LS为原料提取纤维素,进一步通过机械球磨法制备柠檬籽纤维素纳米纤丝(lemon seed cellulose nanofibrils,LSCNF),考察球磨过程中球磨介质——离子液体[BMIM]Cl质量分数对LSCNF形貌和结构的影响,以期为柠檬籽纳米纤维素的开发利用提供基础数据,促进柠檬加工副产物的开发利用。
1 材料与方法
1.1 材料与试剂
榨油后的LS由重庆汇达柠檬加工集团有限公司提供。[BMIM]Cl离子液体 中科院兰州化学物理研究所;HCl、NaOH 成都市科隆化学品有限公司;NaClO2重庆跃翔化工有限公司;其他试剂均为国产分析纯。
1.2 仪器与设备
FW135型中草药粉碎机 天津市泰斯特仪器有限公司;HH-4型数显恒温搅拌水浴锅 金坛区西城新瑞仪器厂;PE20型实验室pH计 梅特勒-托利多(上海)仪器有限公司;DGG-9140A型电热恒温鼓风干燥箱 上海齐欣科学仪器有限公司;BM6pro型行星式球磨仪 北京格瑞德曼仪器设备有限公司;MultifugeX3R型通用台式离心机 美国赛默飞世尔科技有限公司;JY92-IIN型超声波细胞粉碎机 宁波新芝生物科技股份有限公司;Spectrun100型傅里叶变换红外光谱(Fourier transform infrared spectrometer,FTIR)仪美国珀金埃尔默股份有限公司;Dimension icon型原子力显微镜(atomic force microscope,AFM) 德国布鲁克公司;BI-200SM型广角动静态光散射仪 美国布鲁克海文仪器公司;X’Pert3 Powder10300型X射线衍射(X-ray diffraction,XRD)仪 荷兰帕纳特仪器有限公司;STA 449F3型同步热分析仪 德国耐驰有限公司;MCR302型流变仪 奥地利安东帕有限公司。
1.3 方法
1.3.1 柠檬籽纤维素的提取
参照Dai Hongjie等[15]的方法并稍作修改制备柠檬籽纤维素(lemon seed cellulose,LSC)。将烘干的LS粉碎后过80 目筛,然后取100 g与2 L蒸馏水混合,置于恒温搅拌水浴锅中80 ℃搅拌加热2 h以除去原料中的杂质,用滤布过滤后清洗残渣至滤液无色,在50 ℃烘干后获得LS样品。取50 g LS样品按料液比1∶20加入NaClO2溶液(pH 3.8~4.0、质量分数5%),在75 ℃下加热5 h进行漂白处理,漂白后的残渣用蒸馏水重复洗涤直至中性。再次干燥后,将残渣用NaOH溶液(质量分数10%)在30 ℃下恒温搅拌处理12 h,以除去半纤维素和剩余的木质素,并依次用蒸馏水和体积分数95%的乙醇溶液反复清洗残渣,直至滤液变为中性,烘干后过100 目筛得到LSC样品,得率约为15%,室温下贮存备用。
1.3.2 LSCNF的制备
球磨工艺参考Phanthong等[16]的方法进行。根据球磨需要挑取3 种不同直径(7、3、1 mm)的氧化锆球,使3 种球的质量比为5∶4∶3,同时球的总质量与LSC质量之比为12∶1。在室温下,将1 g LSC、20 mL不同质量分数(0%、5%、10%、50%)的[BMIM]Cl溶液(蒸馏水配制)及氧化锆球一起放入球磨仪,球磨转速400 r/min、球磨时间2 h,进行4 次循环,即球磨30 min后暂停30 min,依次循环往复直至达到净球磨时间2 h。球磨结束后对悬浮液进行多次离心洗涤(8 000 r/min、15 min),然后在4 ℃下透析48 h以除去降解物和残留的离子液体。根据制备过程中添加不同质量分数的离子液体,将获得的4 种LSCNF样品分别命名为LSCNF-0%ILs、LSCNF-5%ILs、LSCNF-10%ILs和LSCNF-50%ILs,其悬浮液置于4 ℃冰箱备用,部分冷冻干燥用于结构表征。
1.3.3 FTIR分析
采用KBr压片法,将2 mg干燥的LSCNF与150 mg KBr混合后研磨成粉末压片,置于FTIR仪上在4 000~400 cm-1的波数范围内以4 cm-1的分辨率进行检测。
1.3.4 XRD分析
将干燥的LSCNF样品置于XRD仪的衍射槽中,利用Cu-Kα辐射在2θ=3°~50°、扫描速率2(°)/min、电压45 kV、电流40 mA的条件下测试以获得XRD图,并采用如下所示的Segal公式计算不同样品的结晶度指数[17]。

式中:I200为纤维素Iβ在2θ约为22°处(I002晶面)的最大晶格衍射峰强度(一般纤维素在22°处有最大的I002晶面衍射峰强度);Iam为纤维素Iβ在2θ约为18.5°处的最小晶格衍射峰强度[18]。
1.3.5 AFM观察
取稀释后的LSCNF悬浮液(质量分数0.01%)经超声处理后滴在云母片基底上并室温干燥5 h制样,使用AFM在轻敲模式下观察样品形貌特征。
1.3.6 动态光散射分析
配制2 mg/mL的LSCNF悬浮液,采用动静态激光散射仪测定其粒径分布,进行动态光散射(dynamic light scattering,DLS)分析。测定温度25 ℃、散射角173°、平衡时间3 min,每个样品重复测定3 次。
1.3.7 热重分析
准确称取10 mg干燥的LSCNF,利用同步热分析仪对其进行热重(thermogravimetry,TG)分析,记录样品的TG和微分热重(derivative thermogravimetry,DTG)曲线。设置温度范围为30~500 ℃,升温速率为10 ℃/min,在氮气氛围下进行测定。
1.3.8 流变学分析
测试前,将LSCNF悬浮液(质量分数约0.8%)超声30 min破坏纳米纤维素之间的团聚。采用PP25平板,设定平板间隙为1 mm,在剪切速率0.1~100 s-1范围内进行剪切黏度测试;在0.1~100 rad/s的频率范围内施加0.5%的恒定应力进行频率-模量测试。所有测试均在线性黏弹性区域内进行。
1.4 数据处理与分析
采用SPSS 17.0软件进行数据分析,每个实验设置3 次平行,最终结果以平均值±标准差表示。采用Origin 8.6软件作图。
2 结果与分析
2.1 LSCNF的FTIR分析结果
图1是LS、LSC和LSCNF(LSCNF-0%ILs、LSCNF-5%ILs、LSCNF-10%ILs和LSCNF-50%ILs)的FTIR图。所有样品在3 400、2 900、1 744、1 630、1 050 cm-1和897 cm-1处均有峰出现,属于纤维素I型结构,说明球磨过程没有破坏纤维素的基本结构。其中,在3 000~3 600 cm-1范围出现的较宽吸收带和2 900 cm-1处的窄峰分别是由O—H和C—H伸缩振动引起的;1 630 cm-1附近的吸收峰由样品中吸收的水中O—H弯曲振动引起;C—O和O—H伸缩振动峰出现在1 050 cm-1附近[19];896 cm-1附近的吸收峰是由纤维素分子中葡萄糖单元之间β-糖苷键的C—H振动引起[20-21]。在1 744 cm-1处出现的峰与羰基有关,且仅在LS中出现,主要归因于半纤维素和木质素中乙酰基团和羧酸基团的酯键[18,22],相比之下,LSC中没有此峰存在,表明其中木质素和半纤维素已被除去,同时也成功获得了纯度高的柠檬籽纳米纤维素。此外,获得的LSCNF FTIR图谱与LSC的基本相似,不过在1 630 cm-1处的峰强度增加,这是因为在球磨的过程中暴露了更多的O—H氢键。不同质量分数离子液体结合球磨法制备的LSCNF的FTIR图没有明显区别。此外,在该FTIR光谱上并未检测到离子液体([BMIM]Cl)的化学成分,这也表明在离心洗涤和透析过程中已经完全去除了[BMIM]Cl。

图1 Lemon seed (LS)、LSC和LSCNF的FTIR图Fig.1 FTIR spectra of lemon seed (LS), LSC and LSCNFs prepared with different concentration of ILs
2.2 LSCNF的XRD分析结果
由图2可见,所有样品均在2θ为14.8°、22.6°和34.7°处出现衍射峰,分别对应于纤维素Iβ晶型结构的(1-10)、(200)和(004)晶面[23],说明离子液体-球磨法不会改变纤维素的晶体结构。与其他样品相比,LS中的纤维素XRD特征衍射峰强度较弱,这主要是其纤维素含量较低造成的。通过Segal公式计算结晶度指数,结果如表1所示。LSC的结晶度指数(52.98%)明显高于LS(31.84%),这是由于NaOH和NaClO2处理除去了纤维素无定形区域中的木质素和半纤维素,从而提高了结晶度[24]。与LSC相比,LSCNF-0%ILs的结晶度指数(43.67%)大幅度降低,这是由于球磨过程中对纤维素结晶区的破坏和非晶区的暴露造成的[16],球磨过程中会产生一定的热量,增加了[BMIM]Cl中的阴阳离子与纤维素的羟基作用的几率,导致不同纤维素链中的羟基断裂和无定形区的破坏,从而使结晶度指数下降[16]。这与Kim等[25]的研究结果相似。然而,在球磨中添加[BMIM]Cl,获得的LSCNF结晶度指数增加,且随着[BMIM]Cl质量分数的增加,LSCNF的结晶度指数逐渐增加并趋于平稳。当[BMIM]Cl质量分数在10%时,LSCNF-10%ILs结晶度指数最大(54.78%)。[BMIM]Cl添加量继续增加至50%,获得的LSCNF-50%ILs的结晶度指数略有下降,可能是更多的添加量不仅会使部分无定形区域溶胀,也会使纤维素的结晶区域溶胀。
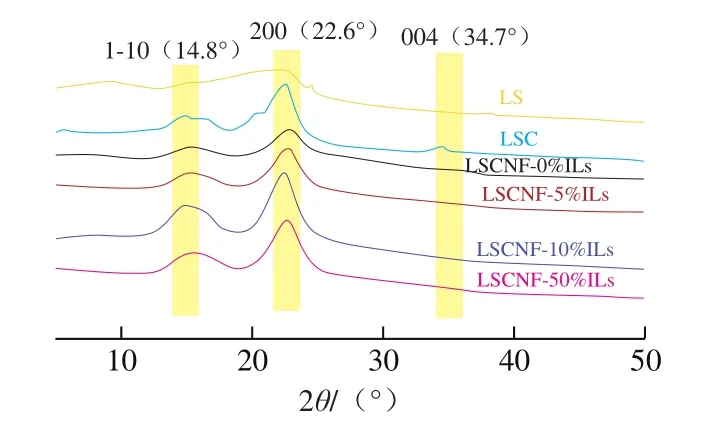
图2 LS、LSC和LSCNF的XRD图Fig.2 XRD profiles of LS, LSC and LSCNFs

表1 LS、LSC和LSCNF的结晶度指数、最高热分解温度及500 ℃时残余质量分数Table 1 Crystallinity index, maximum degradation temperatures and residual amounts at 500 ℃ of LS, LSC and LSCNFs
2.3 LSCNF的AFM观察结果
如图3A所示,所有LSCNF样品都呈现出典型CNF的细丝状,并呈现出一定的相互缠绕网络。当[BMIM]Cl的添加量为0时,仅球磨作用获得的LSCNF-0%ILs呈现更细且密集的纤维素纳米纤丝,且某些部分和主要的纳米纤丝微束略微分离,这应该是球磨时不同大小的氧化锆球碰撞及与罐壁摩擦提供了较高的剪切力,从而引起轻微的除颤[26]所致;LSCNF-0%ILs的紧密堆积程度较其他样品高,这是纤维素分子之间的强氢键相互作用引起的[27]。随着[BMIM]Cl质量分数的增加,获得的LSCNF的直径逐渐增长,但粒径逐渐缩短。这可能是离子液体[BMIM]Cl中的离子(即阴离子(氯离子)和阳离子(1-丁基-3-甲基咪唑鎓))与纤维素的羟基发生相互作用,导致纤维素链中的羟基断裂,同时球磨的剪切力将离子液体溶胀的LSC纤维束除颤成更短的纳米纤丝网络[16]。当[BMIM]Cl的添加量达到10%和50%时,CNF的分散性更好,粒径甚至达到纳米水平。由此可见,在室温下通过[BMIM]Cl和球磨方式结合可以成功从LSC中获得LSCNF。通过Nanomeasure软件统计不同样品的直径范围,如图3B所示,LSCNF-0%ILs、LSCNF-5%ILs、LSCNF-10%ILs和LSCNF-50%ILs经软件分析得出的平均直径分别为20~35、30~40、35~50 nm和40~60 nm。

图3 LSCNF的AFM图(A)和直径分布(B)Fig.3 AFM images (A) and diameter distribution (B) of LSCNFs
2.4 LSCNF的DLS分析结果
DLS技术是一种分析样品散射光强度变化的技术,由于布朗运动的存在,粒子散射光亦会不断发生变化。根据相关研究,粒子散射光强度的变化和频移与其粒径呈现负相关,即粒径越大,散射光强度的变化或频移变化越小。因此,通过观测粒子散射光强度的变化或频移变化情况,可同时获得样品粒径的动态参数,并计算出粒子的粒径(测量范围1 nm~5 μm)[28]。LSCNF-0%ILs、LSCNF-5%ILs、LSCNF-10%ILs和LSCNF-50%ILs的DLS分析结果如图4所示。4 种LSCNF均呈现单峰分布且粒径存在明显差异,其表观粒径分别为(4 127.87±303.02)nm(LSCNF-0%ILs)、(2 180.87±273.1)nm(LSCNF-5%ILs)、(1 517.73±236.2)nm(LSCNF-10%ILs)和(577.28±49.88)nm(LSCNF-50%ILs)。随着球磨过程中[BMIM]Cl添加量逐渐增加,LSCNF的粒径也逐渐降低,这与AFM的观察结果一致,这是因为更多的离子液体[BMIM]Cl有效地破坏了LSC中的强氢键网络,使球磨过程中的剪切行为更易进行。

图4 LSCNF的DLS图Fig.4 DLS profiles of LSCNFs
2.5 LSCNF的TG分析结果
图5是LS、LSC和LSCNF的TG和DTG曲线图,相应的样品最大热解温度和500 ℃时的残余质量分数见表1。如图5所示,所有样品在低于150 ℃的初始损失质量分数分别是6.62%(LS)、5.27%(LSC)、6.61%(LSCNF-0%ILs)、7.52%(LSCNF-5%ILs)、4.71%(LSCNF-10%ILs)和6.48%(LSCNF-50%ILs),这部分是样品中吸附水或结合水的质量损失[24]。在200~380 ℃时,所有样品都存在较大的质量损失,这归因于纤维素材料自身的热解。与此同时,由图5B观察到LS在不同温度下存在不同热解峰,这是由于LS还存在半纤维素和木质素。LS和LSC的最大热解温度与LSCNF的差异较小,均在360 ℃左右,说明纤维素的主要成分分解温度在360 ℃左右。不同样品的最高热解速率明显不同,LSC的最高热解速率最大(18.85%/min),而LS的最小(3.74%/min),这是经因为漂白和碱处理后获得的LS中木质素和半纤维素含量大幅减少,使得LSC更易于发生热解[29]。不同离子液体[BMIM]Cl添加量与球磨结合制备的LSCNF在360 ℃附近的最高热解速率与LSC也存在差异,相同球磨时间内,随着[BMIM]Cl的添加量增大,获得的LSCNF最高热解速率逐步降低且都低于LSC。其中离子液体-球磨制备的LSCNF残余质量分数与仅球磨制备的相比更高,质量损失更小(表1),表明其具有相对较高的热稳定性[30],这与其结晶度的变化趋势一致,也表明离子液体[BMIM]Cl的添加可能会对热稳定性产生积极影响。在380~500 ℃温度范围的质量损失源于含碳骨架的损失,产生了碳和碳氢化合物的混合物以及一些非挥发性成分[30]。加热至500 ℃后,LS、LSC和LSCNF-0%ILs、LSCNF-5%ILs、LSCNF-10%ILs、LSCNF-50%ILs的残余质量分数分别为31.36%、24.08%、22.87%、24.06%、23.49%和24.53%(表1)。

图5 LS、LSC和LSCNF的TG(A)和DTG(B)曲线Fig.5 TG (A) and derivative thermogravimetry (B) curves of LS, LSC and LSCNFs
2.6 LSCNF的流变学分析结果
LSCNF-0%ILs、LSCNF-5%ILs、LSCNF-10%ILs和LSCNF-50%ILs在质量分数均为0.8%时的剪切速率-黏度曲线和角频率-模量测定结果分别如图6和图7所示。总体来看,随着剪切速率在0.1~100 s-1范围内逐渐增大,所有的LSCNF悬浮液均呈现典型的剪切稀化行为,表现为非牛顿流体[31],这可能是由于缠绕或聚集的CNF三维网状结构在剪切过程中被破坏,降低了流体阻力,从而使得表观黏度降低。当剪切速率一定时,4 种LSCNF的黏度大小依次为LSCNF-0%ILs>LSCNF-5%ILs>LSCNF-10%ILs>LSCNF-50%ILs。这种现象出现很可能是因为不同添加量的离子液体造成了不同粒径和直径的LSCNF,LSCNF-0%ILs的粒径最长,其形成更密集的网状结构且大分子链蠕动更慢,所以受剪切速率的影响最小,黏度较大。4 种LSCNF悬浮液的储能模量(G’)和损耗模量(G”)的大小差异不明显。角频率范围在0.1~100 rad/s时,LSCNF-5%ILs、LSCNF-10%ILs和LSCNF-50%ILs的G′均高于G”,且随角频率的增加,G’与G”在该扫描范围内未发生交叉,弹性流体(G’>G”)未转化成黏性流体(G’<G”),表现出无凝胶性质[32],而LSCNF-0%ILs在较低角频率下(0.1~10 rad/s)体系的弹性更好,较高角频率时(10~100 rad/s)由于G”均高于G’,且出现了从溶胶转为凝胶的交叉点,样品的黏性特征更强,还呈现出凝胶性质[32],这与该样品对应的剪切速率曲线的结果相一致。

图6 LSCNF的剪切速率-黏度变化曲线Fig.6 Shear rate-viscosity curves of LSCNFs

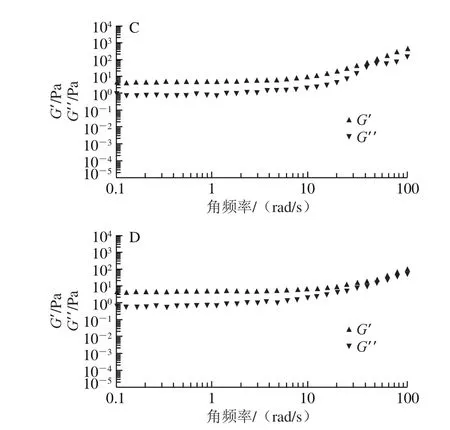
图7 LSCNF的频率扫描图Fig.7 Frequency scanning of LSCNFs
3 结 论
离子液体-球磨法可以用于制备LSCNF,同时LSCNF的形貌和结构与球磨介质(离子液体[BMIM]Cl)的质量分数有关。AFM观察和DLS分析结果表明,当[BMIM]Cl添加量不同时,获得的LSCNF粒径和直径差异较大,这与[BMIM]Cl对纤维素的溶胀作用有关。FTIR和XRD分析结果表明获得的LSCNF属于纤维素Iβ晶型结构,添加[BMIM]Cl有利于提高LSCNF的结晶度和热稳定性,说明在球磨的强剪切力下破坏了纤维素的结晶区,而加入离子液体可对结晶区和热稳定性起到一定保护作用。流变学分析结果表明LSCNF长度更长时黏度较高,离子液体-球磨结合制备的样品在角频率为0.1~100 rad/s时均呈现弹性特征强于黏性特征,而仅球磨操作的LSCNF-0%ILs在低角频率(0.1~10 rad/s)时弹性特征占主导,在高角频率(10~100 rad/s)时主要表现为黏性流体。本研究提供了一种有效分离柠檬籽纳米纤维素的方法,有利于提高柠檬加工副产物的利用价值。
