复合果蔬发酵汁有机酸动态分析及体外模拟消化抗氧化活性和功能成分分析
2021-05-19陈树俊
陈树俊,郑 婕
(山西大学生命科学学院,山西 太原 030006)
近年来研究发现由乳酸菌、开菲尔粒发酵的果蔬汁表现出优良的益生功效,受到市场的青睐。发酵使果蔬汁由富含维生素和矿物质元素的一般饮品,成为具有改善乳糖不耐症、提高机体免疫力、降低血脂和保护肝脏等食疗作用的功能性饮品[1]。发酵可有效改善产品的风味、提高营养价值,但需要注意的是,人体胃肠消化液可能会降解或转化部分功能成分,对其化学结构、功能活性造成影响,降低实际效力[2]。目前,关于食物中多酚类物质及抗氧化活性的研究多是基于有机溶剂提取等化学法,而这与人体胃肠道消化过程有很大区别,无法真实反映多酚类物质在体内生理环境下的存在形式和抗氧化能力。采用体外模拟消化方法能规避上述研究缺陷,通过模拟人体的胃肠道消化来研究食物中活性成分在人体的消化情况,可以准确、快捷地对食品的营养和保健价值进行评估[3]。由此可见,研究果蔬汁胃肠消化特性对准确评估其益生潜力具有重要意义。
复合果蔬汁风味主要受有机酸、糖类、氨基酸等成分影响,其中,有机酸是影响其风味的重要指标,例如,乳酸、柠檬酸、苹果酸等有机酸的酸味柔和且浓郁,可以增强产品醇厚感,促进芳香酯形成。果蔬发酵汁制备工艺简便、易于控制、发酵周期短,不同原料和发酵菌株所生产的发酵产品有机酸组成差别较大,准确测定复合果蔬发酵汁中有机酸种类和含量对解析发酵机理、把控产品品质具有重要意义。
本实验在体外模拟胃肠消化基础上分别探索乳酸菌发酵果蔬汁、开菲尔粒发酵果蔬汁发酵前后酚类物质含量和抗氧化活性变化规律,较有机溶剂化学测定法更加接近人体实际对其消化吸收情况,同时研究果蔬汁在不同发酵时间段的有机酸含量变化,分析发酵过程中有机酸演变规律,旨在为开菲尔粒相关发酵产品的益生功能、品质研究提供参考,并为丰富或替代部分乳酸菌发酵剂提供理论依据。
1 材料与方法
1.1 材料与试剂
桑椹、沙棘、葡萄、胡萝卜原浆 天津悦梵泰有限公司;开菲尔粒 山西大学生命科学学院;植物乳杆菌、干酪乳杆菌 中国菌种保藏中心;胃蛋白酶(1∶3 000)、胰蛋白酶(1∶250)、牛磺胆酸钠、2,2’-联氮-双(3-乙基苯并噻唑啉-6-磺酸)二铵盐(2,2’-azino-bis(3-ethylbenzothiazoline-6-sulfonic acid)diammonium salt,ABTS)、磷酸二氢钾、磷酸北京索莱宝科技有限公司;1,1-二苯基-2-三硝基苯肼(1,1-diphenyl-2-picrylhydrazyl,DPPH)、芦丁标准品美国Sigma公司;草酸、柠檬酸、酒石酸、苹果酸、琥珀酸、乳酸、乙酸、甲醇(均为色谱纯) 天津科密欧化学试剂有限公司;其他试剂均为国产分析纯。
1.2 仪器与设备
UV-8000紫外-可见分光光度计 上海精密仪器仪表有限公司;SHZ-2水浴恒温振荡器 江苏环宇科学仪器厂;PHS-3C数显实验室pH计 苏州华美辰仪器有限公司;SW-CJ-1FD净化工作台 上海博迅实业有限公司;HPS-250生化培养箱 哈尔滨市东明医疗仪器厂;SC-3610低速离心机 安徽中科中佳仪器有限公司;BKQ-B50高压蒸汽立式灭菌锅 山东博科科学仪器有限公司;1525型高效液相色谱仪 美国Waters公司;水相微孔滤膜(0.22 μm) 上海楚定分析仪器有限公司;HH-1数显恒温水浴锅 青岛聚创世纪环保科技有限公司。
1.3 方法
1.3.1 果蔬发酵汁制备
以感官评分和多酚含量为评价指标,通过正交试验确定复合果蔬汁制备工艺为:桑椹汁添加量为15%(以体系总体积计,下同)、葡萄汁添加量为25%、胡萝卜汁添加量20%、沙棘汁添加量为11%,其余为纯净水。
以复合果蔬汁为原料,90 ℃水浴灭菌20 min后接入乳酸菌混菌(植物乳杆菌数与干酪乳杆菌数比为2∶1),以酸度和活菌数为评价指标,通过响应面试验确定乳酸菌发酵果蔬汁最优工艺参数:接种量3.5%(以体系总体积计,下同)、发酵温度37 ℃、发酵时间34.6 h。
以复合果蔬汁为原料,90 ℃水浴灭菌20 min后接入开菲尔粒(乳酸菌数与酵母菌数比为9∶1),以酸度和活菌数为评价指标,通过响应面试验确定开菲尔粒发酵果蔬汁最优工艺参数:接种量7.3%、发酵温度32℃、发酵时间41.7 h。
1.3.2 体外模拟胃肠消化模型
体外模拟消化过程参考Hou Fangli等[4]的方法并稍作改动。
模拟胃消化:移取1 mL复合果蔬汁于装有4 mL无菌水的离心管中,加入0.5 mL 1 mol/L HCl溶液(此时混合液pH值为2),再加入160 mg胃蛋白酶(1∶3 000),将果蔬汁置于37 ℃恒温振荡培养箱中厌氧避光培养,消化过程每隔30 min取样待测。
模拟肠消化:以胃消化2 h的样品作为肠消化初始时间0 h样品,向果蔬汁中加适量1 mol/L NaHCO3溶液至pH 7.5,随后加入18 mL混合液(2 mg/mL胰蛋白酶液与12 mg/mL胆酸盐体积比为12∶6),37 ℃振荡避光培养(厌氧条件)。消化过程每隔30 min取样待测。
1.3.3 功能成分测定
参照Berker等[5]的方法,采用Folin-Ciocalteu法测定总酚质量浓度;采用NaNO2-Al(NO3)3分光光度法测定样品中黄酮的质量浓度[6]。
1.3.4 抗氧化效果的测定
DPPH自由基清除率测定参考文献[7];ABTS阳离子自由基清除率测定参考文献[8-9]并稍加改进:向2.4 mmol/L过硫酸钾溶液中加入等体积6 mmol/L的ABTS溶液混匀,暗处储存15 h后,用无水乙醇稀释至其在734 nm波长处吸光度为0.70左右。依次取果蔬汁消化液1 mL置于具塞试管中,加入5 mL ABTS溶液,室温避光反应7 min后在734 nm波长处测其吸光度并记为A样品;以1 mL蒸馏水代替消化液测其吸光度并记为A空白,以上测定时均以蒸馏水调零。每组样品平行3 次,按下式计算ABTS阳离子自由基清除率;羟自由基(·OH)清除率测定参考文献[10]。

1.3.5 有机酸质量浓度的测定
复合果蔬汁发酵过程中,每隔5 h取5 mL果蔬汁以3 000 r/min离心15 min。移取上清液稀释5 倍体积后过0.22 μm水相滤膜,过滤液进行高效液相色谱分析。
色谱柱:Sepax HP-C18(250 mm×4.6 mm,5 μm);流动相:甲醇-0.02 mol/L KH2PO4(体积比3∶97,用磷酸调至pH 2.5);进样量:10 μL;流速:1 mL/min;柱温:30 ℃;紫外检测器波长:210 nm。
1.4 数据处理与分析
每组实验平行3 次,以平均值±标准差表示,各组数据采用SPSS软件Duncan多重复极差法进行显著性分析,以P<0.05表示差异显著,采用Origin 7.5软件对图表进行绘制。
2 结果与分析
2.1 胃肠消化对发酵果蔬汁抗氧化成分的影响
2.1.1 消化过程中发酵果蔬汁多酚质量浓度的变化

图1 体外消化过程中发酵果蔬汁多酚质量浓度的变化Fig.1 Changes in polyphenol content of mixed fruit and vegetable juices during in vitro digestion
结合图1A、B可以看出,在胃肠消化阶段,3 个实验组多酚质量浓度均呈显著上升趋势(P<0.05),可能是因为在模拟消化过程中,胃酸和胃蛋白酶会削弱部分酚酸与细胞壁之间的酯键从而释放酚酸,胰蛋白酶和胆汁也可以作用于多酚与蛋白质之间的共价键,使其脱离出更多的自由酚,从而使果蔬汁多酚质量浓度在经过胃消化后显著升高,在肠消化过程中进一步升高,这与Bouayed等[11]对苹果进行体外模拟消化研究所得结果相似。同时,开菲尔粒发酵组多酚质量浓度明显著高于乳酸菌发酵组、未发酵组(P<0.05),且在胃肠消化结束时(肠消化2.5 h),开菲尔粒发酵组多酚质量浓度比乳酸菌发酵组高1.07 mg/mL,比未发酵组高3.16 mg/mL(P<0.05)。原因可能是由于开菲尔菌为复杂微生物共生体,相较于植物乳杆菌和干酪乳杆菌能产生更为丰富的酶系,继而切断结合态多酚纤维素、半纤维素之间的共价键,如植物细胞壁多糖共价键、木质素酯键等,从而释放出更多的可溶性多酚,同时发酵后形成的酸性环境亦能减少多酚的破坏降解,导致多酚质量浓度显著高于乳酸菌发酵组和未发酵组。
2.1.2 消化过程中发酵果蔬汁黄酮质量浓度的变化

图2 体外消化过程中发酵果蔬汁黄酮质量浓度的变化Fig.2 Changes in flavonoid content of mixed fruit and vegetable juices during in vitro digestion
从图2A中可以看出,3 组果蔬汁黄酮质量浓度在胃消化过程中显著升高(P<0.05),此消化阶段结束时(胃消化2.5 h),开菲尔粒发酵组黄酮质量浓度较乳酸菌发酵组和未发酵组分别提高了37.33%、66.13%(P<0.05)。表明在胃消化过程中,开菲尔粒发酵组的黄酮释放速率明显优于乳酸菌发酵组,可能是由于其菌体的代谢产物会转化部分碳源物质,生成能发生显色反应的邻苯二酚结构。Suo Huayi等[12]的研究也已证明发酵微生物会引起发酵基质中植物细胞的破裂,引起不同抗氧化物质的释放与合成。同时胃液较低的pH值环境可以有效避免黄酮类化合物的降解,胃蛋白酶、胃酸均能促进结合态黄酮的释放,导致随着胃消化时间的延长黄酮质量浓度持续升高;在肠消化阶段黄酮质量浓度均有所下降(图2B),可能是因为从酸性的胃液环境过渡到中性或弱碱性的肠液环境时,黄酮容易降解为酚醛或其他化合物。肠消化结束时,开菲尔粒发酵组黄酮质量浓度高于其他两组,比乳酸菌发酵组高0.016 mg/mL,比未发酵组高0.022 mg/mL。
2.2 胃消化阶段发酵果蔬汁抗氧化活性分析结果
胃消化过程中果蔬汁抗氧化活性变化如图3所示,DPPH自由基、ABTS阳离子自由基清除率随消化时间的延长呈显著上升趋势(P<0.05)。开菲尔粒发酵组、乳酸菌发酵组、未发酵组发酵结束时DPPH自由基清除率分别为84.6%、78.7%、69.3%,较消化前(胃消化0 h)分别提高了13.3%、11.7%、8.9%(P<0.05);开菲尔粒发酵组、乳酸菌发酵组发酵结束时ABTS阳离子自由基清除率较未发酵组分别提高了12.5%、6.4%,较消化前分别提高了8.5%、5.5%(P<0.05);由图3C可知,·OH清除率先上升后略有下降,在胃消化1.5 h时抗氧化能力最强,Tagliazucchi等[13]的研究也表明,葡萄样品经模拟胃液消化后抗氧化活性有所提高。综合图3A~C可看出,在胃消化阶段,自由基清除率强弱顺序为开菲尔粒发酵组>乳酸菌发酵组>未发酵组,消化组>未消化组,说明微生物发酵和胃消化过程均可以提高复合果蔬汁的自由基清除能力,且开菲尔粒提高效果优于乳酸菌混菌。
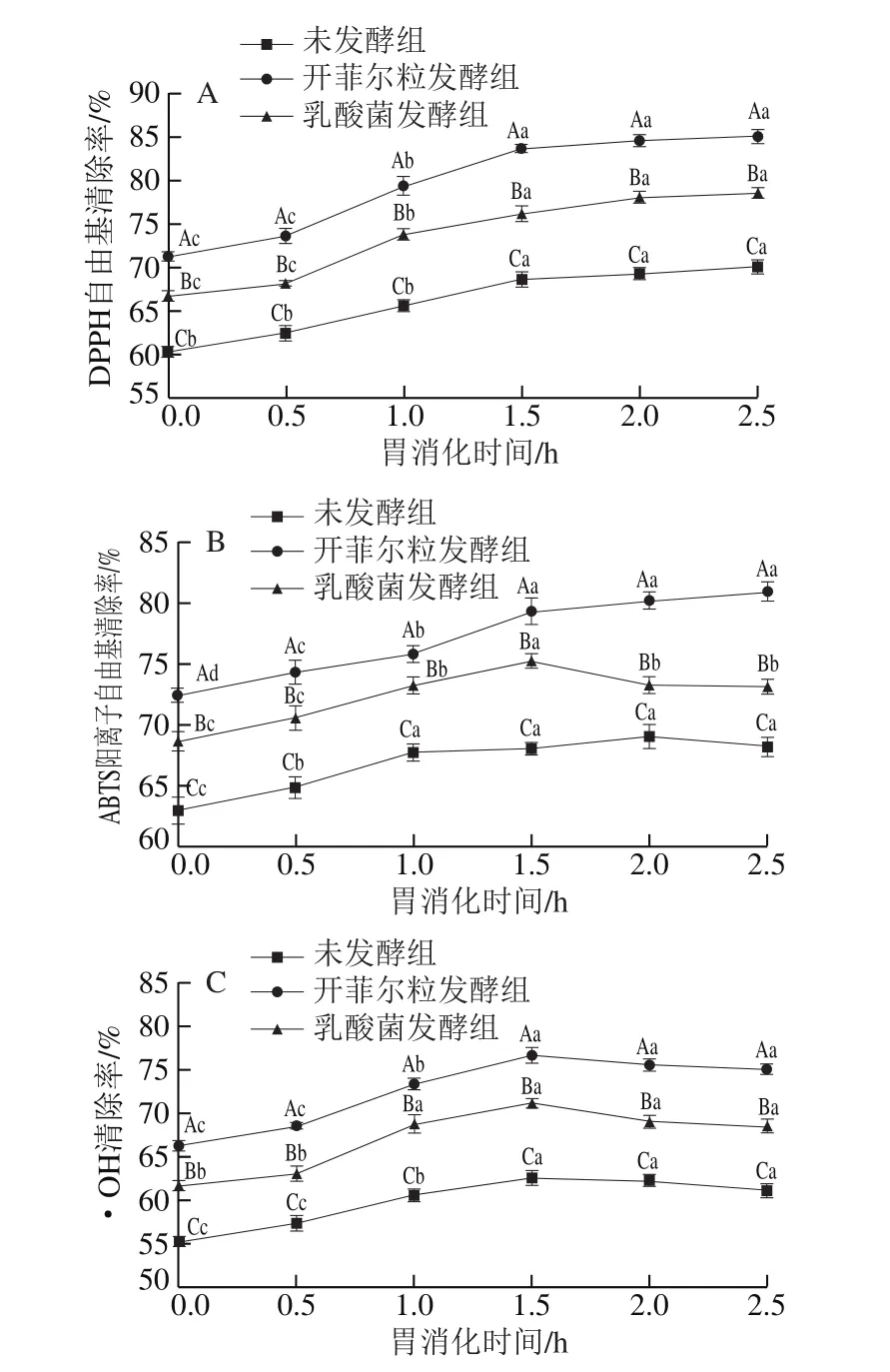
图3 胃消化对发酵果蔬汁自由基清除率的影响Fig.3 Effect of gastric digestion on free radical scavenging capacity of mixed fruit and vegetable juices
2.3 肠消化阶段发酵果蔬汁抗氧化活性分析结果
将果蔬汁经过胃液处理后再经肠液处理,分析其对自由基清除率的影响。由图4A、B可知,随着肠消化时间的延长,DPPH自由基、ABTS阳离子自由基清除率先上升后趋于平缓,肠消化结束时,开菲尔粒发酵组DPPH自由基清除率、ABTS阳离子清除率分别比乳酸菌发酵组高10.1%、13.3%,分别比未发酵组高12.8%、14.7%,较消化前(肠消化0 h)分别提高了11.5%、7.6%(P<0.05),说明经开菲尔粒发酵后果蔬汁具有更高的抗氧化活性,且在肠消化过程中进一步增强。由图4C可知,各组·OH清除率均呈下降趋势,未发酵组清除率下降显著,由未消化时的61.6%下降至56.3%(2.5 h),肠消化结束时,两个发酵组清除率均显著高于未发酵组(P<0.05),虽然·OH清除率整体均呈下降趋势,但开菲尔粒发酵组依旧保持着较高的抗氧化能力,肠消化结束时(2.5 h)比乳酸菌发酵组高6.5%,比未发酵组高16.7%。
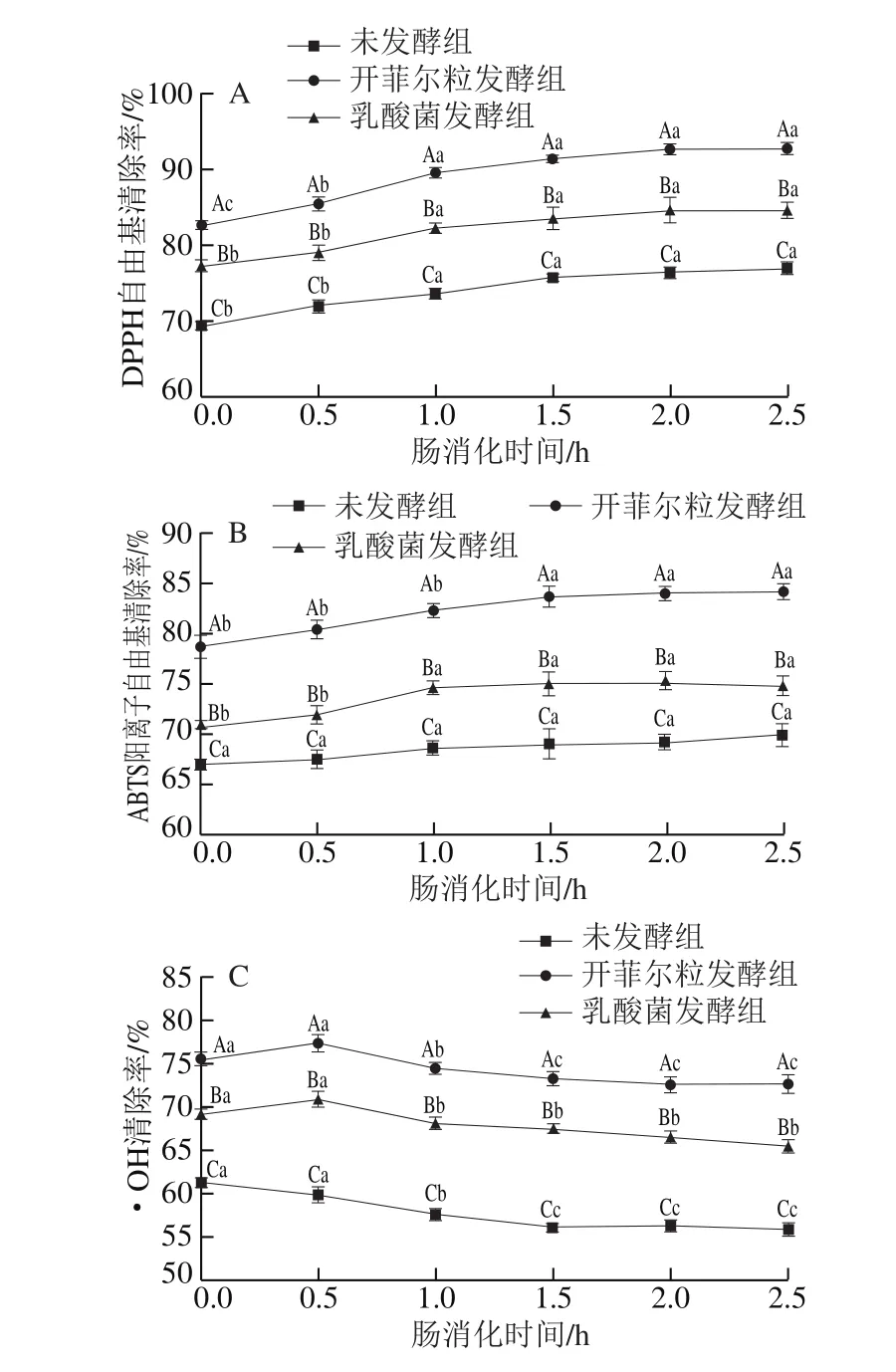
图4 肠消化对发酵果蔬汁自由基清除率的影响Fig.4 Effect of intestinal digestion on free radical scavenging capacity of mixed fruit and vegetable juices
2.4 消化过程中发酵果蔬汁活性成分与抗氧化能力相关性分析结果
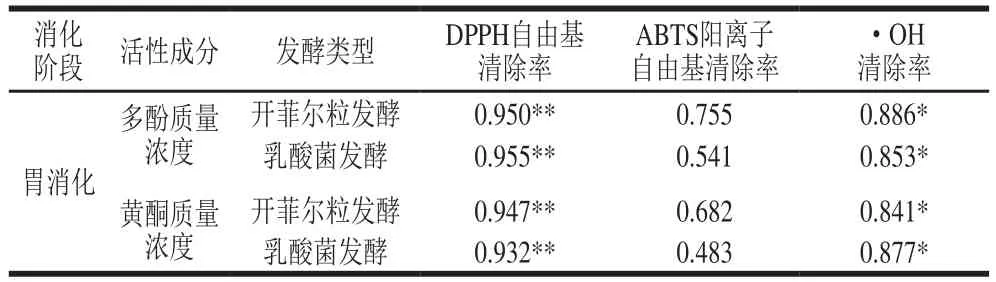
表1 胃消化过程中发酵果蔬汁活性成分与抗氧化能力相关性分析Table 1 Correlation analysis between bioactive ingredients and antioxidant capacity of mixed fruit and vegetable juices during gastric digestion
由表1可知,在模拟胃消化过程中,开菲尔粒发酵组、乳酸菌发酵组多酚和黄酮质量浓度与DPPH自由基、·OH清除率呈显著正相关性,表明在胃消化阶段,发酵果蔬汁中多酚、黄酮类物质对DPPH自由基、·OH清除起主导作用;而ABTS阳离子自由基清除率与开菲尔粒发酵组和乳酸菌发酵组多酚质量浓度(r=0.755、r=0.541)、黄酮质量浓度(r=0.682、r=0.483)相关性不显著,推测其对ABTS阳离子自由基的清除是由多酚、黄酮与发酵菌株共同作用的结果[14],可能是发酵菌株细胞产生的多糖和蛋白(如酵母细胞壁内的葡聚糖等[15])具有很强的抗氧化作用;同时菌株细胞质内还含有很多内生的抗氧化剂,均可以促进ABTS阳离子自由基清除率提高。

表2 肠消化过程中活性成分与抗氧化能力相关性分析Table 2 Correlation analysis between bioactive ingredients and antioxidant capacity during intestinal digestion
由表2可知,在模拟肠消化过程中,两组发酵果蔬汁DPPH自由基清除率与多酚质量浓度均呈显著正相关(r=0.897、r=0.928),而ABTS阳离子自由基、·OH清除率与两发酵组多酚、黄酮质量浓度相关性不显著,说明ABTS阳离子自由基、·OH清除能力是发酵果蔬汁体系中所有抗氧化物质共同作用的结果,其中,发酵菌种具有重要作用。已有研究证明益生菌被人体摄入后会在肠道停留一定时间,通过代谢向细胞壁外分泌胞外多糖、生物活性肽等代谢产物[16-17],这些产物具有较强的抗氧化活性,可抑制自由基连锁反应的发生。在肠消化过程中,胰酶和胆汁的协同效应也可水解某些物质生成抗氧化剂[18-19],提高发酵液的抗氧化能力。
2.5 果蔬汁发酵过程中有机酸动态变化
2.5.1 有机酸标准品色谱图和线性关系
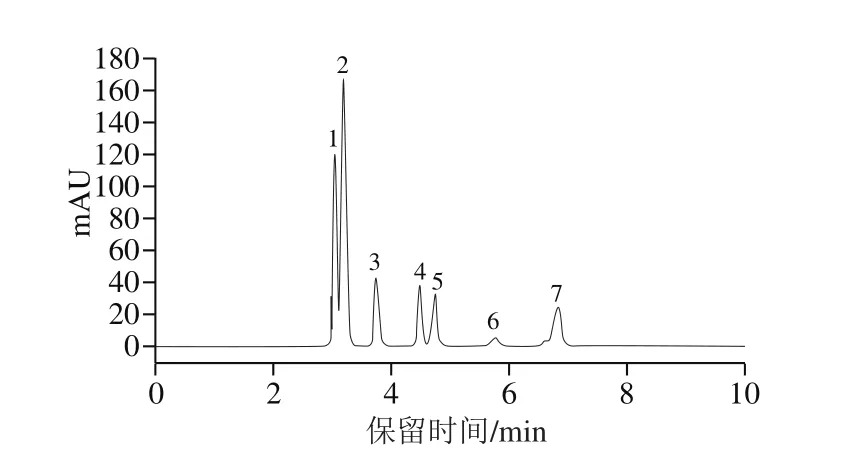
图5 有机酸混合标准品高效液相色谱图Fig.5 HPLC profile of mixed organic acid standards
由图5可知,7 种有机酸标准品分离效果较好,且分离时间较短,保留时间在2~8 min,各有机酸对应的保留时间分别为草酸3.029 min、酒石酸3.184 min、苹果酸3.747 min、乳酸4.470 min、乙酸4.716 min、柠檬酸5.751 min、琥珀酸6.801 min。

表3 有机酸标准品标准曲线回归分析Table 3 Calibration curves for organic acid standards
由表3可知,定量检测波长下,决定系数均大于0.997 5,说明各有机酸质量浓度与色谱峰面积呈良好线性关系,采用峰面积定量法对各有机酸进行定量分析可行。7 种有机酸的检出限在0.18~4.89 mg/mL之间,定量限在0.63~19.17 mg/mL之间,能满足检测要求。
2.5.2 发酵果蔬汁苹果酸、琥珀酸、柠檬酸、草酸质量浓度动态变化

表4 果蔬汁发酵过程中苹果酸、琥珀酸、柠檬酸、草酸质量浓度动态变化Table 4 Dynamic changes of malic acid, succinic acid, citric acid and oxalic acid of mixed fruit and vegetable juices during fermentation
复合果蔬汁有机酸含量丰富,在发酵过程中呈动态变化趋势,准确测定有机酸的种类和含量对评估果蔬汁发酵品质、功能特性具有重要意义。由表4可知,与发酵前相比,果蔬汁经乳酸菌、开菲尔粒发酵后,苹果酸、琥珀酸和草酸质量浓度均呈极显著下降趋势(P<0.01),柠檬酸质量浓度变化不显著(P>0.05)。在发酵过程中,果蔬汁进行三羧酸循环,作为循环中间体的苹果酸参与多种生化反应,随着反应的进行,苹果酸((3 818.90±22.26)mg/L)被分解为乳酸等物质而导致质量浓度分别下降至(1 254.77±14.10)mg/L(乳酸菌发酵组)、(1 436.12±10.9)mg/L(开菲尔粒发酵组)。Tsuji等[20]研究表明琥珀酸、柠檬酸及草酸是碳代谢的中间产物。琥珀酸在碳代谢途径中,可通过部分丙酮酸氧化为氢离子和醋酸,也可产生少量乳酸,其中间代谢物也能为合成双乙酰、乙偶姻等物质提供前体分子[21-22],这可以解释发酵结束时琥珀酸质量浓度仅为(74.48±4.54)mg/L(乳酸菌发酵组)、(98.03±15.73)mg/L(开菲尔粒发酵组)。草酸在果蔬汁中初始质量浓度较低,仅为(87.62±2.34)mg/L,在微生物代谢发酵过程中发生合成或分解,生成其他物质,发酵结束时其质量浓度仅为(39.64±3.55)mg/L(乳酸菌发酵组)、(42.88±1.56)mg/L(开菲尔粒发酵组),较发酵前明显降低。柠檬酸在发酵阶段质量浓度处于动态变化中,发酵至20 h左右达最大值,之后又逐渐下降,可能是乳酸菌将部分柠檬酸分解成醋酸和丙酮酸,导致发酵结束时柠檬酸质量浓度较发酵前无显著差异,与郑欣[23]、Mousavi[24]等分别应用乳酸混合菌发酵荔枝汁、石榴汁后发现柠檬酸质量浓度无显著变化的结论相一致。
2.5.3 发酵果蔬汁乳酸、酒石酸、乙酸质量浓度动态变化
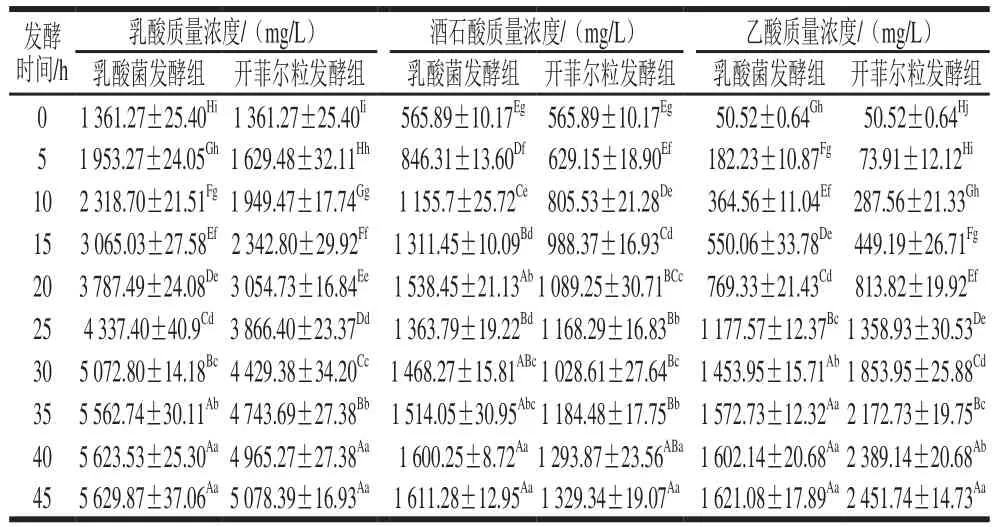
表5 果蔬汁发酵过程中乳酸、酒石酸、乙酸质量浓度动态变化Table 5 Dynamic changes of lactic acid, tartaric acid and acetic acid of mixed fruit and vegetable juices during fermentation
由表5可知,与发酵前相比,果蔬汁经过乳酸菌混菌、开菲尔粒发酵后,乳酸、酒石酸和乙酸质量浓度极显著上升(P<0.01)。原因可能是除了益生菌发酵使部分苹果酸转化为乳酸外,果蔬汁中葡萄糖也能在乳酸脱氢酶作用下,通过糖代谢途径还原为乳酸,导致乳酸质量浓度持续增加,由初始的(1 361.27±25.40)mg/L分别提高到(5 629.87±37.06)mg/L(乳酸菌发酵组)、(5 078.39±16.93)mg/L(开菲尔粒发酵组),这与de Souza Neves Ellendersen等[25]研究苹果浆发酵期间乳酸质量浓度的动态规律相一致。发酵结束时,乳酸菌发酵组乳酸质量浓度高于开菲尔粒发酵组,原因可能与两种发酵液中乳酸菌数量及代谢产物酶有关。酒石酸在果蔬汁中的初始质量浓度为(565.89±10.17)mg/L,随着发酵时间的延长,果蔬汁pH值降低,酒石酸盐溶解性增大,使酒石酸含量增加[26-27],发酵至45 h时,两组果蔬汁酒石酸质量浓度分别为(1 611.28±12.95)mg/L(乳酸菌发酵组)、(1 329.34±19.07)mg/L(开菲尔粒发酵组),较发酵前极显著升高(P<0.01)。果蔬原汁中乙酸质量浓度较低,初始质量浓度为(50.52±0.64)mg/L,发酵后乙酸为果蔬汁中挥发性有机酸的主体成分,会使产品带有愉悦的醋香味[28],Driehuis等[29]发现乳酸菌在厌氧条件下具有降解乳酸并将其转化为乙酸的能力。发酵结束时,开菲尔粒发酵组乙酸质量浓度明显高于乳酸菌发酵组,原因可能是除开菲尔粒中的乳酸菌能代谢丙酮酸产生乙酸外[30],其含有的少量醋酸菌也参与代谢产酸[31],综合作用使得乙酸质量浓度明显增加。
3 讨 论
模拟人体消化技术日渐成熟并得到广泛应用,已成为研究食物在人体胃肠道消化变化的重要途径。Hu Yidong等[32]研究了消化过程对发酵芒果汁黄酮、多酚含量及抗氧化活性的影响,结果表明,与未发酵组相比,发酵芒果汁经胃肠消化后抗氧化组分含量显著升高,其中发酵菌株具有重要作用。在本研究中,以不同发酵组果蔬汁的多酚、黄酮质量浓度以及DPPH自由基、ABTS阳离子自由基、·OH清除率为指标,进行模拟胃肠消化实验,结果表明消化过程有利于抗氧化成分及自由基清除率的升高且开菲尔粒发酵样品益生效果显著优于乳酸菌混菌,相关性分析结果表明发酵菌株是影响发酵果蔬汁抗氧化能力的重要因素,与上述研究结果相似。
在对果蔬汁有机酸研究方面,Herrero等[33]研究发现当酵母菌和乳酸菌混合发酵苹果汁时,苹果酸在发酵过程中被完全代谢,且苹果酸完全分解后乳酸含量也开始降低,而醋酸大量产生。本研究中,苹果酸经发酵后含量显著下降,乳酸、酒石酸和乙酸含量显著升高,与上述结果一致。发酵过程中果蔬汁进行苹果酸-乳酸菌发酵,不仅能够产生诸多风味物质,而且对发酵产品抗氧化等功能性作用具有重要影响,发酵产品能调节人体肠道微生态,提高营养元素的吸收利用率,增强人体免疫力[34]。
与乳酸菌发酵所得果蔬汁相比,开菲尔粒发酵果蔬汁具有更好的益生功能。这归功于开菲尔粒的组成菌种类多样,在发酵过程中能产生多种生物活性肽[35],这些活性肽对维持肠道菌群平衡、保护人体健康具有重要作用。目前,市场上发酵果蔬汁饮料所采用的发酵菌种多局限为乳酸菌,导致发酵果蔬汁类型较为单一,严重影响我国果蔬饮料的出口与内销。本实验结果证明开菲尔粒可丰富或替代部分乳酸菌发酵剂,开发功能性果蔬和天然抗氧化产品。但有关发酵果蔬汁产品的多酚和黄酮组分结构、益生菌数量在消化过程中的变化趋势以及主导有机酸变化的核心菌群均有待于在今后的工作中进一步深入研究。
4 结 论
本实验通过模拟胃肠消化,分别对乳酸菌发酵组、开菲尔粒发酵组果蔬汁发酵前后多酚、黄酮质量浓度和抗氧化活性进行动态评价,实验结果表明:在消化环境中,与未发酵样品相比,发酵果蔬汁多酚、黄酮质量浓度显著升高,对DPPH自由基、·OH、ABTS阳离子自由基清除能力较消化前进一步提高,且在模拟胃消化过程中升高最显著。肠消化结束时,开菲尔粒发酵组DPPH自由基、ABTS阳离子自由基、·OH清除率分别比乳酸菌发酵组高10.1%、13.3%、6.5%,比未发酵组高12.8%、14.7%、16.7%;多酚、黄酮质量浓度分别比乳酸菌发酵组高1.07、0.016 mg/mL,分别比未发酵组高3.16、0.022 mg/mL,说明开菲尔粒发酵果蔬汁益生效果显著优于乳酸菌混菌,更加适应人体消化环境,可为丰富或替代部分乳酸菌发酵剂提供参考。采用高效液相色谱法分别对乳酸菌发酵组、开菲尔粒发酵组果蔬汁中7 种有机酸进行动态分析,结果表明:两组果蔬汁在整个发酵过程中有机酸变化规律较为一致:苹果酸、琥珀酸和草酸经发酵后质量浓度极显著下降,乳酸、酒石酸和乙酸质量浓度显著极升高,柠檬酸质量浓度变化不显著。
