CT引导氩氦刀冷冻消融治疗肺癌临床实践及文献分析
2021-05-19张海林万里陈颖吴波猛何海权谢锡浩
张海 林万里 陈颖 吴波猛 何海权 谢锡浩
摘要:目的:探讨CT引导下氩氦刀冷冻消融治疗肺癌临床应用的安全性、可行性及有效性。方法;通过回顾性分析,收集2018年10月~2019年10月在高州市人民医院施行CT引导下氩氦刀冷冻消融治疗肺癌病例10例临床资料,分析术前临床资料、术中主要指标、术后并发症发生情况及术后随访情况。结果:纳入研究的10例患者中,4例为高龄或心肺功能极差、1例为鼻咽癌肺部转移、5例为肿瘤综合治疗后病变局限患者。手术平均时间(137.20±65.93)min,肿瘤平均长径(3.30±2.58)cm,最大冰球直径(5.10±2.80)cm,术中发生气胸1例,术后并发局部皮肤冻伤2例。随访2年期间,1例临床评估CR,5例PR。随访期间死亡2人。结论:CT引导下氩氦刀肺部肿瘤冷冻消融术,对于部分肺部肿瘤患者提供了安全、可行及有效的治疗选择。
关键词:肺恶性肿瘤,氩氦刀,冷冻消融
肺部恶性肿瘤是世界上常见恶性肿瘤之一,其发病率及死亡率双高。尤其在我国,按国家癌症中心给出数据显示,目前肺部恶性肿瘤在我国发病率位居所有癌肿之首。对于肺部恶性肿瘤的治疗,随着研究深入,治疗呈现多样化,但对于中早期的肺部恶性肿瘤,仍然是以外科手术为主的综合性治疗。SEER数据库收录的对于我国1973年~2015年肺癌流行病学调查显示[1],手术治疗病例约占1/3,仍然存在大部分患者无法通过外科手术切除。这部分患者多因肿瘤出现转移无法外科手术切除,但也存在部分早期或局限性肺部肿瘤患者,因自身原因无法耐受全麻手术或拒绝外科手术治疗,对于该部分患者,介入或立体定向放疗往往发挥着较好的治疗效果[2]。本文主要分析在高州市人民医院施行的CT引导下肺肿瘤氩氦刀冷冻消融病例资料并结合相关文献,分析该治疗模式临床开展的安全性、可行性及有效性。现报道如下:
1 对象与方法
1.1 一般资料
收集2018年10月1日~2019年10月1日在高州市人民医院施行的10例CT引导氩氦刀冷冻消融治疗肺癌病例临床资料。所有病例术前完善心肺功能检查、脑部MR、胸部+上腹部CT增强、骨ECT检查,并完善术前临床分期。年龄47~85岁。其中1例85岁高龄无法耐受传统外科手术及肿瘤放化疗治疗;3例因肺功能差无法耐受全麻手术;1例鼻咽癌放疗后,出现右上肺肺部局限性肿瘤并因肿瘤位置深,外科手术切除范围大,患者拒绝外科手术治疗;5例患者为肺癌晚期,行靶向药物治疗或化疗后,肿瘤局限,控制良好。患者一般情况见表1。
1.2 方法
根据患者肿瘤病变位置及CT引导情况,选取合适体位(置针容易、消融范围最大化、患者舒适),充分显露术野,常规消毒、铺巾。清点穿刺针配件。
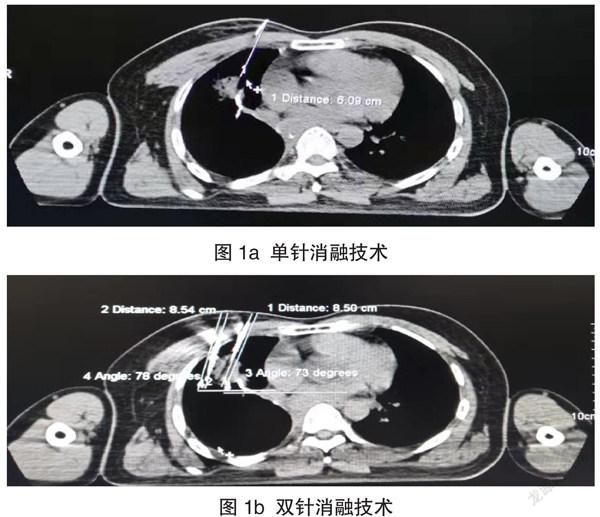
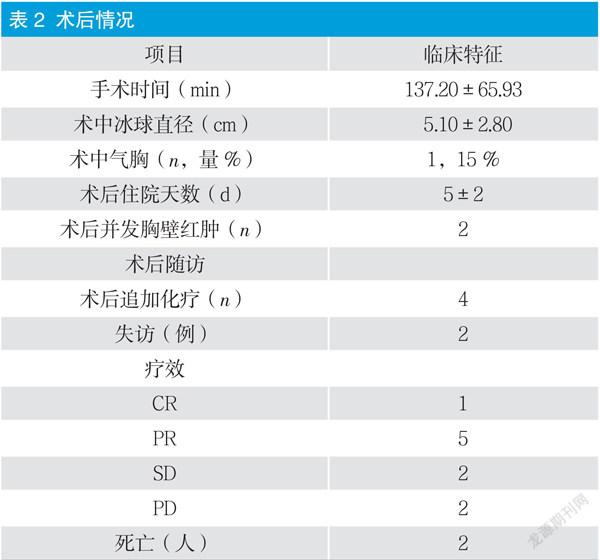
局部胸壁浸润麻醉后,于CT定位点为穿刺点,置入氩氦刀(根据消融范围选取单根或多根,见图1);氩氦刀完全穿破肿瘤基底部,启动氩氦刀10 min,复查CT,肿瘤已完全被冰球覆盖;根据肿瘤大小,选取循环次数,每个循环10 min,复查CT,无明显血气胸。复温完全后予拔除氩氦刀。复查胸部CT无明显血气胸后,术后返回病房继续治疗。
1.3 观察指标
手术时间、冰球直径(冷冻后,复温前,最大冷冻范围直径)、术中并发症发生情况(以术后2周为时间节点)、术后住院天数、术后随访情况(以术后2年为时间节点)。
2 结果
2.1 围手术期相关指标
手术时间60~220 min;冰球直径3.50~7.00 cm;术中发生气胸1例,气胸小于20 %,无须留置胸腔闭式引流及胸腔穿刺抽气;術后住院天数3~7 d;术后胸壁红肿2例,均无需额外处理自行好转。
2.2 术后随访情况
术后追加化疗4例,随访2年,失访病例2人。随访内容:每3月复查胸部CT平扫,于术后6月复查胸部CT增强,其案例3术后第6月复查PET-CT,提示原肺部病变PET-CT未见明确糖代谢异常。随访期间因肿瘤出现广泛转移而死亡2人,死亡时间分别为术后5月及术后13月。
3 讨论
3.1 CT引导下肺肿瘤氩氦刀冷冻消融术安全性
10例患者中,在围手术期,均未发生严重并发症,其中1例术中消融期间发生15 %气胸,无需额外施行胸腔闭式引流术,同时对术中无明显影响。术后2例患者出现置针处红肿并疼痛,但均无皮肤破损及坏死,7 d后,红肿逐步消退,随后患者顺利康复出院。虽然病例报道少,但复习相关文献显示,冷冻消融术临床应用于肺部肿瘤时间不长,在原发性肺部肿瘤或肺部孤立性肿瘤中的治疗资料很少,但均呈现较好安全性[3]。在消融治疗中,射频消融在欧美国家使用较多,同时多应用于非膈肌平面、远离肺门及胸膜结构;在亚洲国家,微波消融应用较多,与射频消融术原理都是通过热能达到肿瘤治疗目的,因而其安全性与射频消融相似。而冷冻消融不同于射频消融及微波消融,主要通过冷冻损伤及冷热交替汇聚效应使得肿瘤坏死,同时疼痛反应及周围组织副损伤相比其他两种消融技术小。目前上,对于氩氦刀副反应,主要报道存在冷休克、血小板降低、肿瘤溶解综合征及周围组织损伤。
3.2 CT引导下肺肿瘤氩氦刀冷冻消融术可行性
本文中使用氩氦刀治疗肺部肿瘤,其中1例因高龄肺功能差,无法耐受全麻手术;1例患者为其他癌肿肺部单发转移;3例患者为姑息性冷冻治疗;5例患者为经过全身治疗控制后的肺部局限性病变。目前可供查阅文献显示,氩氦刀在肺部肿瘤性病变主要应用于:手术不能切除,或不能完全切除,或切除风险较大的原发性病灶;因心、肺、肝功能等原因,体质过弱,不宜手术的患者;病人拒绝传统外科手术;肺部肿瘤术后局部复发的病人,无法耐受二次手术;其他癌肿肺部孤立性转移性癌灶。氩氦刀冷冻消融治疗工作原理主要分为两部分:降温及升温,其中降温主要分两阶段,第一阶段(温度-4℃~-21℃)细胞外冰晶形成:冷冻初期,细胞外冰晶形成,细胞内水分进入细胞外,引起细胞内渗透压上升,细胞内脱水。失去水分的细胞变得皱缩,细胞膜和细胞器因此而受损。第二阶段(温度下降至-21℃以下)细胞内冰晶形成:当冷冻速度极快,温度进一步降低时,细胞内冰晶形成,冷冻消融为纯物理性损伤,温度-40℃以下组织可以达到彻底消融;而近冰球边缘部组织依据其对冷冻损伤的敏感性可以产生不同程度的冻伤。复温后,组织水肿,周围血小板聚集,形成微血栓,组织局部缺氧及局部微血管破坏,导致肿瘤缺血性坏死[4]。同时对于肿瘤直径超过3 cm的患者,采用双针或多针治疗模式,该治疗模式主要为了实现更好达到适行的消融范围、更高的消融效率。
3.3 CT引导下肺肿瘤氩氦刀冷冻消融术有效性
氩氦刀冷冻消融技术应用于肺部肿瘤性病变,时间不长,可供查阅文献不多,但就目前报道的文章中,均获得较好的阳性结果[5]。在目前较为理想的消融范围是目标消融容积约为病变外1 cm。本研究中存在2例患者病变范围广泛,基于安全性原则,只行了姑息性冷冻消融治疗,术后追加化疗治疗。随访期间,这两例患者出现肿瘤进展,并最终出现远处肿瘤转移。其余8例患者,在随访期间,均获得SD以上治疗效果,其中1例患者经PET-CT检查,证实无明确的高代谢情况,临床评估为完全缓解。此外,本研究中5例复查结果提示PR。总体体现出该术式的高有效率。最后本研究中4例患者术后追加化疗治疗,2例患者出现较好的治疗疗效。这主要参考了冷冻消融治疗具备延迟损伤作用,其中微血管破坏作用为延期损伤之一,微血管破坏后,抗肿瘤性药物更容易进入瘤体。同时,目前免疫治疗已广泛应用于临床,Daniel等研究显示,冷冻消融可起到免疫调控作用,肿瘤细胞反复冻融后,细胞内抗原物质释放,联合免疫治疗药物,可启动对肿瘤细胞的免疫杀伤作用[6]。
CT引导下氩氦刀肺部肿瘤冷冻消融术,对于无法耐受全麻外科手术治疗、心肺功能差无法耐受立体定向放疗治疗或拒绝放化治疗的,孤立性、局限性肺部肿瘤,该术式显示出了微创、高效、低毒优势,为该部分患者肿瘤治疗提供另外一条路径。
参考文献
[1]Lu T , Yang XD, Huang YW, et al.Trends in the incidence, treatment, and survival of patients with lung cancer in the last four decades[J].Cancer Manag Res. 2019,11:943–953.
[2]Li H , Shen YF,Wu YZ.et al. Stereotactic Body Radiotherapy Versus Surgery for Early-Stage Non–Small-Cell Lung Cancer[J]. Journal of Surgical Research,2019,243:346–353.
[3]Thierry DB, Lambros T, David W,et al.Evaluating Cryoablation of Metastatic Lung Tumors in Patients-Safety and Efficacy The ECLIPSE Trial-Interim Analysis at 1 Year[J].Journal of Thoracic Oncology,2015,10(10):1468-1474.
[4]Baust J G , Gage A A , Bjerklund Johansen T E , et al. Mechanisms of cryoablation: Clinical consequences on malignant tumors[J]. Cryobiology, 2014, 68(1):1-11.
[5]魏穎恬,肖越勇.影像学引导肺癌冷冻消融治疗专家共识2018版[J].中国介入影像与治疗学,2018,15(5):5.
[6]Daniel K, Shirley W,Daniel H.Immunological Aspects of Cryoablation of Non–Small Cell Lung Cancer: A Comprehensive Review[J].Journal of Thoracic Oncology,2018,13(5):624-635.
