利用InDel标记对青梗菜新品种15039进行纯度鉴定
2021-05-18王群刘洁赵道松方小雪
王群,刘洁,赵道松,方小雪
(宁波微萌种业有限公司,浙江 宁波 315100)
青梗菜(BrassicarapaSSP.Chinensis)为十字花科、芸薹属作物,起源于中国。青梗菜生长周期短,适应性广,可以随时播种、持续采收,对于克服春、冬季蔬菜淡季供应不足,保证蔬菜均衡供应,调节市场供应起着重要作用。近年来,随着青梗菜栽培面积扩大和国内市场对优质青梗菜品质需求的提升,青梗菜常规品种因整齐度差、退化等问题渐渐被淘汰,而青梗菜杂交品种因整齐度高、抗病性强、商品性好等优势越来越受人们喜欢。
随着市场对优质青梗菜杂交种的需求量增加,青梗菜杂交种的质量问题逐渐引起人们关注。在青梗菜杂交种制种过程中常因混有亲本自交系种子或其他品种种子等生物学混杂问题影响种子纯度,因此,对青梗菜杂交种进行纯度鉴定是保证杂交种质量的必要步骤之一。目前我国青梗菜纯度鉴定主要以田间表型鉴定为主,此方法简单、直观,但受环境差异影响大、鉴定周期长且费工占地、表型特征判断不易把握[1],因此,建立青梗菜杂交种纯度室内快速鉴定方法十分必要。
随着分子标记技术的发展,SSR分子标记被广泛应用于蔬菜种子纯度鉴定工作中,前人利用SSR分子标记技术完成黄瓜、甜瓜、辣椒等作物的纯度鉴定[2-4]。SSR标记在十字花科作物中也得到应用,如青梗菜速俊109杂交种纯度SSR分子标记鉴定[5]。但用于纯度鉴定的SSR标记需从大量的引物库中进行筛选,耗时耗力,因此,需要一种更高效、准确的分子标记技术。近几年随着全基因组测序技术的发展,InDel标记也被成功应用于结球甘蓝、大白菜等十字花科蔬菜作物的纯度检测[6-8]。
本实验通过对青梗菜15039的亲本(W1、W2)进行全基因组重测序和数据分析,开发出可用于青梗菜15039纯度鉴定的InDel分子标记,为以后开展青梗菜大规模、高效的室内纯度鉴定奠定基础。
1 材料与方法
1.1 材料
供试材料青梗菜15039(正交组合152株、反交组合152株)及其亲本(W1、W2)种子由宁波微萌种业有限公司(以下简称微萌种业)提供,均种植于微萌种业育种基地。
1.2 方法
1.2.1 DNA提取
随机选取青梗菜15039及其父、母本植株各10株,用打孔器分别在青梗菜15039及其父、母本植株的嫩叶上取样,分别以青梗菜15039及其父、母本的嫩叶混合样品为材料提取DNA,获得青梗菜15039及其父本、母本的混合基因池。
青梗菜15039(正交组合152株、反交组合152株)植株叶片采用CTAB法进行单株DNA提取,用于纯度检测。
1.2.2 全基因组重测序及InDel位点筛选
父、母本混合基因池送到天津诺禾致源生物信息科技有限公司进行全基因组重测序,利用UltraEdit和Excel软件进行测序数据的对比和分析。
1.2.3 引物设计
重测序基因序列与白菜全基因组数据(Bra_Chromosome_V3.0)进行对比,得到raw date,数据过滤后对比筛选得到具有InDel差异的有效数据。从BRAD数据库(http://brassicadb.org/brad/blastPage.php)中下载白菜全基因组数据(Bra_Chromosome_V3.0),用Primer Premier 5.0软件在差异位点两侧保守区设计引物。为了确保扩增的特异性,引物设计参数特别考虑GC含量介于40%~50%、退火温度介于50~60 ℃,引物片段长度介于17~25 bp。
1.2.4 PCR体系的构建
PCR扩增采用近岸蛋白质科技有限公司的2×Taq Master Mix。
PCR体系为20 μL:DNA模板1 μL(DNA浓度50 ng·μg-1),正反向引物各1 μL(引物浓度10 ng·μL-1),2×Tap Master Mix 10 μL,超纯水7 μL。
PCR扩增程序为:94 ℃预变性5 min,94 ℃变性20 s,54 ℃退火20 s,72 ℃延伸40 s,循环32次,72 ℃延伸10 min,4 ℃保存1 h。PCR产物用2%琼脂糖凝胶检测。
2 结果与分析
2.1 引物筛选
通过对青梗菜15039亲本进行全基因组重测序数据分析设计出12对引物(表1)。12对引物对青梗菜15039及其父、母本的DNA扩增结果如图1,根据电泳结果筛选出3对具有多态性的引物jpk-1、jpk-3和jpk-7。其中引物jpk-1和jpk-3虽满足父、母本扩增存在差异及F1呈共显性的引物筛选要求,但父、母本扩增的条带片段差异较小,需电泳1.5 h后父、母本条带才会出现明显差异,耗时太长,因此,不选取这两对引物用于纯度鉴定。引物jpk-7母本扩增片段大小为225 bp,父本扩增片段大小为184 bp,父、母本扩增的条带片段差异大,带型清晰稳定,可用于青梗菜15039纯度鉴定。

M—maker;W1—母本;W2—父本;F1—杂交种15039;jpk-1~8—引物编号。

表1 12对InDel引物的序列
2.2 引物jpk-7检测青梗菜15039植株纯度
利用筛选出的引物jpk-7对田间种植的304株青梗菜15039(正交组合编号1~152,反交组合编号153~304)进行纯度检测,检测纯度率为96.05%。其中,正交组合(编号1~152)的152个单株中有9株母本植株,编号分别为57、86、91、102、111、123、131、143和150,其余143株都为杂交种,编号47~92单株扩增结果如图2所示,编号57、86和91植株只扩增出母本条带,缺少父本条带;反交组合(编号153~304)的152个单株中有3株父本植株,编号分别为188、218和279,其余149株都为杂交种,编号183~228单株扩增结果如图3所示,编号188和218号只扩增出父本条带,缺少母本条带。

M—maker;W1—母本;W2—父本;57、86、91—青梗菜15039母本。
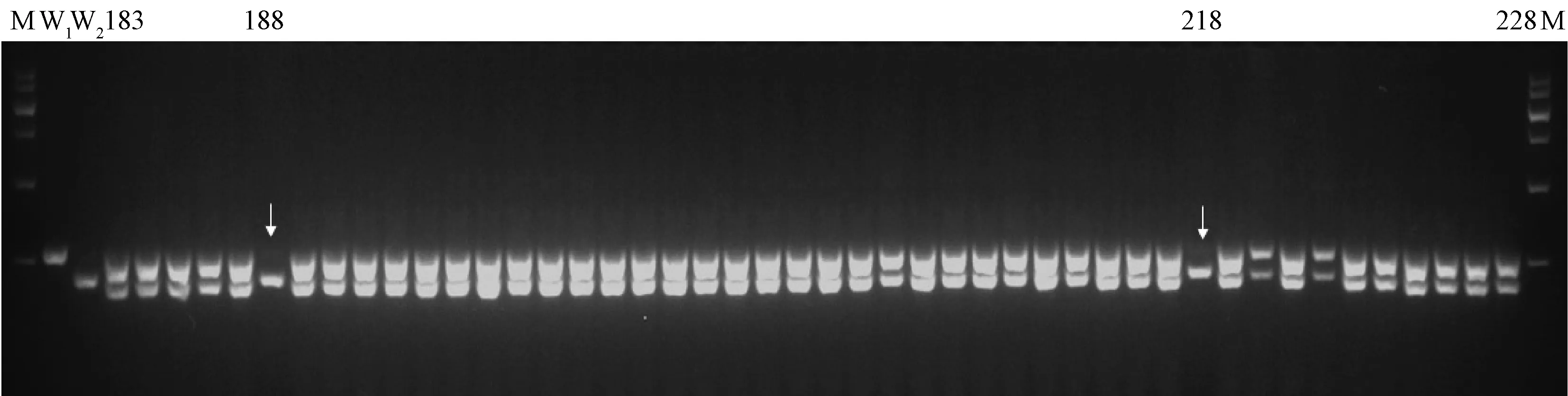
M—maker;W1—母本;W2—父本;188、218—青梗菜15039父本。
2.3 田间表型鉴定青梗菜15039植株纯度
304株青梗菜15039植株(正交组合编号1~152,反交组合编号153~304)定植后20 d开始观察记录植株田间表型性状,2~3 d观察一次,共观察5次。青梗菜15039母本植株与F1田间表型区别为株型较矮,叶脉纹路更明显,叶色浅绿无光泽;青梗菜15039父本植株与F1田间表型区别为株型较开展,叶片较小。经过田间表型鉴定,304株青梗菜15039植株纯度率为96.71%。其中正交组合(编号1~152)的152个单株中有7株母本植株,编号分别为57、86、91、102、123、143、150,其余145株认定为杂交种;反交组合(编号153~304)的152个单株中有3株父本植株,编号分别为188、218、279,其余149株认定为杂交种。
2.4 InDel标记检测与田间表型鉴定纯度结果对比
InDel标记检测与田间表型鉴定纯度结果如表2,InDel标记检测304株青梗菜15039中有12株亲本株,纯度率为96.05%;田间鉴定304株青梗菜15039中有10株亲本株,纯度率为96.71%。青梗菜15039反交组合的152个单株InDel标记检测结果与田间表型鉴定结果完全一致。青梗菜15039正交组合的152个单株InDel标记检测结果与田间表型观察鉴定结果基本相符,存在较小差异,田间表型观察结果为亲本的7个单株同时也全部被InDel标记检测为亲本,而编号111和131的植株田间表型鉴定结果为杂交种,但InDel标记检测为亲本。

表2 InDel标记与田间表型观察鉴定纯度结果的比较
3 小结与结论
近年来,SSR分子标记因引物广谱性、操作简单、成本低等特点,已经在水稻、油菜、玉米、小麦、西瓜、甜瓜、棉花等作物的种子纯度鉴定中得到广泛应用[9]。但随着全基因组测序技术的发展,InDel标记也逐渐进入大家视野并已成功应用于玉米、瓠瓜、大白菜等蔬菜作物中。InDel标记与SSR标记相比具有数量更丰富、稳定性和重复性更好、扩增产物分离效果更显著等优点[10]。并且针对检测材料设计的引物具有更高准确性,可以大大节省引物筛选时间,因此,会越来越受育种者关注。
本试验从12对InDel引物中筛选出3对具有双亲互补型的引物,选用其中1对条带差异大、稳定性高的InDel引物对青梗菜15039杂交种进行纯度鉴定。这对引物对304株青梗菜15039植株纯度检测结果与田间表型鉴定结果存在较小差异,检测结果相同的有302株,检测结果不相同的有2株,两者结果相同比例高达99.34%,因此,引物jpk-7可以应用于青梗菜15039植株纯度检测。
本试验为今后应用InDel标记检测青梗菜纯度积累了一定经验。首先,在进行分子检测结果与田间表型鉴定结果比对时,需在植株不同生长期对植株田间表型进行多次鉴定,以保证田间表型鉴定纯度结果的准确性。其次,考虑到分子标记纯度鉴定需要高通量快速进行,因此,筛选引物时需要综合考量引物的质量好、稳定性高与耗时短等因素。
