B6-Co 小鼠眼睑成纤维细胞生长曲线及HSP70表达研究
2021-05-18姬桂青邱天景瑾朱顺星邵义祥
姬桂青邱 天景 瑾朱顺星邵义祥*
(1.南通大学神经再生重点实验室,江苏 南通 226001; 2.华东师范大学第二附属中学,上海 201203;3.南通大学比较医学研究所,江苏 南通 226001)
先天性的角膜混浊(congenital corneal opacities,CCO)在新生儿中患病率只有1.4‰,虽然罕见但患病严重易致盲,如不能得到诊治,将会导致弱视,影响新生儿的视觉发育,或者波及其全身发育(引发生长迟缓等)[1]。 因此能够及早发现并治疗CCO,具有重要意义。 一般研究认为常见的CCO 病因主要有两种:一是外胚叶发育障碍性的角膜混浊,由于外胚叶的晶状体和囊泡不能正常地分离外胚叶;二是炎症引起角膜混浊(母体内血液或羊水感染)[2]。 前一种发育障碍主要是常染色体显性遗传因素导致,但深入机制尚不明确,这与先天性眼睑闭合不全(eyelid open at birth,EOB)模型鼠[3]的现象极为相似。
EOB 小鼠在出生时眼睑开放,这种异常现象可能是导致后代小鼠眼部疾患的重要原因[4]。 有研究发现通过ENU 诱变建立的B6-Co 突变系小鼠即具有EOB 特征[5-7]。 两种小鼠角膜组织全蛋白二维凝胶电泳结果显示,相比C57BL/6 小鼠(以下简称:B6 小鼠),B6-Co 小鼠电泳结果发现蛋白质点显著上调的有6 个,显著下调的蛋白质点有13 个,其中HSP70 下调最为显著[8]。 热休克蛋白70(HSP70)是热休克蛋白家族中被研究最多的一种,尤其是对HSP70 家族的结构、功能以及表达调控机理的研究较多[9-10],HSP70 在细胞的周期调控[11]、胚胎发育[12-14]、衰老中具有重要的生物学功能[15]。而前期实验[8]检测两种老鼠眼睑组织内HSP70 蛋白表达差异性显著,所以HSP70 与B6-Co 小鼠EOB表型出现可能存在联系。
因此,本实验选取从突变系B6-Co 小鼠和正常B6 小鼠(取18.5 d 孕鼠腹中胚胎)中取材培养的成纤维细胞[16-20],验证HSP70 在两种细胞中的含量是否存在差异,通过小干扰敲低B6 成纤维细胞HSP70 表达,检测其迁移能力变化。 为体外验证HSP70 的表达能否调控两种细胞的生物学行为提供前期基础。
1 材料和方法
1.1 实验动物
实验所用SPF 级C57BL/6 小鼠雌鼠20 只、雄鼠10 只(18~22 g,误差小于10%)以及其突变系B6-Co 小鼠(SPF 级,18 ~22 g 误差小于10%)雌鼠10 只、雄鼠5 只,选用小鼠均为8 周龄,均由南通大学实验动物中心提供[SCXK(苏)2019-0001]。 前期实验取材于南通大学实验动物中心[SYXK(苏)2017-0045]完成。 实验鼠饲养于SPF 级屏障动物房内,室内温度(21 ± 1)℃,相对湿度(55 ± 5)%,自由采食和自由饮水,昼夜明暗交替时间12 h/12 h,定期更换笼具、垫料,实验过程中所有操作符合实验动物福利要求,获得南通大学实验动物伦理委员会批准(IACUC:20180808-001)。 B6 雄性与B6雌性小鼠以1 ∶2比例配对,共5 笼;B6-Co 雄性小鼠与B6 雌性或B6 雄性与B6-Co 雌性小鼠以1 ∶2比例配对,共5 笼。 每天早上8 点前检栓,见栓当日胚龄记为0.5 d。
1.2 主要试剂与仪器
CO2细胞培养箱(Thermo);倒置相差显微镜(Leica);Transcriptor First Strand cDNA Synthesis kit(Roche,REF:04897030001);0.25% 胰蛋白酶(含EDTA)(Hyclone)、总RNA 提取试剂(TRIzol)(生工,Lot:FB06KB3578);SDS - PAGE Preparation kit凝胶试剂盒(生工,C631100-0200);GAPDH 一抗(Abcam,ab9485);HSP70 一抗(Abcam,ab2787);lysis buffer(生工,G301DB0009);胎牛血清,FBS(Gibico,美国);DMEM 高糖培养基(Gibico,美国)

表1 根据HSP70 基因设计siRNA 序列Table 1 Design siRNA sequence based on HSP70 gene
1.3 实验方法
1.3.1 分离和培养小鼠眼睑成纤维细胞
取妊娠期18.5 d 的孕鼠麻醉消毒,剖腹取胎鼠(观察B6-Co 胎鼠的眼睑部开闭,眼睑开启则为EOB 表型小鼠,眼睑关闭则舍弃,B6 孕鼠腹中胎鼠则全部可用)的眼睑组织剪碎,胰酶消化,100 目、40目网筛梯度过滤,离心,完全培养基重悬,放于37℃、5% CO2培养箱中培养;24 h 后换新鲜完全培养基。 细胞按照1 ∶3传代,传代3 次以上待用。
1.3.2 小鼠眼睑成纤维细胞的观察
将细胞传代培养到第3 代时,将细胞接种于圆玻片上,进行细胞爬片;待细胞密度约80%,弃去培养基,PBS 洗涤,70%乙醇固定过夜,PBS 轻洗细胞;苏木素染色20 min,自来水清洗。 伊红染色2 s,自来水清洗。 乙醇梯度脱水透明,滴加中性树胶盖玻片,拍照。
1.3.3 小鼠眼睑成纤维细胞的鉴定
将细胞传代培养到第3 代时,将细胞接种于圆玻片上,进行细胞爬片;待细胞密度约80%,弃去培养基,PBS 洗涤细胞,进行固定、通透、封闭等常规细胞免疫荧光染色步骤,在荧光显微镜下观察拍照。
1.3.4 检测小鼠眼睑成纤维细胞的生长曲线
取对数生长期细胞,每孔种2×104个细胞。 将接种好的细胞培养板放入培养箱中培养过夜,每组设3 个复孔取均值,实验重复3 次。 在培养1 d、2 d、3 d、4 d、5 d、6 d 和7 d 后直接血球计数板进行细胞计数。
1.3.5 两种成纤维细胞内HSP70 mRNA 含量检测
从18.5 d 的孕鼠体内获取B6-Co 和B6 胎鼠,从其眼睑部位取材培养成纤维细胞待其传代3 次之后种六孔板,重复3 次。 通过常规方法提取RNA、逆转录和Real-time PCR(目的基因以内参基因的GAPDH进行校正,每个样本3 次重复。 根据HSP70 基因mRNA 设计RT-PCR 反应引物:GAPDH:Primer-F:5’-GGAGCGAGACCCCACTAAC-3 ’; Primer-R: 5 ’-GGCGGAGATGATGACCCT-3’. HSP70:Primer-F:5’-CCAAGGTGCAGGTGAAC TACAAGG-3’; Primer-R:5’-GCCGCTGAGAGTCGTTGAAGTAG-3’.)使用2-ΔΔCT法进行相对定量分析。
1.3.6 Western blot 检测眼睑成纤维细胞内HSP70蛋白相对表达量
在两种细胞培养至第3 代后,接种细胞,收集3次样本,提取两种细胞的全蛋白、电泳(80 V,120 V)、转膜(300 mA,90 min),室温封闭2 h。 一抗4℃孵育过夜(1/1000),PBST 洗3 × 10 min。 二抗室温孵育2 h(1/1000),PBS 洗3 × 20 min,显影。
1.3.7 siRNA-HSP70 的设计与合成
在NCBI 数据库查询小鼠HSP70 基因序列(Accession Number:NM_010478.2),最终设计3 条siRNA 序列、1 条NC 序列进行合成,见表1。 siRNAHSP70 的合成委托上海吉玛制药技术有限公司。
1.3.8 siRNA-HSP70 转染B6 小鼠眼睑成纤维细胞
B6 小鼠眼睑成纤维细胞种于12 孔板中,待密度达到50%~60%时,取2 μL siRNA-HSP70 溶于100 μL Opti-MEM 基 培 中, 再 取 2 μL Lipofectamin2000 溶于100 μL Opti-MEM 基培中,混匀后,室温各孵育5 min;再将两者混匀,室温孵育20 min;成纤维细胞换液,更换成基础培养液800 μL;混合液加入12 孔板中,混匀,细胞37℃,5%CO2培养箱中培养6 h 后更换成完全培养液。 细胞转染后48 h 提取总RNA、72 h 提取总蛋白。
1.3.9 Transwell 检测眼睑成纤维细胞迁移能力的变化
本实验选用直径6.5 mm, 孔径8 μm 的Transwell 小室;0.25%胰酶将转染的细胞消化,以DMEM 基础培养基重悬并调整细胞浓度至每毫升5×105个细胞;加100 μL 细胞悬液至Transwell 上室,加入500 μL DMEM 培养基(含5%胎牛血清)至Transwell 下室,于CO2培养箱中培养24 h;取出Transwell 小室,吸尽培养基,PBS 清洗3 次;放入4%多聚甲醛中固定20 min;弃固定液,PBS 摇床洗10 min;放入结晶紫中室温染色10 min;PBS 轻洗2 次,每次5 min;用脱脂棉擦去小室上表面细胞,显微镜下取5 个视野拍照计数,以备后续统计、分析。
1.4 统计学方法
采用STATA V16.1 统计学软件进行数据处理,用GraphPad Prism 8 软件进行统计作图。 数据结果用平均数±标准差(±s)表示,获得数据分析为正态性分布,采用配对t检验,当P<0.05 视为差异有统计学意义。
2 结果
2.1 成纤维细胞形态
使用倒置相差显微镜观察从B6 和B6-Co 小鼠眼睑取出的成纤维细胞,在400 倍镜下可以看出两种成纤维细胞都呈现梭形、星型、多角型。 但是B6小鼠的成纤维细胞更为舒展,且胞体较大;而B6-Co小鼠的眼睑成纤维细胞在400 倍镜下发现其边缘较为粗糙,形态与B6 相比更为狭小,见图1。
2.2 通过免疫荧光法鉴定B6 和B6-Co 小鼠成纤维细胞
使用免疫荧光技术鉴定原代取材的细胞,根据文献查阅发现:使用眼睑部位皮肤进行原代取材一般存在两种细胞:成纤维细胞与角质形成细胞。 因此使用Vimentin (波形蛋白)和Cytokeratin (细胞角蛋白)进行免疫荧光染色(图2、图3),因为波形蛋白是成纤维细胞的标志性蛋白,而细胞角蛋白是角质形成细胞的标志性蛋白。 所以从图2、图3 中发现,在B6 与B6-Co 两种成纤维细胞中的细胞质里,发现被染色的波形蛋白,而没有出现细胞角蛋白,说明成纤维细胞纯度达到100%。 因此,可以证明原代取材B6 和B6-Co 小鼠眼睑部位成纤维细胞成功。
2.3 通过HE 染色观察B6 和B6-Co 小鼠成纤维细胞
HE 染色方法主要是用苏木素染核呈蓝色,而伊红染色主要是染细胞胞浆。 从图4 可以发现,绝大多数细胞呈长梭形,胞浆为红色,细胞核被染成蓝色,符合成纤维细胞特征。 B6 和B6-Co 小鼠成纤维细胞在HE 染色上没有显著性差别。
2.4 通过血球计数板法检测B6 和B6-Co 小鼠成纤维细胞生长
通过血球计数板计数法,原代取材培养三代以后,胰酶消化后离心弃上清,重悬沉淀,人工计数,种板——每孔约2×104个。 之后7 d 定时通过数值统计,得出图5 的两种细胞生长曲线。 可以发现两种细胞都呈现增殖趋势,但在第7 天略微下降,细胞长满进入平台期。 而B6 小鼠成纤维细胞数量统计每天都略高于B6-Co 小鼠成纤维细胞数量,B6 小鼠成纤维细胞第1 天后即进入指数增长期,B6-Co 则在第2 天进入指数增长期,因此由图5 可以判定,B6-Co 小鼠成纤维细胞增殖速度显著低于B6 正常成纤维细胞增殖速度(P<0.01)。
2.5 通过Real-time PCR 法检测B6-Co 和B6 小鼠成纤维细胞内HSP70 mRNA 的表达
通过常规方法提取RNA 进行Real-time PCR 实验,从图中发现,B6-Co 小鼠眼睑部位成纤维细胞HSP70 mRNA 表达量低于B6 小鼠眼睑成纤维细胞,且二者具有显著性差异(图6)。
2.6 通过Western blot 检测B6-Co 和B6 小鼠成纤维细胞内HSP70 蛋白表达量
通过Western blot 实验发现,B6-Co 小鼠眼睑部位成纤维细胞的HSP70 蛋白表达量低于B6 小鼠成纤维细胞,且二者具有显著性差异(图7)。
2.7 siRNA-HSP70 对HSP70 基因的干扰效率
在转染48 h 后,通过Real-time PCR 验证HSP70 基因mRNA 水平的干扰效率;在转染72 h后,通过Western blot 验证HSP70 基因蛋白水平的干扰效率。 结果表明(图8):各组均能对靶基因的mRNA 及蛋白表达产生抑制作用,siRNA-HSP70-3组较其他组抑制作用最强,B6 小鼠眼睑成纤维细胞HSP70 基因的表达量下降最为显著,干扰效率高达70%以上(P<0.01),以上结果表明siRNA-HSP70-3 能够有效靶向抑制HSP70 基因的表达,保证后续实验的有效开展。

注:A:波形蛋白;D:细胞角蛋白;B、E:DAPI 染色;C、F:合成图。图2 免疫荧光鉴定B6 小鼠的眼睑成纤维细胞Note. A, Vimentin. D, Cytokeratin. B/E, DAPI staining. C/F, Merge.Figure 2 Immunofluorescence identification of orbital fibroblasts from B6 mice

注:A:波形蛋白;D:细胞角蛋白;B、E:DAPI 染色;C、F:合成图。图3 免疫荧光鉴定B6-Co 小鼠的眼睑成纤维细胞Note. A, Vimentin. D, Cytokeratin. B/E, DAPI staining. C/F, Merge.Figure 3 Immunofluorescence identification of orbital fibroblasts from B6-Co mice
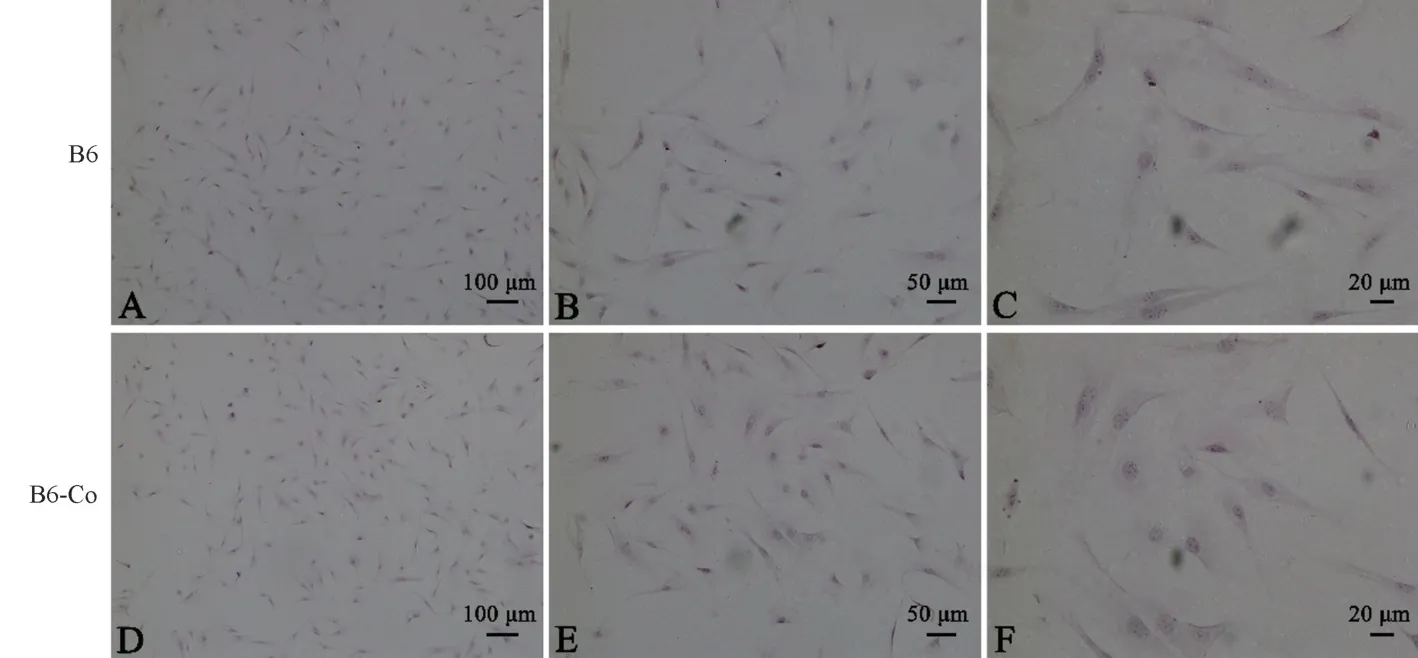
注:A/B/C:B6 小鼠眼睑成纤维细胞;D/E/F:B6-Co 小鼠眼睑成纤维细胞。图4 HE 染色鉴定B6 与B6-Co 小鼠眼睑成纤维细胞Note. A/B/C, B6 mouse orbital fibroblasts. D/E/F, B6-Co mouse orbital fibroblasts.Figure 4 HE staining of B6 and B6-Co mouse orbital fibroblasts
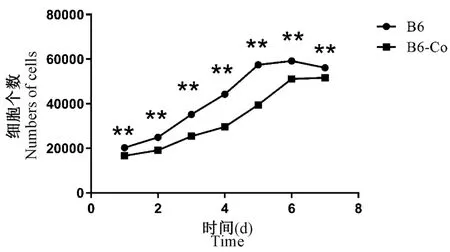
注:血球计数板计数B6 和B6-Co 小鼠成纤维细胞个数,与B6 组相比,**P <0.01。图5 B6 和B6-Co 小鼠成纤维细胞生长曲线Note. The number of fibroblasts in B6 and B6-Co mice was counted by blood cell counting plate. Compared with the B6 group, **P <0.01.Figure 5 Growth curve of fibroblasts in B6 and B6-Co mice

注:Real-time PCR 检测B6-Co 和B6 小鼠成纤维细胞内HSP70 mRNA 表达量。 与B6 组相比,**P <0.01。图6 B6-Co 和B6 小鼠成纤维细胞内HSP70 mRNA 表达量对比Note. The expression of HSP70 mRNA in B6-Co and B6 mouse fibroblasts was detected by Real-time PCR.Compared with the B6 group, **P<0.01.Figure 6 Comparison of HSP70 mRNA expression in fibroblasts of B6-Co and B6 mice
2.8 siRNA-HSP70 对B6 成纤维细胞迁移能力的影响
通过Transwell 迁移实验检测HSP70 基因下调后成纤维细胞的体外迁移能力,由实验结果(图9)可知,siRNA -HSP70 组的成纤维细胞,在Transwell 小室接种培养24 h 后,其穿过小室的细胞数量极显著低于siRNA -NC 组(P<0.01),这表明敲低HSP70 基因能够显著降低B6 成纤维细胞的体外迁移能力。
3 讨论
先天性角膜混浊(congenital corneal opacities,CCO)是一种较为罕见的遗传性疾病,目前对于CCO 的诊断治疗仍在不断探索之中,而对发育障碍引发的角膜混浊一直广受眼科学研究者关注。
发育障碍引发角膜混浊主要由遗传因素导致,这与EOB 模型鼠的现象类似。 人类胚胎时期眼睛的发育过程一般有以下几个过程:眼睑生长——覆盖眼球——全部融合——重新打开(出生后)[16]。在小鼠胚胎期眼睛发育过程中,同样经历上下眼睑生长——覆盖眼球——全部融合——重新打开的过程[4],与人类不同的是正常小鼠出生时闭眼,至出生后12 ~14 d 才睁眼。 而EOB 表型的小鼠在出生时即睁眼,这种异常现象是导致后代小鼠眼部患病的重要原因之一。 B6-Co 突变系小鼠出生时眼睑即张开,使得幼年期眼部易受病原体感染[5],不能保护小鼠眼睛的正常发育,从而易患角膜炎,进而逐步发展为角膜混浊,与人类角膜混浊的发病机制极为相似,是研究人类CCO 的良好疾病动物模型。

注:Western blot 检测B6-Co 和B6 小鼠眼睑成纤维细胞内HSP70 蛋白表达及其统计图。 与B6 组相比,*P <0.05。图7 B6-Co 和B6 小鼠眼睑成纤维细胞内HSP70 蛋白表达量对比Note. Western blot was used to detect the expression of HSP70 protein in B6-Co and B6 mouse eyelid fibroblasts and its statistical diagram. Compared with the B6 group, *P <0.05.Figure 7 Comparison of HSP70 protein expression in fibroblasts of B6-Co and B6 mice

注:A:Real-time PCR 检测成纤维细胞在转染siRNA-HSP70 后HSP70 mRNA 的相对表达量;B:Western blot 检测HSP70 蛋白的表达量;C:B 的统计结果。 与siRNA-NC 组相比,*P<0.05,**P<0.01。图8 siRNA-HSP70 对HSP70 基因的干扰效率Note. A, Real-time PCR was used to detect the relative expression of HSP70 mRNA in fibroblasts after transfection with siRNA-HSP70. B,Western blot to detect HSP70 protein expression. C, B statistical results. Compared with the siRNA-NC group, *P<0.05, **P<0.01.Figure 8 The interference efficiency of siRNA-HSP70 on HSP70 gene

注:A:siRNA-NC 组穿过Transwell 小室的成纤维细胞;B:siRNA-HSP70 组穿过Transwell 小室的成纤维细胞;C:A、B 的统计图。 与siRNA-NC 组相比,*P<0.05。图9 siRNA-HSP70 对成纤维细胞迁移能力的影响Note. A, Fibroblasts passing through Transwell chamber in siRNA-NC group. B, Fibroblasts passing through Transwell chamber in siRNAHSP70 group. C, Statistical charts for A and B. Compared with the siRNA-NC group, *P <0.05.Figure 9 Effect of siRNA-HSP70 on migration ability of fibroblasts
HSP70 蛋白是热休克蛋白家族中被研究较多的一种蛋白,大多数研究者关注在HSP70 家族的结构、功能以及表达调控机理方面的研究[11-14]。 在前期实验中通过比较两种小鼠角膜组织蛋白分析发现突变系B6-Co 小鼠中HSP70 基因的表达量显著下调[8],所以B6-Co 小鼠体内HSP70 表达量的进一步降低可能影响了眼睑成纤维细胞增殖迁移[16]能力,导致其胚胎期上下缘眼睑无法正常生长融合,导致该小鼠出生时的EOB 表型。 有研究表明,HSP70 在细胞内的含量可能与胚胎发育中保护与被保护有关[21],细胞内HSP70 的表达量的高低可能影响成纤维细胞在胚胎期发育[22-27]。 眼睑边缘部位细胞迁移障碍是引发B6-Co 出现EOB 表型的重要原因,因而成纤维细胞的迁移运动能力强弱是小鼠出生前眼睑愈合重要因素。 而实验(图9)通过小干扰实验敲低B6 小鼠成纤维细胞HSP70 的表达,使用Transwell 检测细胞迁移能力,发现成纤维细胞的迁移能力被显著性降低(P<0.05)。
本实验结果表明,B6 和B6-Co 小鼠胚胎期眼睑成纤维细胞内HSP70 的mRNA 表达量和蛋白表达量存在显著差异,与两种小鼠角膜组织蛋白二维凝胶电泳的结果一致。 说明HSP70 基因及蛋白表达下调影响了B6-Co 的成纤维细胞生长曲线,同时下调HSP70 表达降低了成B6 纤维细胞迁移能力。 因此HSP70 基因可能参与成纤维细胞胚胎期发育的调控,最终造成B6-Co 小鼠EOB 表型。 HSP70 基因如何调控成纤维细胞的增殖、迁移和凋亡? 其他相关基因又是如何影响成纤维细胞的生长发育? 眼睑、眼附属器以及眼角膜等胚胎发育过程中的协调机制又是如何实现的? 这一系列问题均有待于持续深入研究才能阐明,而B6-Co 小鼠将来能否作为眼病研究的动物模型还需进一步探讨。
