印记基因XIST和H19 DNA甲基化水平与猪克隆胚胎发育效率关联分析
2021-05-18石俊松吴珍芳李紫聪
张 宁,余 波,石俊松,吴 霄,吴珍芳,李紫聪
(1 华南农业大学 动物科学学院/国家生猪种业工程技术研究中心,广东 广州 510642; 2 广东温氏种猪科技有限公司,广东 云浮 527400)
1962年世界上第1例体细胞克隆动物诞生[1],1962年英国发育生物学家Gurdon利用蟾蜍幼体的肠上皮细胞作为供体细胞进行体细胞核移植,最终发育成为了蝌蚪。但是总体而言克隆技术发展较为缓慢,直到世界上第1例体细胞克隆哺乳动物Dolly羊的诞生[2],体细胞克隆技术得到快速的发展,体细胞克隆技术相继在奶牛[3]、小鼠[4]、山羊[5]、猪[6]、狗[7]、水牛[8]、骆驼[9]、猴[10]等动物上获得成功。与此同时动物体细胞克隆技术在保存和复制扩繁优秀生产性状的农业动物、保存或恢复濒危甚至是已灭绝的动物、作为异种器官移植的供体动物以及治疗性克隆、转基因生物反应器生产药物蛋白和人类疾病模型的构建中拥有着广泛的作用。
虽然克隆技术在很多领域上都有着广泛的应用,但是就目前来说克隆技术的发展依然非常的缓慢,其中最主要的原因是克隆效率的限制。以猪为例,猪的克隆效率普遍只有1%~3%[11]。导致克隆效率低的原因主要有供体核表观遗传修饰的异常以及动物体细胞克隆中各种复杂的试验技术。表观遗传修饰主要包括DNA甲基化、组蛋白修饰、基因组印记、X染色体失活[12-13]。其中DNA甲基化在众多基因组的表观遗传修饰中是极为重要的[14]。DNA甲基化的异常会导致很多功能基因的异常表达,尤其是印迹基因(XIST、H19)的异常表达将会导致克隆胚胎的异常发育[15]。Jiang等[16]在死亡的克隆猪上发现XIST基因的异常表达。Wianny等[17]发现H19基因在哺乳动物的胚胎发育中有着重要的作用,而且完全敲除H19基因将导致胚胎死亡。
XIST是X染色体失活的关键基因。XIST基因在体外受精(Invitrofertilization,IVF)和体内受精(Invivofertilization,IVV)的胚胎中仅在父系来源的X染色体上表达,但是在克隆动物的早期胚胎中父系来源和母系来源的X染色体都会被激活。母系来源X染色体XIST基因的异常表达会导致母源X染色体的失活以及早期胚胎整体转录物的改变[18],从而可能导致早期胚胎以及胚胎附植后发育异常。Nolen等[19]在2005年研究发现在克隆小鼠的囊胚期阶段出现了2条X染色体都失活的现象。同时在很多研究中都发现在克隆胚胎中X染色体相关基因的大规模下调[20-21]。所以在小鼠上通过使用敲除XIST的细胞系作为供体细胞代替体细胞或者在克隆胚胎1细胞期注射人为设计的针对XIST基因的小干扰RNA极大地提高了胚胎的发育效率[20-21]。H19基因是发现得比较早的1个印记基因,位于猪的2号染色体上,编码1个2.3 kb的非编码RNA分子[22]。H19基因与胚胎的生长发育有很重要的关系,有研究发现H19基因的失活可以导致新生雌性胎儿的体质量比正常高27%[23]。
本研究利用同一头猪来源的耳朵成纤维细胞培养得到14个细胞克隆团,以这些克隆团为供体细胞进行体细胞核移植试验,并且统计了各克隆团的囊胚率以及各囊胚的XIST和H19基因调控区的DNA甲基化水平,以期找到与猪克隆胚胎发育效率相关的重要印记基因的表观遗传修饰,为将来通过调控相关的印记基因的表观遗传修饰或表达来提高猪克隆效率提供基础。
1 材料与方法
1.1 试验材料
亚硫酸盐转化试剂盒EZ DNA Methylation-GoldTMKit、ZymoTaqTMPreMix(ZYMO RESEARCH公司);普通PCR用的TaqMix(广州东盛生物科技公司);TA连接试剂InsTAcloneTMPCRCloningKit(上海拜力生物科技有限公司);DL500 DNA Marker (大连宝生生物工程有限公司);PCR 产物纯化试剂盒 E.Z.N.A Cycle-Pure Kit、氨苄青霉素(Amp)(北京天泽生物制品有线公司);核酸染料(北京康润诚业生物科技有限公司)。
1.2 试验方法
1.2.1H19、XIST基因差异甲基化区域的选择 已经有文献报道H19的差异甲基化区域(Differentially methylated region, DMR)[24],参考这些研究报道利用甲基化引物设计网站(http://www.urogene.org/methprimer/)在H19基因 (GenBank: AY044827.1)的启动子区域设计甲基化引物,扩增并检测该区域的片段。本研究的XIST基因的DMR位于XIST基因的5′端的侧翼区域,是由Xu等[25]在2013年发现的。
1.2.2H19的 2个等位基因含有父母本差异碱基的供体细胞的筛选和获取 从广东温氏食品有限公司挑选26头杂交公猪(品种包括杜洛克×二花脸,大约克夏×莱芜和四元杂商品猪),每头公猪采集耳组织样品并抽提DNA。通过PCR扩增H19基因的调控区(CTCF3片段附近),并将PCR产物测序来寻找H19的2个等位基因含有父母本差异碱基的公猪。把该头猪的耳朵成纤维细胞通过单细胞接种,产生14个相同遗传背景的单细胞克隆团,分别作为供体细胞制备克隆胚胎。因公猪只有1条X染色体,只携带1个X染色体连锁的XIST等位基因,不用区分其父母本等位基因。
1.2.3 体细胞核移植、胚胎收集 在广州嘉禾望岗屠宰场收集猪的卵巢,将收集到的卵巢用含双抗和生理盐水的4 L保温瓶保存好,快速运回实验室。用未开封的一次性注射器将卵母细胞从3~8 mm的卵泡中抽提出来。将抽提好的卵泡液倒入50 mL的细胞用的离心管中静置10 min,小心去除上清液,再用DPBS缓冲液清洗3次沉淀。将清洗好的沉淀吸到10 cm细胞培养板中,挑选完好的复合体。将选好的复合体培养成熟,然后用透明质酸酶处理,将处理好的复合体用口吸管在体视镜下挑选出排出第一极体的成熟卵母细胞,在Spindle-view系统下观察进行去核操作。将挑选好的体细胞注入已去核的形态结构完整的卵母细胞卵周隙中,然后将重构胚胎激活。最后将激活好的胚胎置于培养箱中培养,本试验的核移植是在下午进行的,当天作为核移植的第0天,在第7天下午统一收集胚胎,并记录形态,将每个囊胚单独收集到1个PCR管中,样品暂时保存在−80 ℃冰箱中。
1.2.4 胚胎亚硫酸测序 分批使用 EZ DNA Methylation-DirectTMKit处理样品,试验操作流程参照试剂盒说明书,产物保存在−20 ℃冰箱。因为胚胎样品的浓度低(DNA质量浓度通常低于1 ng/μL),所以使用巢氏PCR对产物进行扩增,引物序列如表1所示。巢氏PCR分成2轮扩增。第1轮PCR酶为ZymoTaqTMPreMix。反应程序如下:95 ℃ 10 min,94 ℃ 30 s、55 ℃ 30 s、72 ℃ 30 s、30 个循环,72 ℃7 min,16 ℃ 1 h。反应体系为15 μL。第 2 轮,以稀释2倍的第1轮产物为模版,PCR酶为普通Taq酶。反应程序如下:95 ℃ 3 min,94 ℃ 25 s、59 ℃25 s、72 ℃ 25 s、45 个循环,72 ℃ 10 min,16 ℃ 1 h。将经过2轮巢氏PCR扩增好的产物吸取10 μL点在30 g/L的琼脂糖凝胶上电泳,将有明显条带的样品回收并且测定其浓度。最后将产物连接、转化、挑菌、送华大基因测序,每个样品至少要获得10个以上的有效测序结果。

表 1 猪H19和XIST基因巢氏PCR引物信息Table 1 Primer information for nest PCR of porcine H19 and XIST genes
1.2.5 数据处理及统计分析 对测序结果编号,存为fas格式,再用BiQ Analyzer软件进行分析,制作高分辨的甲基化串珠图。利用SPSS25.0的单因素ANOVA 程序的LSD 方法对甲基化水平进行多重比较。利用Pearson相关系数(r)将XIST基因、H19基因甲基化水平与囊胚率进行相关性分析。r>0为正相关,r<0为负相关;|r|<0.3,相关性极弱;0.3≤|r|<0.5,低度相关;0.5≤|r|<0.8,中度相关;|r|≥0.8,高度相关;|r|>0.95,存在显著相关[26]。
2 结果与分析
2.1 H19父母本差异碱基的寻找
在H19基因的CTCF3片段附近设计引物对26头杂交公猪样品进行检测,最后筛选到有1头猪的样品有差异碱基(图1)。然后设计引物进行测序,测序结果如图2所示。在图中可以明显的看到在某些序列上的差异,一些序列里几个位点全部为A,而另一些序列里几个位点全部是G。于是用A和G来区分父母本2个等位基因,最后分开分析细胞克隆团囊胚H19基因的甲基化结果。
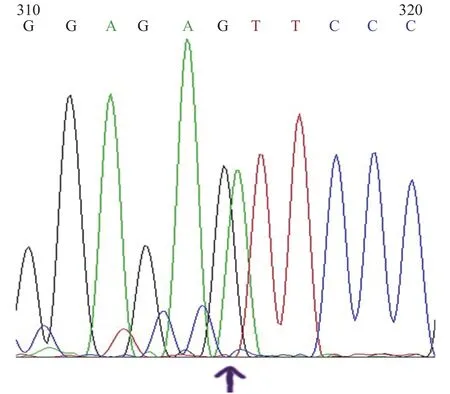
图 1 差异碱基测序峰图Fig.1 Differential base sequencing peak diagram

图 2 H19基因父母本差异碱基的测序结果Fig.2 H19 gene sequencing results of differential bases of parents
2.2 H19基因差异甲基化区域选择结果
H19基因差异甲基化区域是通过设计甲基化引物再将其扩增得到的。其扩增的区域如图3所示,该区域的总长度为241 bp,共有15个CpG岛。
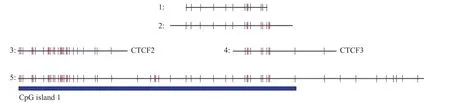
图 3 H19基因差异甲基化区域Fig.3 Differential methylation regions of H19 gene
2.3 胚胎收集情况统计
统一在核移植后的第7天下午收集胚胎,在显微镜下观察胚胎的形态并进行记录。具体的统计结果如表2,共使用了14个细胞克隆团(编号为:1、2、4、5、6、7、8、9、10、11、13、14、15、20)进行核移植试验,得到418个重构胚胎,收集到90个囊胚。其中以14号克隆团作为核移植的供体细胞囊胚率最高,为38.2%,以1号克隆团为核移植的供体细胞囊胚率最低,为8.6%。以8号克隆团作为供体细胞进行核移植试验只得到1个囊胚,囊胚数太少,没有被用于后续试验。

表 2 胚胎收集情况统计Table 2 Statistics of embryo collection
2.4 细胞克隆团囊胚的XIST基因的甲基化结果以及与囊胚率的关联分析
利用亚硫酸盐测序统计了87个囊胚XIST的甲基化情况,其中有77个囊胚数据是有效的(每个囊胚有10个以上的有效测序结果,表示该囊胚的数据是有效的)。对不同单细胞克隆团XIST基因DNA甲基化水平以及囊胚率进行比较(图4),其中14号克隆团的甲基化水平最低,仅为16.68%,1号克隆团的甲基化水平最高,为65.04%。与此同时为了研究不同单细胞克隆团囊胚XIST基因甲基化程度之间的差异,利用单因素 ANOVA 程序的 LSD方法对甲基化水平进行多重比较,结果(图4)表明10、14、20号克隆团的甲基化水平显著低于1、4号克隆团(P<0.05)。

图 4 不同单细胞克隆团制备的囊胚的XIST基因DNA甲基化水平和囊胚率Fig.4 The DNA methylation levels and blastocyst rates of XIST genes of blastocysts prepared from different single-cell cloning groups
为了研究单细胞克隆团囊胚的XIST基因的DNA甲基化水平与该单细胞克隆团为供体细胞得到的囊胚率之间的关联性,对2组数据进行Pearson相关系数分析和回归分析(图5)。得到的Pearson相关系数r=−0.812 5,|r|>0.8,R2=0.660 2,所以单细胞克隆团囊胚的XIST基因的甲基化程度与囊胚率间有高度负相关性。

图 5 不同单细胞克隆团制备的囊胚的XIST基因DNA甲基化水平与囊胚率的关联分析Fig.5 The correlation analysis between the DNA methylation levels of XIST genes and the blastocyst rates of blastocysts prepared from different singlecell cloning groups
2.5 细胞克隆团囊胚的H19基因的甲基化结果及与囊胚率的关联分析
由于父母本差异碱基的存在,细胞克隆团囊胚H19基因的DNA甲基化水平统计结果以等位基因A和G分开统计结果,分为A侧和G侧。A侧等位基因总共有56个囊胚数据是有效的,这56个囊胚是以13个细胞克隆团为供体细胞克隆得到的;其中DNA甲基化水平最高的细胞克隆团是6号克隆团,均值为5.12%,最低为9号克隆团,均值为0.61%(图6)。G侧等位基因总共得到了54个有效结果,包括12个细胞克隆团的DNA甲基化水平;其中DNA甲基化水平最高的细胞克隆团是4号克隆团,均值为90.92%,最低为11号克隆团,均值为72.69%(图7)。A侧等位基因的DNA甲基化水平整体趋近于0,G侧等位基因DNA甲基化水平为60%~100%。对H19基因A侧等位基因DNA甲基化水平的多重比较结果(图6)显示,只有6号克隆团与2号、9号、11号、20号间的DNA甲基化水平有显著差异(P<0.05)。对H19基因G侧等位基因DNA甲基化水平进行多重比较,图7的结果表明在12个克隆团中只有4号和14号克隆团间存在显著差异(P<0.05)。

图 6 不同单细胞克隆团制备的囊胚的H19基因A侧等位基因的DNA甲基化水平和囊胚率Fig.6 The DNA methylation levels and blastocyst rates on the A allele sides of H19 genes of blastocysts prepared from different single-cell cloning groups
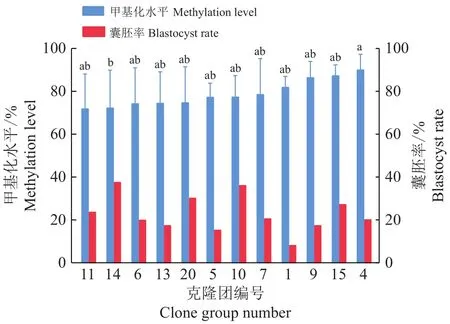
图 7 不同单细胞克隆团制备的囊胚的H19基因G侧等位基因的DNA甲基化水平和囊胚率Fig.7 The DNA methylation levels and blastocyst rates on the G allele sides of H19 genes of blastocysts prepared from different single-cell cloning groups
对H19基因A侧和G侧等位基因DNA甲基化水平与囊胚率2组数据进行Pearson相关性分析,H19基因 A 侧的相关系数r=−0.164 7,|r|<0.3,R2=0.027 1(图 8);H19基因 G 侧的相关系数r=−0.309 8,0.3<|r|<0.5,R2=0.096(图9)。表明H19基因A侧等位基因DNA甲基化水平与囊胚率间相关性极低,H19基因G侧等位基因DNA甲基化水平与囊胚率间有低度的负相关性。

图 8 不同单细胞克隆团制备的囊胚的H19基因A等位基因侧DNA甲基化水平与囊胚率的关联分析Fig.8 The correlation analysis between the DNA methylation level on the A allele sides of H19 genes and the blastocyst rates of blastocysts prepared from different single-cell cloning groups

图 9 不同单细胞克隆团制备的囊胚的H19基因G侧等位基因DNA甲基化水平与囊胚率的关联分析Fig.9 The correlation analysis between the DNA methylation levels on the G allele sides of H19 genes and the blastocyst rates of blastocysts prepared from different single-cell cloning groups
3 讨论与结论
本研究选取的XIST基因差异甲基化区域(DMR)来自Xu等[25]对猪的XIST基因的研究,该研究证明了精子和卵母细胞的XIST基因区域出现典型的差异甲基化现象,并且研究了该DMR甲基化程度和表达量的关系以及药物处理对不同阶段克隆胚胎的XIST基因甲基化程度的影响[25]。H19基因的DMR的选择是参考了相应的文献[24],在H19基因的启动子区域设计甲基化引物合成的。本试验利用亚硫酸盐测序检测了囊胚XIST基因和H19基因的DNA甲基化状态。研究结果表明各单细胞克隆团生产的囊胚XIST基因的DNA甲基化水平为16.68%~65.04%,各囊胚XIST基因DNA甲基化水平间是存在差异的,尤其是14号克隆团的基因甲基化水平显著低于多个克隆团;而各单细胞克隆团生产的囊胚H19基因A侧的DNA甲基化水平为0.61%~5.12%,接近0,H19基因的G侧DNA甲基化水平为72.69%~90.92%,各克隆团间H19基因DNA甲基化水平的差异不明显。
同时本研究也统计了以各个克隆团为核供体细胞的囊胚率,并利用Pearson法分析了XIST基因DNA甲基化水平与囊胚率间的相关性。结果表明单细胞克隆团囊胚XIST基因DNA甲基化水平与囊胚率间存在极强的负相关关系(r=−0.812 5),即克隆团囊胚的XIST基因DNA甲基化水平越低,克隆团囊胚率就相应地越高。与此同时,Mao等[27]通过4个生物学重复中收集统计了第7天IVF雌性和雄性的混合胚胎(囊胚),发现其所研究的区域的XIST基因DNA甲基化水平为(0.6±2.4)%,与克隆胚胎相比IVF得到的囊胚的XIST基因DNA甲基化水平远低于克隆胚胎。因此我们提出一个猜想,在克隆动物囊胚期我们所研究的XIST基因DMR甲基化程度越低则越有利胚胎的存活。该结果可为,研究表观修饰小分子辅助药物DNA甲基化转移酶抑制剂 (DNMTi)如 5−杂胞苷 (5-azaC)、RG108[28-30]等通过降低DNA甲基化水平来提高克隆效率提供基础。
利用Pearson法分析H19基因A侧和G侧等位基因DNA甲基化水平与囊胚率间的相关性,结果表明H19基因A侧等位基因DNA甲基化水平与囊胚率间只有低度的负相关性(r=−0.164 7),H19基因G侧等位基因DNA甲基化水平与囊胚率间只有极低的负相关性(r=−0.309 8)。因此根据已有的试验数据得出一个初步的结论,克隆胚胎H19基因的DNA甲基化水平对克隆胚胎的发育效率没有显著影响。但是胚胎的样本量太少,其中1号、5号、15号克隆团H19基因G侧等位基因只有2个甲基化水平的结果,所以本试验研究H19基因的差异甲基化区域对克隆胚胎发育效率的影响结论只是一个初步探索的结论。
本试验的研究结果可以为在体细胞核移植中的精英细胞理论猜想提供一个初步的探索结果。在诱导多功能干细胞 (Induced pluripotent stem cell,IPSC)的研究中提出了精英细胞的猜想,而且提出了精英模型、诱导精英模型、随机模型[31]。李美蓉[32]的研究将IPSC重编程中表达多潜能转录分子的细胞称为精英细胞,同时也将在初始细胞群中能表达目的细胞表征性表面标记的细胞定义为精英细胞。Ogura[33]通过了10年的努力对不同细胞类型和基因型的供体细胞进行评估和筛选,最终利用小鼠的129株细胞株作为供体细胞显著提高了克隆效率。本试验从公猪的体细胞中培养得到了14个克隆团,其中14号、10号克隆团的囊胚率是所有克隆团中最高的,分别为38.2%和36.7%。利用亚硫酸盐测序得到14号、10号克隆团XIST基因的DNA甲基化水平为16.68%和23.50%,是所有克隆团最低的,也是最接近IVF胚胎的甲基化水平(0.6%)。14号和10号克隆团是一种低甲基化高克隆效率的供体细胞,符合我们理想中的供体细胞即精英细胞。然而上述的结论和结果需要统计验证更多的不同类型的供体细胞的囊胚的甲基化水平与囊胚率,最终得到一种能显著提高克隆胚的发育效率的供体细胞。
