非酒精性脂肪性肝病患者肠道炎症与肠道菌群失调的相关性研究
2021-05-18黄泽鑫杨妙芳杨雅蓉汪芳裕
黄泽鑫,杨妙芳,杨 钊,杨雅蓉,汪芳裕
0 引 言
非酒精性脂肪性肝病(non-alcoholic fatty liver disease,NAFLD)指除酒精及其他明确肝损伤因素所导致,以肝细胞内脂肪过度沉积为主要特点的临床病理综合征。在我国,NAFLD患病率高达15%~30%,并已取代乙型肝炎成为第一大慢性肝病[1];然而关于其发病机制目前仍未完全阐明。近年研究表明,NAFLD的发生、发展与肠道菌群的失调存在密不可分的关系[2-4]。肠道发生菌群失调、致病菌增多更容易引发肠道炎症,进而破坏肠黏膜屏障,通过肠-肝轴对肝造成损伤,促进NAFLD的发生发展。
粪便钙卫蛋白(fecal calprotectin,FC)主要存在于中性粒细胞,其含量占中性粒细胞胞浆蛋白的40%~60%[5]。当肠黏膜发生炎症反应时,中性粒细胞迁移、聚集到肠道炎症部位,并释放大量的钙卫蛋白,最终随粪便排出体外。因此,FC含量成为肠道炎症反应的经典指标,可反应肠道内炎症水平[6-7]。既往研究表明,NAFLD患者的FC水平显著高于健康人群[8];但其与患者肠道内菌群失调的相关性尚不明确。本研究旨在通过检测NAFLD患者的FC及粪便菌群多样性,探讨肠道炎症与肠道菌群失调之间的相关性。
1 资料与方法
1.1研究对象回顾性分析2019年3月至2019年7月期间我院脂肪肝联合专病门诊就诊的NAFLD患者(病例组)临床资料;选取同期符合纳入和排除标准的体检者作为健康对照组。参照2018年更新的《非酒精性脂肪性肝病防治指南》[9],NAFLD患者的纳入标准:①无过量饮酒史或饮酒在过去12个月每周饮用乙醇男性<210 g、女性<140 g;②肝B超符合弥漫性肝细胞脂肪变的影像学表现。排除标准:①患有酒精性肝病、基因3 型 HCV 感染、肝豆状核变性、自身免疫性肝炎等可致脂肪肝的特定肝病;②药物(他莫昔芬、乙胺碘呋酮、丙戊酸钠、甲氨蝶呤、糖皮质激素等)、全胃肠外营养、炎症性肠病、乳糜泻、甲状腺功能减退症、库欣综合征等导致脂肪肝的特殊情况[10]。记录研究对象个人信息、现病史、既往病史、吸烟饮酒史、治疗情况以及近1个月用药情况等。
1.2标本收集及处理所有研究对象空腹抽取静脉血2 mL。使用全自动生化分析仪(Hitachi 7600)检测血糖、尿酸、谷丙转氨酶(ALT)、谷草转氨酶(AST)、谷氨酰转肽酶(GGT)、TG、TC、HDL(日本第一化学株式会社试剂盒)。当天留取新鲜粪便5 g,并将粪便分装至EP管储存于-80℃冰箱待测。采用ELISA法检测粪便钙卫蛋白(瑞士Schnenbuch,Bühlmann)。称取待测粪便50 mg,溶于提取液2450 μL中,混匀后静置;30 min 后取上清液1 mL,以2000×g离心5 min。取离心后上清液和标准品各100 μL。采用ELISA法检测,FC>50 μg/g提示肠道炎症。应用16s rRNA基因测序检测粪便样本菌群多样性。
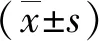
2 结 果
2.1一般情况本研究最终纳入NAFLD组18例、HC组12例。两组患者年龄、性别、尿酸、TG、TC、HDL等差异无统计学意义(P>0.05);但NAFLD组的空腹血糖、AST、ALT、GGT等指标均明显高于HC组(P<0.05)。见表1。
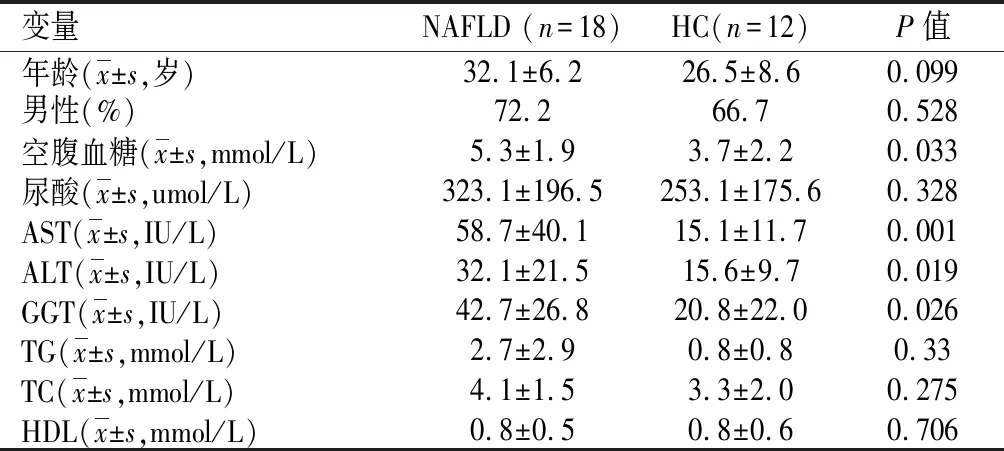
表 1 NAFLD组与HC组一般资料比较
2.2FC含量NAFLD患者的FC含量为61.2±60.0 μg/g,明显高于HC组[(17.3±16.7)μg/g],差异有统计学意义(P<0.05)。
2.3NAFLD组与HC组肠道菌群的差异16s rRNA基因测序结果显示,NAFLD组与HC组肠道菌群均主要由厚壁菌门(Firmicutes)、拟杆菌门(Bacteroidetes)及变形菌门(Proteobacteria)构成,但在菌群结构上存在显著差异,见图1。与HC组相比,NAFLD组的变形菌门显著增加(P<0.05)。通过在菌群属水平作进一步的分析,结果显示NAFLD组的埃希菌属(Escherichia)较HC组明显增加(P<0.01)。见图2。

a:变形菌门; b:埃希菌属
2.4FC含量与变形菌门、埃希菌属相对丰度的相关性分析在NAFLD组中,用FC含量分别与变形菌门及埃希菌属相对丰度作Spearman相关性分析,结果显示FC含量与变形菌门相对丰度呈正相关(r=0.625,P<0.05);同时与埃希菌属相对丰度也呈正相关(r=0.629,P<0.01)。见图3。

a:变形菌门; b:埃希菌属
3 讨 论
肠道炎症参与NAFLD的发生、发展。Gäbele等[11]诱导NASH模型小鼠肠道发生炎症反应后,小鼠静脉血中脂多糖含量增多,最终导致肝炎症、纤维化加重。临床工作中也发现NAFLD患者存在明显的肠道急慢性炎症,主要表现为末端回肠炎及结直肠息肉。目前临床常规采用结肠镜检来评估肠道炎症;但其具有侵入性、风险大、费用高,且不能全面评估肠道(包括小肠)炎症水平,结果不易量化等缺点。相比之下,粪便FC检测用于评估肠道炎症具有无创、费用低、准确度高等优点[12]。本研究采用FC检测评估NAFLD患者肠道炎症水平,结果表明NAFLD患者的FC含量显著高于对照组,提示NAFLD患者存在明显的肠道炎症。在一项针对儿童肥胖与NAFLD相关性的研究中,Demirbas[13]等发现,肥胖患儿FC水平较正常儿童明显升高;此外,在肥胖患儿中,患NAFLD病例组的FC水平进一步增高,与本研究结果一致。
肠道菌群在调节炎症、肥胖和代谢性疾病方面具有重要作用[14]。NAFLD与肠道菌群失调存在密切的关系。NAFLD患者存在肠道菌群失调,其中包括致病菌增多,益生菌减少。Verdam等[15]发现肥胖的受试者群体细菌多样性降低,同时可能引起炎症反应的变形菌门丰度升高。FC仅在拥有肥胖菌群的受试者中可明显检测。这提示肥胖患者肠道菌群失调与肠道炎症密切相关,肥胖相关的菌群成分可能具有促炎效应。Ponziani等[16]的研究结果显示,NAFLD相关的肝硬化病人中,其粪便菌群中的肠杆菌科与链球菌丰度增加,Akkermansia菌减少,并且Akkermansia菌与FC的含量呈负相关,这也说明肠道菌群与肠道炎症具有明显的相关性。本研究结果证实NAFLD患者粪便菌群中的变形菌门及埃希菌属增加,并且均与FC呈现正相关,与上述的结果相似。这可能是因为NAFLD患者肠道菌群失调导致变形菌门、埃希菌属等致病菌增多,产生有害的代谢物质导致肠道炎症的发生。
本研究显示,在NAFLD患者中,埃希菌属作为变形菌门中显著增多的菌属,与肠道炎症的产生及NAFLD的发生、发展具有密切的关联。埃希菌属产生酒精破坏肠黏膜屏障的完整性,促使肠道炎症的发生。Zhu等[17]的研究发现,NASH 患者内源性酒精水平较健康人显著增加,且与大肠埃希菌的丰度呈正相关。Guercio等[18]的研究显示,肥胖儿童其肠道通透性、内源性酒精与内毒素相比正常儿童均较高。埃希菌属可在肠道中代谢产生内源性酒精,后者使肠黏膜通透性增加,更有利于内毒素等有害物质透过肠道屏障进入门静脉,激活肝脏TLR4等通路产生炎症反应[19-20]。Carpino等[21]同时在人类和小鼠的研究中发现,大肠埃希菌的脂多糖可能通过TLR4通路加重NAFLD的肝损伤。上述的研究说明,埃希菌属在加重NAFLD肠道炎症的同时,产生的有毒物质可能通过肠-肝轴进一步加重疾病进展。本研究中FC含量与埃希菌属相对丰度呈正相关,表明肠道菌群失调导致的埃希菌属增多,可能是加重肠道炎症、导致NAFLD进展的重要因素。本研究为单中心的回顾性研究,样本量较小,研究结果尚不能推广到其他地域和人群中,未来多中心、更大样本量的研究仍有待开展。
综上所述,本研究发现NAFLD患者存在肠道炎症与肠道菌群失调,两者间存在一定的相关性,在NAFLD发生、发展中发挥重要作用。该研究可能为临床NAFLD开发新的治疗靶点提供科学依据。
