靶向阻断CXCR4对上皮性卵巢癌细胞CD44和CD133表达的影响*
2021-05-18陈永香杨梦月彭仁国曹言言訾聃
陈永香,杨梦月,彭仁国,曹言言,訾聃
(1.贵州医科大学 临床医学院,贵州 贵阳 550025;2.贵州医科大学附属医院 妇产科,贵州 贵阳 550004; 3.贵州医科大学 组织工程与干细胞实验中心,贵州 贵阳 550025)
上皮性卵巢癌是常见的妇科肿瘤,全球每年有12.5万患者死于卵巢癌,严重威胁女性患者的身心健康[1],通常情况下疾病诊断时已为晚期,80%的患者出现播散性的瘤体形成[2]。目前,卵巢癌的治疗主要是手术联合化疗,但多数患者在完成初级治疗后复发[3]。2005年,Bapat等[4]率先发现卵巢癌干细胞(ovarian cancer stem cell,OCSC),为卵巢癌的发生提供了新的理论依据。研究表明,除了OCSC外,卵巢癌中还存在具有干细胞特性的肿瘤细胞亚群[5]。肿瘤干细胞的研究中通常会选择与干细胞相关的蛋白质作为观察指标,目前已知的肿瘤干细胞标志物有很多,如分化抗原簇133(cluster of differentiation 133,CD133)、分化抗原簇44(cluster of differentiation 44,CD44)、分化抗原簇117(cluster of differentiation 117,CD117)、乙醛脱氢酶1家族成员A1(aldehyde dehydroge-nase, ALDH1A1)、分化抗原簇326(cluster of differentiation 326,CD326)及分化抗原簇24(cluster of differentiation 24,CD24)等[6-9],其中CD133、CD44在卵巢癌中较为常见[10-11]。卵巢癌易发生转移,除与本身的因素相关,还与趋化因子受体4(chemokine receptor 4,CXCR4)相关[12]。趋化因子-12(C-X-C motif chemokine ligand-12 ,CXCL12)是CXCR4特异性配体,二者在发育中至关重要,但也参与了多种病理过程[13]。目前小干扰核糖核酸(small interfering RNA,siRNA)介导基因沉默、肿瘤的免疫治疗等对卵巢癌侵袭转移方面的研究已很多[14],但靶向阻断CXCR4来探讨其对OCSC特征影响方面的研究很少,因此,本研究拟通过检测上皮性卵巢癌细胞中CXCR4的表达,并利用其靶向阻断剂普乐沙福(AMD3100)处理卵巢癌细胞后,探究CXCR4对卵巢癌肿瘤细胞干细胞特征的影响。
1 材料与方法
1.1 材料
1.1.1细胞株和主要试剂 卵巢上皮癌细胞株(human ovarian cancer cell line-3, OVCAR-3)购自昆明医科大学细胞库中心,高糖培养基(dulbecco's modified eagle medium , DMEM),AMD3100(美国MedChemExpress),全细胞裂解液(radio-Immunoprecipitation assay,RIPPA),1 ∶500 CXCR4抗体(美国R&D),1 ∶500 CD133(美国Abcam),1 ∶100 CD44抗体(美国CST)。
1.1.2主要仪器 SW-CJ-1FD超净工作台(苏州金净),3111 CO2恒温培养箱和FRESCO 21低温离心机(美国Thermo),4 ℃、-20 ℃ BCD-190TMPK冰箱(青岛海尔),B20-TEKELX800UV酶标仪(美国宝特),ECLIPSE TS100光学显微镜及LHS-H100P-1显微照相系统(日本 Nikon),PowerpacTMBasic电泳仪(美国 BioRAD)。
1.2 方法
1.2.1细胞培养与分组 常规利用DMEM培养基将OVCAR-3细胞置于5%CO2的37 ℃恒温培养箱中培养,每2~3 d更换1次培养基,取对数期细胞分为对照组(0 mg/L AMD3100处理)、低浓度组(10 mg/L AMD3100处理)及高浓度组(100 mg/L AMD3100处理)。
1.2.2Western blot试验 取对数期各组细胞,裂解各组细胞收取细胞总蛋白,分离蛋白后脱脂,室温封闭2 h根据蛋白量剪切条带后分别加CXCR4、CD44及CD133抗体孵育,4 ℃过夜,TBST漂洗后,分别加二抗室温孵育2 h漂洗,加DAB显色液,待阳性区带显色清晰后拍照记录。
1.2.3细胞悬浮成球实验 取对数期各组细胞,将生长状态良好的细胞消化后离心,去掉含血清的培养基,PBS清洗2次,干细胞培养基重悬细胞,将384悬滴板置于准备好的6孔板顶上,将重悬液接种于384悬滴板中,过滤的去离子水800 μL吸移到每个边界贮存器中,在每个6孔板孔中加去离子水4~5 mL,进一步控制湿度;分别于加药处理后第2天、第7天倒置显微镜计数直径大于50 μm的悬浮球,计算并比较成球率(成球率=悬浮球/加入细胞数×100%)。
1.3 统计学分析
2 结果
2.1 CXCR4蛋白的表达
低浓度组和高浓度组OVCAR-3细胞的CXCR4蛋白表达分别低于对照组,且高浓度组也低于低浓度组,差异均有统计学意义(P<0.05)。见图1。

注:A为蛋白印迹试验结果,B为蛋白表达的定量结果;(1)与对照组比较,P<0.05;(2)与低浓度组比较,P<0.05。
2.2 CD133与CD44蛋白的表达
低浓度组和高浓度组OVCAR-3细胞中干细胞标志物CD133和CD44蛋白表达均分别低于对照组,且高浓度组也低于低浓度组,差异均有统计学意义(P<0.05)。见图2。
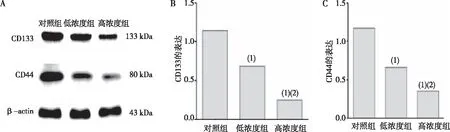
注:A为蛋白印迹试验结果,B、C分别为CD133和CD44蛋白表达的定量结果;(1)与对照组比较,P<0.05;(2)与低浓度组比较,P<0.05。
2.3 细胞悬浮成球能力
经AMD3100处理后,OVCAR-3细胞接种第2天时,对照组、低浓度组及高浓度组的细胞成球比例比较、差异均无统计学意义(P>0.05);当OVCAR-3细胞培养至第7天时,对照组细胞悬浮成球的比例分别低于低浓度组和高浓度组,且低浓度组也低于高浓度组,差异均有统计学意义(P<0.05或P<0.01)。见图3。

注:A为细胞悬浮成球试验结果(10×);B为肿瘤细胞悬浮成球比例的定量结果;与对照组比较,(1)P<0.05,(2)P<0.01;(3)与低浓度组比较,P<0.05。
3 讨论
卵巢癌是常见的妇科肿瘤,其转移和复发是卵巢癌患者死亡的原因[15]。CXCL12及其受体CXCR4在卵巢癌中高表达,并促进了卵巢癌的发展[16],趋化因子是细胞运输、相互作用及肿瘤发展的重要介质[12],CXCR4与其特异性配体CXCL12结合后可激活CXCR4-CXCL12轴,增加了癌细胞的细胞增殖、迁移及侵袭[17]。CXCR4在卵巢癌的高表达,为卵巢癌的治疗提供了新的思考,由于卵巢癌由于卵巢癌的耐药性和全身性副作用,传统的卵巢癌化疗方法受到限制,靶向治疗在卵巢癌的治疗中显得尤为重要,AMD3100与CXCR4具有高度亲和力[18],利用这一特性,展开本研究。本研究结果显示,CXCR4在上皮性卵巢癌细胞中高表达,在利用AMD3100阻断CXCR4后,CXCR4的表达降低,不同浓度对CXCR4表达的抑制也存在差异性。乳腺癌上皮循环肿瘤细胞上皮-间质转化表型谱分析提示,CXCR4、CD44阳性的患者循环肿瘤细胞最具有攻击性,淋巴结的转移、肿块的大小及死亡的风险都更严重[17]。Garg等[19]利用AMD3100阻断CXCL12可减缓胰腺癌肿瘤生长,并增加细胞毒性T细胞的肿瘤浸润;Erhart等[20]研究提示,所有研究的胶质瘤球体始终具有分子标记CD44/CD133阳性的细胞群;有关结肠直肠癌的研究也证实远端边缘富集CD133表达的患者,其复发率增加,无病生存率降低[21]。由此可以推断,CXCR4、CD44及CD133都对肿瘤的发生和发展产生了一定的促进作用。Rasti等[22]研究提示CXCR4可以作为肾癌靶向治疗的诊断和标记物;Abigail等[23]研究也显示,CXCL12/CXCR4轴在子宫内膜异位症细胞中可以促进细胞增殖、迁移和侵袭,同时诱导蛋白激酶B磷酸化和活性;Blagden[24]研究表明肿瘤内细胞亚群的异质性参与了肿瘤耐药性的发生;Landencn等[25]发现肿瘤干细胞标志物阳性的肿瘤细胞亚群,其耐药性更强,靶向治疗时将使耐药细胞对化疗的厌恶更加敏感。因此,本实验通过靶向阻断CXCR4后,CD44和CD133的表达与对照组相比,明显降低,悬浮成球的结果也表明靶向阻断CXCR4后上皮性卵巢癌的悬浮成球能力明显下降。
综上所述,在上皮性卵巢癌细胞中,CXCR4可促进CD44和CD133的表达,靶向阻断CXCR4可降低上皮性卵巢癌细胞的干细胞特征,但具体机制仍需进一步研究。
