过表达CagA对胃癌细胞中GLUT1表达的影响*
2021-05-18程薇杨丽萍周建奖谢渊全欣莹陈定宇王琴容赵艳
程薇,杨丽萍,周建奖,谢渊,全欣莹,陈定宇,王琴容,赵艳**
(1.贵州医科大学 地方病与少数民族性疾病教育部重点实验室 & 贵州省医学分子生物学重点实验室,贵州 贵阳 550004;2.贵州医科大学附属医院 临床医学研究中心,贵州 贵阳 550004)
胃癌是全球范围内最常见的恶性肿瘤之一,亦是症死亡的第3大原因[1]。近年来,虽然胃癌诊断和治疗方面取得了进展,但是5年生存率仍然低于30%,即使手术切除的胃癌患者也有50%~90%的复发和转移风险[2]。胃癌的发病机制较复杂,至今尚不明确,主要影响因素有幽门螺杆菌(Helicobacterpylori,H.pylori)感染、肿瘤微环境及基因表达失调,而H.pylori感染是重要的始发因素[3-5]。有研究表明,H.pylori长期感染会引发急性胃炎、慢性萎缩性胃炎、胃溃疡和胃黏膜相关淋巴组织淋巴瘤等胃部疾病,与胃癌的发生发展密切相关[6]。H.pylori细胞毒素相关基因A蛋白(cytotoxin associated gene A,CagA)是一种高免疫原性蛋白,分子量为120~140 kDa。细菌通过cagA毒力岛编码的IV型分泌系统(type IV secretion system, TFSS)将CagA转移到宿主细胞中,能与宿主细胞激酶相互作用,并参与酪氨酸磷酸化修饰[7];CagA也可以直接以未磷酸化状态发挥作用,从而影响细胞紧密连接、细胞极性、细胞增殖和分化、炎症反应的诱导以及信号传递[8]。肿瘤细胞代谢异常,即使在有氧条件下也偏好糖酵解,称为Warburg效应[9]。肿瘤细胞Warburg效应通常表现为生长迅速,摄取高水平的葡萄糖、谷氨酰胺,糖酵解增强、丙酮酸和乳酸堆积,这些与癌症的发生及预后不良密切相关[10]。偏好有氧糖酵解能为肿瘤细胞提供生存优势,但其机制并不完全清楚。有文献提示其主要影响因素有代谢酶改变、能量代谢改变、线粒体功能损伤、氨基酸代谢异常、基因失调、肿瘤微环境等[11]。研究证明,在肝癌细胞糖酵解途径中,葡萄糖转运蛋白GLUT1的表达明显上调[12]。本实验建立过表达glut1稳转AGS和BGD823胃癌细胞株,并用过表达cagA的腺病毒感染2株稳定转染细胞株,用免疫荧光检测过表达cagA对GLUT1表达的影响和细胞定位,为后续研究CagA引起胃癌细胞能量变化奠定实验基础。
1 材料与方法
1.1 材料
1.1.1细胞、质粒 胃癌细胞AGS购于ATCC公司(美国),BGC-823购于中国科学院上海细胞库,人原代胃癌细胞YHD由课题组前期分离保存。过表达CagA腺病毒载体由课题组构建和保存。glut1慢病毒载体pCDH-CMV-GLUT1-EF1-turboRFP-T2A-Puro及相应的空载体购于上海柯雷达生物技术公司,慢病毒的包装由公司完成。
1.1.2主要试剂和仪器 DMEM高糖培养基、澳洲胎牛血清、磷酸盐缓冲液(PBS)、青霉素/链霉素(10 000 U/mL)购于美国Gibco公司,二甲基亚砜(DMSO)、0.25% EDTA胰蛋白酶溶液购于美国Sigma公司,CagA和GLUT1抗体购于美国Cell Signaling Technology公司,内参GAPDH、β-actin抗体,羊抗兔、羊抗鼠辣根过氧化物标记二抗,羊抗兔、羊抗鼠荧光二抗均购于美国Proteintech公司,Triton X-100(中国索莱宝公司),SDS-PAGE蛋白电泳凝胶试剂盒(中国碧云天生物公司)。CO2恒温培养箱购自Thermo Fisher公司(美国),生物安全柜购于Esco公司(新加披),Obesever A1型倒置显微镜购于蔡司公司(德国),LSM 710激光共聚焦显微镜购于蔡司公司(德国),-80 ℃ 超低温冰箱购于海尔公司(中国),DYY-4C型电泳仪电源购于北京六一生物技术有限公司(中国),Mini-Sub cell GT水平电泳槽、Mini-PROTEAN Tetra垂直电泳槽购于Bio-Rad(美国),高速台式离心机、低速台式离心机购于Thermo Fisher Scientific(美国)。
1.2 方法
1.2.1过表达glut1慢病毒感染胃癌细胞株AGS、BGC823并筛选稳转细胞株 取对数生长期的原代胃癌细胞,以1×106个/孔的细胞量接种于6孔板,细胞汇合度至70%~80%,将3 μg过表达glut1质粒和5 μL Lipofectamine 2000分别与200 μL Opti-MEM培养基混匀,室温静置5 min。将质粒溶液加入Lipofectamine 2000溶液中,移液枪轻柔吹打混匀,室温静置20 min;每孔的培养基更换成0.6 mL不含FBS、双抗的DMEM高糖培养基,再将转染复合物均匀滴加到相应的实验孔中、混匀,放于37 ℃ 5% CO2培养箱培养;转染6 h后更换成新鲜的DMEM高糖完全培养基。24~48 h后,加入嘌呤霉素,终浓度0.002 mg/L,筛选稳转细胞株,以空载体慢病毒感染的AGS和BGC823细胞为对照。
1.2.2Western blot检测CagA、GLUT1的蛋白表达 转膜前预先使用甲醇活化PVDF 膜,根据目的蛋白分子量大小设定电压和时间,转膜结束,用5% 脱脂奶粉封闭膜2 h,加入相应的一抗溶液(稀释比例均为1 ∶1 000),置于水平摇床,4 ℃ 孵育过夜。取出PVDF膜,TBST洗膜3次、10 min/次,加入HRP标记的羊抗兔二抗(1 ∶10 000)室温孵育2 h;TBST洗PVDF膜3次、10 min/次;将PVDF膜平整放入化学发光仪,均匀滴加超敏 ECL化学发光试剂,曝光。
1.2.3免疫印迹和免疫荧光鉴定AGS/glut1、BGC-823/glut1稳转细胞株 培养AGS、BGC-823、BGC-823/glut1、AGS/glut1细胞,按照1×106个/孔将细胞接种于15 mm玻底直径的激光共聚焦皿,用腺病毒以MOI 50感染细胞48 h;出共聚焦皿,PBS缓冲液洗1次,4%多聚甲醛室温固定15 min后用PBS缓冲液洗3次、5 min/次;加入0.3% Triton X-100,室温孵育5~20 min;PBS缓冲液洗/3次、5 min/次,山羊血清室温封闭1 h,弃掉封闭液,滴加500 μL稀释好的一抗溶液(1 ∶200),放入4 ℃ 冰箱孵育过夜。第二天PBS缓冲液洗共聚焦皿3次、5 min/次,滴加500 μL稀释好的荧光二抗溶液(1 ∶200),室温避光孵育1 h。PBS缓冲液洗3次、5 min/次,滴加500 μL DAPI溶液,室温避光孵育5~10 min,PBS缓冲液洗3次、5 min/次。弃掉皿中溶液,加入200 μL PBS缓冲液,使用LSM 710激光共聚焦显微镜采图。
2 结果
2.1 过表达CagA降低AGS和人原代胃癌细胞中GLUT1的表达
分别用空载体腺病毒(NC)和pAdeno-cagA腺病毒感染AGS和人原代胃癌细胞YHD 72 h后,免疫荧光检测GLUT1蛋白的表达。结果发现GLUT1蛋白主要在细胞膜上表达,且过表达CagA能引起细胞膜上GLUT1蛋白的表达降低并出现碎片化(图1)。

注:过表达CagA的AGS、YHD胃癌细胞免疫荧光鉴定,其中NC为空载组,CagA为过表达CagA组。
2.2 免疫印迹和免疫荧光鉴定AGS/glut1、BGC-823/glut1稳转细胞株
为了探讨CagA引起GLUT1表达降低的原因,过表达glut1慢病毒感染胃癌细胞株AGS和BGC823,用嘌呤霉素筛选稳转细胞株,Western blot检测稳转细胞株中GLUT1的表达。结果显示成功构建过表达GLUT1的AGS和BGC-823 稳转细胞株(图2A),分别命名为AGS/glut1和BGC-823/glut1。随后选取BGC-823细胞用免疫荧光检测GLUT1蛋白表达,进一步证实BGC-823/glut1细胞膜上高表达GLUT1(图2B)。
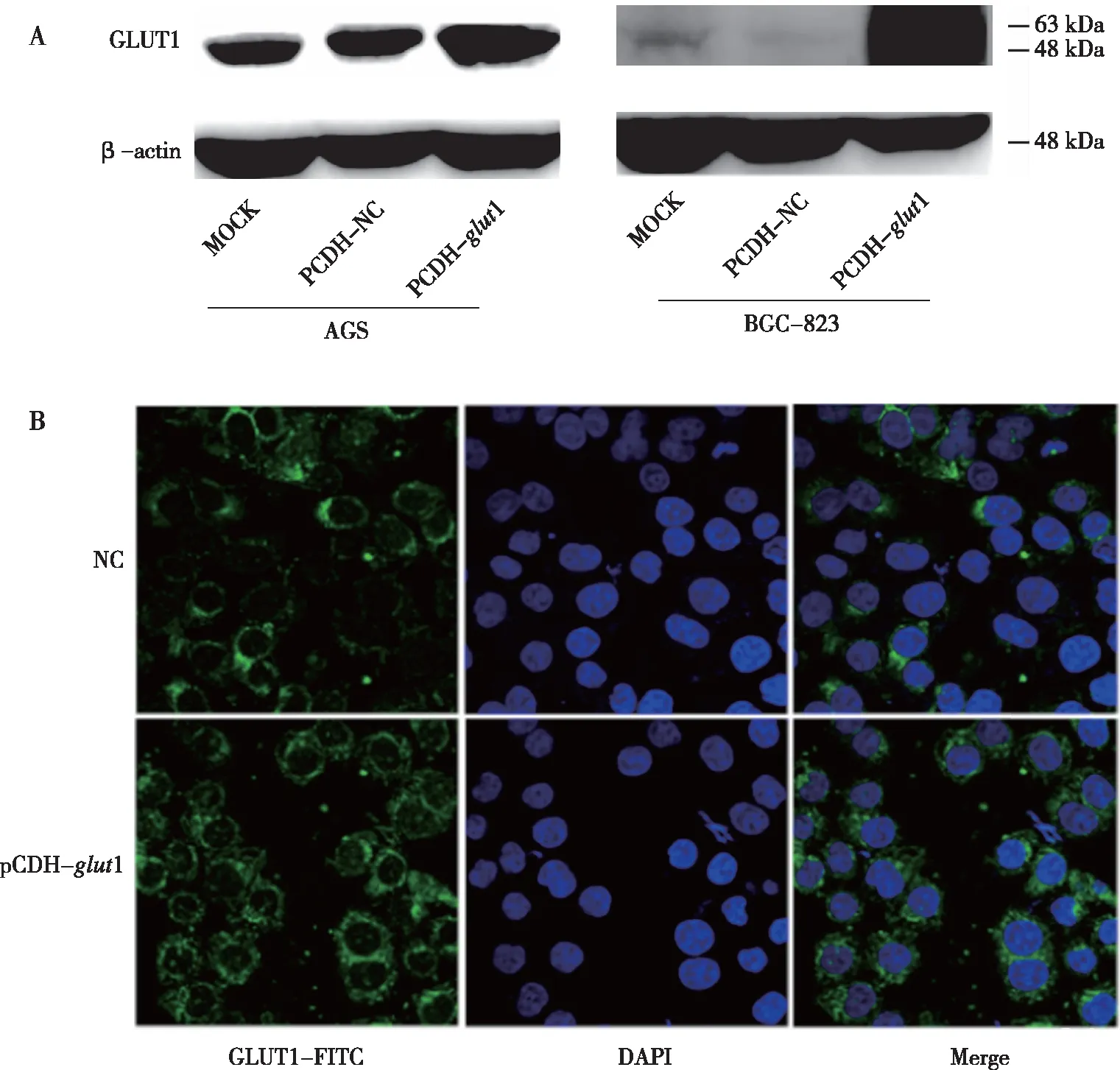
注:A示BGC-823/glut1、AGS/glut1细胞Western blot鉴定,其中MOCK为空白组,pCDH-NC为空载组;B示BGC-823/glut1细胞免疫荧光鉴定(标尺40 μm),其中NC为空载组,pCDH-glut1为过表达GLUT1组。
2.3 GLUT1和CagA在细胞膜上共定位
成功构建过表达GLUT1的稳转细胞株以后,用pAdeno-cagA腺病毒感染BGC-823/glut1和AGS/glut1稳转细胞株,72 h后免疫荧光检测发现GLUT1蛋白和CagA均在细胞膜上表达,在细胞膜上共定位(图3),提示CagA可能引起细胞膜的破坏。

图3 CagA与GLUT1在BGC-823/glut1及AGS/glut1细胞上的共定位结果(免疫荧光,标尺50 μm)
3 讨论
胃癌是起源于胃黏膜上皮的恶性肿瘤。H.pylori感染可导致急、慢性胃炎、消化性溃疡、胃癌的发生[13]。CagA是H.pylori重要毒力因子之一,是哺乳动物中发现的首个细菌性致癌蛋白,亦被称为细菌癌蛋白[14]。近年来,虽然对H.pylori进行了大量的研究,但是迄今为止H.pylori-CagA对细胞能量代谢的机制并不清楚。因此,本研究用过表达CagA腺病毒感染人胃癌细胞株AGS和人原代胃癌细胞YHD,免疫荧光检测发现过表达CagA能够抑制细胞膜上GLUT1蛋白的表达,并且破坏细胞膜使GLUT1蛋白的表达呈现碎片。GLUT是细胞糖代谢过程中的首个关键蛋白,作为水溶性物质的葡萄糖需要借助GLUT通过细胞磷脂双分子层转运进入细胞质。GLUT有14个成员,与葡萄糖有高的亲和力的是GLUT1,GLUT3和GLUT4,可以高效率地转运葡萄糖[15]。研究表明,在恶性肿瘤细胞中,常特征性地过表达GLUT1或GLUT3[16]。在卵巢癌和肺癌细胞中,缺氧可诱导氟代脱氧葡萄糖2摄入增加,GLUT1蛋白表达上调[17]。
有研究发现H.pylori感染胃上皮细胞后,将CagA注入细胞内,与细胞膜内磷脂酰丝氨酸结合,定位在细胞膜的浆膜面,引起细胞形态变化,这可能与胃上皮异常增生和肿瘤恶性程度相关[18]。本研究中,用免疫荧光共定位检测发现CagA和GLUT1共定位于细胞膜上,推测两者的共定位是CagA破坏细胞膜,引起GLUT1表达碎片化的直接原因。但是,这些结果与上述肿瘤细胞中葡萄糖摄取增加的结果不一致,提示CagA可能通过其它的机制引起胃癌的发生发展。
综上,本研究首次证实CagA与GLUT1共定位于细胞膜上,破坏细胞膜,抑制GLUT1蛋白的表达。该研究将为进一步研究CagA对细胞的毒性以及致病致癌机制奠定基础。
