响应面法优化酶法制备驴血红蛋白源二肽基肽酶Ⅳ抑制活性肽
2021-05-17刘丹吴晓彤
刘丹 吴晓彤

摘 要:食源性二肽基肽酶Ⅳ(dipeptidyl peptidase Ⅳ,DPP-Ⅳ)抑制活性肽成为近年来健康产品研究的方向之一。本研究以驴血红蛋白为原料,采用计算机模拟蛋白水解方法筛选最佳蛋白酶,研究酶解时间、温度和加酶量对蛋白水解度(degree of hydrolysis,DH)和酶解产物DPP-Ⅳ抑制率的影响,响应面优化酶解法制备DPP-Ⅳ抑制活性肽的工艺条件。结果表明,最佳蛋白酶为蛋白酶K,驴血红蛋白源制备DPP-Ⅳ抑制活性肽的最佳酶解条件为:底物质量浓度1 g/100 mL、酶解时间3.15 h、温度65 ℃、pH 8、加酶量400 U/g,此条件下2 mg/mL酶解产物对DPP-Ⅳ的抑制率为53.44%。
关键词:驴血红蛋白;蛋白酶K;响应面分析法;二肽基肽酶Ⅳ抑制活性肽
Optimization of Enzymatic Preparation of Dipeptidyl Peptidase-Ⅳ Inhibitory Peptides from Donkey Hemoglobin
LIU Dan, WU Xiaotong*
(School of Life Sciences, Inner Mongolia University, Hohhot 010000, China)
Abstract: Food-derived dipeptidyl peptidase (DPP) Ⅳ inhibitory peptide has become an important direction of research on dietary supplements in recent years. In this study, donkey hemoglobin was hydrolyzed with proteases to produce DPP-Ⅳ inhibitory peptide. The best protease was selected by computer simulation of protein hydrolysis. The effects of hydrolysis time, temperature and enzyme dosage on the degree of hydrolysis and DPP-Ⅳ inhibitory activity were studied. The process conditions were optimized by response surface methodology. The results showed that protease K was the best enzyme for the production of DPP-Ⅳ inhibitory peptide. The optimal enzymatic hydrolysis conditions were as follows: substrate concentration 1%, hydrolysis time 3.15 h, temperature 65 ℃, pH 8.00, and enzyme dosage 400 U/g. The inhibition rate of DPP-Ⅳ by 2 mg/mL of the hydrolysate prepared using these conditions was 53.44%.
Keywords: donkey hemoglobin; protease K; response surface analysis; dipeptidyl peptidase Ⅳ inhibitory peptides
DOI:10.7506/rlyj1001-8123-20201225-296
中圖分类号:TS251.9 文献标志码:A 文章编号:1001-8123(2021)02-0019-06
引文格式:
刘丹, 吴晓彤. 响应面法优化酶法制备驴血红蛋白源二肽基肽酶-Ⅳ抑制活性肽[J]. 肉类研究, 2021, 35(2): 19-24. DOI:10.7506/rlyj1001-8123-20201225-296. http://www.rlyj.net.cn
LIU Dan, WU Xiaotong. Optimization of enzymatic preparation of dipeptidyl peptidase-Ⅳ inhibitory peptides from donkey hemoglobin[J]. Meat Research, 2021, 35(2): 19-24. DOI:10.7506/rlyj1001-8123-20201225-296. http://www.rlyj.net.cn
随着社会经济的飞速发展,人们的生活方式特别是饮食习惯发生巨大变化,营养摄入的不均衡导致肥胖和糖尿病等慢性代谢疾病的发生率逐年上升。糖尿病已逐渐成为世界范围内日益严重的社会健康问题,预计到2040年,将会有6.42亿成年人患糖尿病[1]。
二肽基肽酶Ⅳ(dipeptidyl peptidase Ⅳ,DPP-Ⅳ)抑制剂是新型糖尿病治疗药物[2]。然而,长期服用合成的DPP-Ⅳ抑制剂会产生耐药性和肝肾损伤等副作用[3]。生物活性肽是对生物机体生命活动有益或是具有生理作用的肽类化合物,是一类分子质量小于6 000 Da,具有多种生物学功能的多肽[4],其分子结构复杂程度不一,介于氨基酸与蛋白质之间,由2 个至数十个氨基酸通过肽键连接而成[5]。DPP-Ⅳ抑制活性肽主要来源于天然动植物,具有生物活性高、副作用低等优点,在高效性和安全性等方面具有突出优势[6],具有辅助控制血糖水平的潜力[7]。
近年来,已从豆类[7]、藜麦[8]、谷物[9]、油菜[10]、猪皮凝胶[11]、猪骨骼肌[12]、乳清蛋白[13]、酪蛋白[14]和骆驼乳[15]等中水解得到DPP-Ⅳ抑制肽。关于血液中DPP-Ⅳ抑制肽鲜有报道。血中富含血红蛋白,血红蛋白由2 个
α-亚基和2 个β-亚基组成,是一种非膜的复合变构蛋白,能运输氧并调节血液酸碱平衡[16],血红蛋白酶解肽段具有抗氧化[17-18]、降血压[19-20]和抗菌[21-22]等多种活性,且分子质量小,可被直接吸收[23],是一种非常有前途的功能性食品原料。生物信息学是用于管理、规划和解释与生物系统相关信息的计算方法,它利用各种数据库、在线工具和软件等获取目标功能。利用ExPASy Cutter[24]和BIOPEP[25]等在线平台的肽剪切工具,可以根据蛋白质的氨基酸序列及特异蛋白酶的剪切位点在理论上预测肽的组成,并将肽段与数据库中的DPP-Ⅳ多肽进行比较[26],从而选择合适的底物及蛋白酶。
本研究以驴血红蛋白为原料,通过借助ExPASy Cutter和BIOPEP在线平台筛选合适的蛋白酶。在单因素试验基础上,通过响应面法优化酶解条件制备驴血红蛋白源DPP-Ⅳ抑制活性肽,为推动DPP-Ⅳ抑制活性肽产业化发展提供理论依据,以提高驴血的附加值,促进驴产业的发展。
1 材料与方法
1.1 材料与试剂
选择检疫合格的3 岁乌公驴,在宰杀过程中收集新鲜血液,通过20 目筛后滤入含有1%柠檬酸钠抗凝剂容器中。上述过程于内蒙古呼和浩特市蒙驴食品定点屠宰场完成。
蛋白酶K(40 U/mg) 德国Merck公司;DPP-Ⅳ抑制剂筛选试剂盒 美国Abnova公司;十二烷基硫酸钠-聚丙烯酰胺凝胶电泳(sodium dodecyl sulfate polyacrylamide gel electrophoresis,SDS-PAGE)凝胶制备试剂盒 北京索来宝科技有限公司;氯化钠、浓盐酸、氢氧化钠、乙醇、柠檬酸钠均为分析纯。
1.2 仪器与设备
FD-1真空冷冻干燥机 北京德天佑科技发展有限公司;5804R高速冷冻离心机 艾本德(中国)有限公司;DK-8D水浴锅 上海博讯实业有限公司医疗设备厂;PHS-3C雷磁pH计 上海仪电科学仪器股份有限公司;MULTISKAN GO全光谱酶标仪 美国Thermo Fisher公司;凝胶成像仪、Mini protein II型垂直电泳系统 美国Bio-Rad公司。
1.3 方法
1.3.1 驴血红蛋白的提取及SDS-PAGE分析
采集新鲜驴血过20 目筛后,放入含有1%柠檬酸钠抗凝剂容器中,5 000×g、4 ℃条件下离心5 min,去上层,按上述步骤重复3 次,收集红细胞,置于4 ℃冰柜中保存备用。将红细胞中加入2 倍体积4 ℃预冷的去离子水,于4 ℃冰柜中静置过夜后,12 000×g、4 ℃条件下离心20 min,去沉淀,收集上清液,即得驴血红蛋白。采用SDS-PAGE检测驴血红蛋白纯度,分离胶质量分数12%、浓缩胶质量分数5%、电压110 V、电泳时间90 min。电泳结束后,用考马斯亮蓝染色,脱色后将胶片置于胶片观察灯上观察。
1.3.2 计算机模拟酶解驴血血红蛋白
利用UniProt数据库(http://www.uniprot.org/)获得原料蛋白质一级结构,由在线软件PeptideCutter(http://web.expasy.org/peptide_cutter/)进行胰蛋白酶、胃蛋白酶、木瓜蛋白酶和蛋白酶K模拟水解,将水解得到的多肽整理分类,与BIOPEP(http://www.uwm.edu.pl/biochemia/index.php/en/biopep)数据库中的DPP-Ⅳ抑制肽进行对比,筛选出合适的蛋白酶。
1.3.3 蛋白水解度的测定
在中性和碱性条件下,采用pH-Stat法[27]测定蛋白水解度。在水解反应开始时,调节pH值为8.00,反应结束后测定反应体系pH值,用0.50 mol/L NaOH溶液将反应体系pH值再次调至8.00,记录所用NaOH溶液体积,
按式(1)计算蛋白水解度。
(1)
式中:V为NaOH溶液所用体积/mL;c为NaOH溶液浓度/(mol/L);1/T为2.26;m为蛋白质质量/g;htot为每克蛋白质中所含肽键的物质的量(8.30 mmol/g)。
1.3.4 DPP-Ⅳ抑制活性測定
采用荧光法,按照DPP-Ⅳ抑制剂筛选试剂盒说明书步骤操作,37 ℃孵育30 min,在激发波长360 nm、发射波长460 nm条件下检测荧光强度。按式(2)计算DPP-Ⅳ抑制率。
(2)
式中:a为抑制剂孔荧光强度;b为背景孔荧光强度;c为DPP-Ⅳ孔荧光强度。
1.3.5 单因素试验
选定最佳蛋白酶后,研究酶解时间、酶解温度和加酶量对驴血红蛋白水解度和DPP-Ⅳ活性抑制率的影响。
1.3.5.1 酶解时间对驴血红蛋白酶解产物DPP-Ⅳ抑制活性和水解度的影响
设定底物质量浓度1 g/100 mL、加酶量400 U/g、
酶解温度60 ℃、pH 8,分别酶解1、2、3、4、5 h,以水解度和DPP-Ⅳ抑制率为指标,确定最适酶解时间。
1.3.5.2 酶添加量对驴血红蛋白酶解产物DPP-Ⅳ抑制活性和水解度的影响
设定底物质量浓度1 g/100 mL、酶解温度60 ℃、pH 8、酶解时间3 h,分别考察加酶量为240、320、400、480、560 U/g时的水解度和DPP-Ⅳ抑制率,确定最适加酶量。
1.3.5.3 酶解温度对驴血红蛋白酶解产物DPP-Ⅳ抑制活性和水解度的影响
设定底物质量浓度1 g/100mL、蛋白酶K添加量480 U/g、pH 8、酶解时间3 h,分别考察酶解温度50、55、60、65、70 ℃时的水解度和DPP-Ⅳ抑制率,确定最适酶解温度。
1.3.6 响应面法优化驴血红蛋白制备DPP-Ⅳ抑制活性肽的工艺条件
以DPP-Ⅳ抑制活性率为指标,在单因素试验基础上,根据Box-Behnken中心组合试验设计原理,采用3因素3水平响应面试验,确定驴血红蛋白制备DPP-Ⅳ抑制活性肽的最佳工艺条件。试验因素水平见表1。
1.4 数据处理
每项测定均重复3 次,采用SPSS 22软件进行数据分析,采用Design-Expert V8.0.6和SPSS 22软件绘制图表。
2 结果与分析
2.1 驴血红蛋白纯度检测
由图1可知,电泳只显示一条蛋白质条带,说明该血红蛋白的分子质量均一,为典型的血红蛋白SDS-PAGE图像。
2.2 计算机模拟酶解驴血红蛋白的结果
本研究分别使用胰蛋白酶、胃蛋白酶、木瓜蛋白酶和蛋白酶K对驴血红蛋白进行模拟酶解。由表2可知,使用胰蛋白酶水解得到25 种多肽,共25 条,其中二肽4 种,共4 条,在总多肽数量中的占比为16%,四肽4 种,共4 条,在总多肽数量中的占比为16%。使用胃蛋白酶水解得到52 种多肽,共52 条,其中二肽15 种,共15 条,在总多肽数量中的占比为46.90%;三肽13 种,共13 条,在总多肽数量中的占比为40.60%。使用木瓜蛋白酶得到72 种多肽,共76 条,其中二肽27 种,共31 条,在总多肽数量中的占比为28.88%,三肽24 种,共24 条,在总多肽数量中的占比为25%;使用蛋白酶K水解得到76 种多肽,共78 条,其中二肽35 种,共37条,在总多肽数量中的占比为47.40%;三肽31 种,共31 条,在总多肽数量中的占比为39.70%。模拟水解的结果表明,蛋白酶K理论上释放的肽段数量和种类较多,酶解效果优于其他蛋白酶。
由表3可知,将模拟酶解得到的多肽与BIOPEP数据库进行对比发现,使用胰蛋白酶、胃蛋白酶、木瓜蛋白酶和蛋白酶K水解分别得到3、7、14、26 种已知的DPP-Ⅳ抑制活性肽。因此,本研究选用蛋白酶K作为最佳蛋白酶进行后续实验。
2.3 单因素试验结果
2.3.1 酶解时间对驴血红蛋白酶解产物DPP-Ⅳ抑制活性和水解度的影响
小写字母不同,表示水解度组间差异显著(P<0.05);大写字母不同,表示DPP-Ⅳ抑制率组间差异显著(P<0.05)。图3~4同。
由图2可知,在酶解1~3 h内,驴血红蛋白水解度呈递增趋势(P<0.05),随着酶解时间的延长,水解度稍有降低;这是因为随着水解的进行,底物蛋白质不断减少,酶解产物逐渐积累,从而抑制酶解反应的进行。DPP-Ⅳ抑制活性随酶解时间的延长呈先上升后下降趋势,在酶解3 h时达到最大,为54.75%,这与吉薇[28]使用动物蛋白酶水解南极磷虾蛋白制备DPP-Ⅳ抑制肽的研究结果一致。这是因为随着酶解时间延长,蛋白质水解生成的肽含量增多,DPP-Ⅳ抑制率随之增大,继续水解导致底物的酶解程度过大,使得到的活性多肽进一步水解成氨基酸,多肽含量降低,活性肽的数量也随之减少。
2.3.2 酶添加量对驴血红蛋白酶解产物DPP-Ⅳ抑制活性和水解度的影响
由图3可知,酶添加量为240~480 U/g时,驴血红蛋白水解度呈递增趋势(P<0.05),随着酶添加量的增加,水解度变化幅度较小,曲线趋于平缓。抑制率DPP-Ⅳ随酶添加量的增加呈先上升后下降趋势,在480 U/g
时达到最大,为55.02%。这可能是因为酶添加量较小时,随着酶量的增多,蛋白质分解逐渐完全,DPP-Ⅳ抑制率和水解度也逐渐增大。当酶添加量达到480 U/g,此时酶分子相对于底物来说已趋向饱和,DPP-Ⅳ抑制率达到最大值,继续增大酶添加量,蛋白分子水解完全导致具有DPP-Ⅳ抑制活性的多肽分子减少,DPP-Ⅳ抑制率降低,这与Nongonierma等[29]酶解制备DPP-Ⅳ抑制肽时的结论类似。
2.3.3 酶解温度对驴血红蛋白酶解产物DPP-Ⅳ抑制活性和水解度的影响
由图4可知,随着酶解温度的升高,驴血红蛋白水解度和酶解产物DPP-Ⅳ抑制率均呈先升高后降低的趋势,当酶解温度为65 ℃时,二者均达到最大,继续升高酶解温度,DPP-Ⅳ抑制活性显著下降(P<0.05)。推测随着酶解温度的升高,可能是由于蛋白酶K的結构发生一定改变,从而影响酶解效果[30],也可能是由于DPP-Ⅳ抑制肽的结构发生变化使其活性下降。因此,选择65 ℃为最适酶解温度。
2.4 响应面试验结果
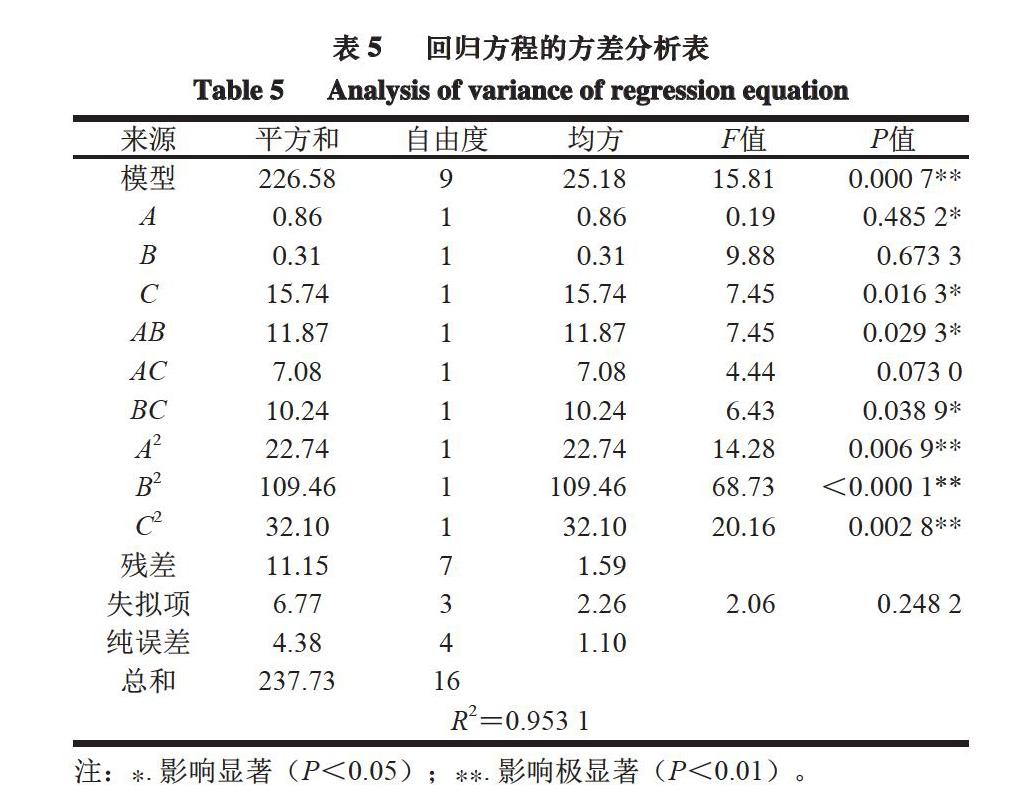
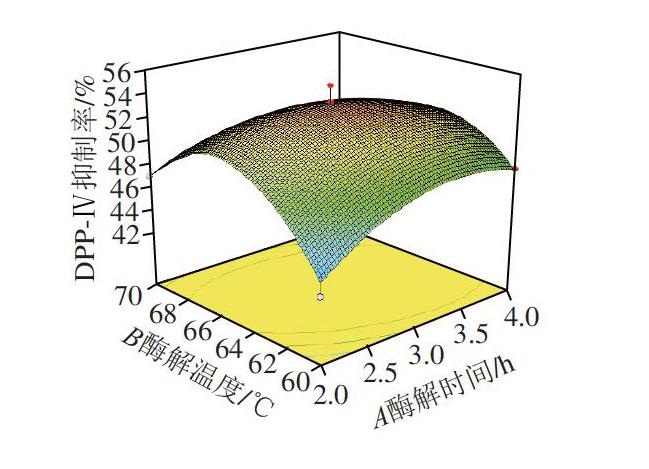
通过Design-Expert V8.0.6设计响应面试验,结果如表4所示。得到回归方程如下:Y=53.32+0.33A-0.20B+1.40C-1.72AB+1.33AC+1.60BC-2.32A2-5.10B2-2.76C2。对模型进行方差分析,由表5可知,该模型P<0.01,失拟项P=0.2482>0.05,不显著,表明建模成功,模型回归系数R2=0.953 1,说明模型拟合程度良好且差异具有统计学意义,该模型可用于确定驴血红蛋白制备DPP-Ⅳ抑制活性肽的最佳工艺。对DPP-Ⅳ抑制率影响顺序为C酶添加量>B酶解时间>A酶解温度,模型中一次项C,交互项AB、BC,二次项A2、B2、C2对试验结果有显著影响(P<0.05或P<0.01)。
2.4.1 因素交互作用分析
在响应面分析中等高线形状越接近椭圆形和响应面曲面倾斜度越陡,响应值对于处理条件改变的敏感程度越大,颜色越深,表明因素间的交互作用显著,反之则交互作用不显著[31]。由图5可知,3 种因素交互作用对DPP-Ⅳ抑制率影响较显著。
2.4.2 模型驗证试验
通过分析响应面试验结果,得到酶解驴血红蛋白制备DPP-Ⅳ抑制活性肽的最佳条件为:底物质量浓度1 g/100 mL、酶解时间3.15 h、酶解温度65 ℃、pH 8.00、酶添加量400 U/g,此条件下2 mg/mL酶解产物对DPP-Ⅳ的抑制率为53.80%。在最优条件下进行验证,测得此条件下DPP-Ⅳ抑制率为53.44%,接近于理论值,表明该模型可较好地反映各因素与响应值之间的关系。
3 结 论
食源性DPP-Ⅳ抑制肽的研究一般按照以下流程
进行[25,33]:1)选取合适的蛋白底物和酶;2)酶解蛋白;3)体外活性分析;4)富集/分离;5)DPP-Ⅳ抑制肽的鉴定;6)DPP-Ⅳ抑制效能验证;7)抑制机制阐述;8)细胞及动物实验验证。该方法耗时且劳动强度大,对蛋白酶的选择缺乏目的性[26]。本研究应用计算机结合传统酶解方法制备驴血红蛋白源DPP-Ⅳ抑制活性肽,有效筛选出蛋白酶K为最佳蛋白酶,其水解所得多肽数量和种类最多,且获得的已知的DPP-Ⅳ抑制活性肽数量也最多,有效地减少了实验过程中的盲目性。实际酶解结果表明,驴血红蛋白酶解物具有一定的DPP-Ⅳ抑制活性;在单因素试验基础上,以DPP-Ⅳ抑制率为响应值,采用响应面分析法研究酶解时间、酶解温度和酶添加量对血红蛋白酶解产物DPP-Ⅳ抑制率的影响,确定蛋白酶K的最优酶解工艺为:底物质量浓度1 g/100 mL、酶解时间3.15 h、酶解温度65 ℃、pH 8.00、酶添加量400 U/g,此条件下2 mg/mL酶解产物对DPP-Ⅳ的抑制率为53.44%,理论值与实测值基本相符。本实验结果为驴血红蛋白DPP-Ⅳ抑制肽的制备和功能性研究提供了技术参考。
参考文献:
[1] CHEN Z Z, GERSZTEN R E. Metabolomics and proteomics in type 2 diabetes[J]. Circulation Research, 2020, 26(11): 1613-1627. DOI:10.1161/circresaha.
[2] 张群子, 范瑛, 汪年松. 二肽基肽酶4抑制剂在糖尿病肾病患者中的应用和疗效评价[J]. 世界临床药物, 2020, 41(10): 758-763. DOI:10.13683/j.wph.2020.10.002.
[3] 赵红星. 降血糖活性肽制备及抑制α-葡萄糖苷酶活性肽纯化与鉴定[D].
哈尔滨: 哈尔滨工业大学, 2018: 8.
[4] 杨闯. 生物活性肽在营养保健中的应用[J]. 食品科学, 2003, 24(11): 153-154.
[5] 崔凤霞. 海参胶原蛋白生化性质及胶原肽活性研究[D]. 青岛: 中国海洋大学, 2007.
[6] 赵蕊, 姚鑫淼, 周野, 等. 食源二肽基肽酶Ⅳ抑制剂的研究进展[J].
食品科学, 2020, 41(7): 315-321. DOI:10.7506/spkx1002-6630-20190211-044.
[7] LAN V T T, ITO K, OHNO M, et al. Analyzing a dipeptide library to identify human dipeptidyl peptidase Ⅳ inhibitor[J]. Food Chemistry, 2015, 175: 66-73. DOI:10.1016/j.foodchem.2014.11.131.
[8] GUO Huimin, RICHEL A, HAO Yuqiong, et al. Novel dipeptidyl peptidase-Ⅳ and angiotensin-Ⅰ-converting enzyme inhibitory peptides released from quinoa protein by in silico proteolysis[J]. Food Science and Nutrition, 2020, 8(3): 1415-1422. DOI:10.1002/fsn3.1423.
[9] CERME?O M, CONNOLLY A, OKEEFFE M B, et al. Identification of bioactive peptides from brewers spent grain and contribution of Leu/Ile to bioactive potency[J]. Journal of Functional Foods, 2019, 60:103455. DOI:10.1016/j.jff.2019.103455.
[10] XU Feiran, YAO Yijun, XU Xiaoying, et al. Identification and quantification of DPP-Ⅳ-inhibitory peptides from hydrolyzed-rapeseed-protein derived napin with analysis of the interactions between key residues and protein domains[J]. Journal of Agricultural and Food Chemistry, 2019, 67(13): 3679-3690. DOI:10.1021/acs.jafc.9b01069.
[11] HUANG Shili, HUNG C C, JAO C L, et al. Porcine skin gelatin hydrolysate as a dipeptidyl peptidase Ⅳ inhibitor improves glycemic control in streptozotocin-induced diabetic rats[J]. Journal of Functional Foods, 2014, 11(2): 235-242. DOI:10.1016/jjff.2014.09.010.
[12] SENTANDREU A M, TOLDR? F. Dipeptidyl peptidase Ⅳ from porcine skeletal muscle: purification and biochemical properties[J]. Food Chemistry, 2001, 75(2): 159-168. DOI:10.1016/S0308-8146(01)00145-5.
[13] NONGONIERMA A B, CADAMURO C, LEGOUIC G A, et al. Dipeptidyl peptidase Ⅳ (DPP-Ⅳ) inhibitory properties of a camel whey protein enriched hydrolysate preparation[J]. Food Chemistry, 2019, 279: 70-79. DOI:10.1016/j.trac.2018.04.005.
[14] LIN Zheng, QIONG Yaoxu, LIAN Zhulin, et al. In vitro metabolic stability of a casein derived dipeptidyl peptidase-Ⅳ (DPP-Ⅳ) inhibitory peptide VPYPQ and its controlled release from casein by enzymatic hydrolysis[J]. Journal of Agricultural and Food Chemistry, 2019, 67(38): 10604-10613. DOI:10.1021/acs.jafc.9b03164.
[15] NONGONIERMA A B, PAOLELLA S, MUDGIL P, et al. Identification of novel dipeptidyl peptidase Ⅳ (DPP-Ⅳ) inhibitory peptides in camel milk protein hydrolysates[J]. Food Chemistry, 2018, 244: 340-348. DOI:10.1016/ji.foodchem.2017.10.033
[16] 任雪平. 血红蛋白的生物学特性[J]. 科教导刊, 2011(33): 132-133.
[17] 孔卓姝, 刘海杰, 成晓瑜, 等. 响应面法优化酶法制备猪血红蛋白抗氧化肽[J]. 肉类研究, 2013, 27(9): 1-6.
[18] 胡滨, 陈一资, 胡惠民, 等. 猪血蛋白酶解物的抗氧化功能研究[J]. 核农学报, 2014, 28(9): 1632-40. DOI:10.11869/j.issn.100-8551.2014.09.1632.
[19] 李诚, 郭奇亮, 付刚, 等. 酶解猪血红蛋白制备降血压肽工艺参数
优化[J]. 食品科学, 2012, 33(1): 195-199.
[20] YU Yike, HU jianen. Isolation and characterization of angiotensin Ⅰ-converting enzyme inhibitory peptides derived from porcine hemoglobin[J]. Peptides, 2006, 27(11): 2950-2956. DOI:10.1016/j.peptides.2006.05.025.
[21] 潘晓倩, 成晓瑜, 张顺亮, 等. 响应面法优化猪血红蛋白抗菌肽的制备工艺[J]. 肉类研究, 2013, 27(11): 1-5.
[22] 张庆华, 王青, 尚田田, 等. 新型血红蛋白抗菌肽抑菌活性及溶血性研究[J]. 动物医学进展, 2014, 35(9): 54-57. DOI:10.16437/j.cnki.1007-5038.
[23] 卢文静, 韩涛. 可食动物血蛋白肽的研究进展[J]. 食品工业科技, 2011, 32(11): 499-502. DOI:10.13386/j.issn1002-0306.
[24] TU Maolin, CHENG Shuzhen, LU Weihong, et al. Advancement and prospects of bioinformatics analysis for studying bioactive peptides from food-derived protein: sequence, structure, and functions[J]. Trends in Analytical Chemistry, 2018, 105: 7-17. DOI:10.1016/j.trac.2018.04.005.
[25] NONGONIERMA A B, FITZGERALD R J. Enhancing bioactive peptide release and identification using targeted enzymatic hydrolysis of milk proteins[J]. Analytical and Bioanalytical Chemistry, 2018, 410(15):3407-3423. DOI:10.1007/s00216-017-0793-9.
[26] 頡宇, 胡錦灵, 赵宏飞, 等. 基于生物信息学定向制备柠条籽蛋白抗氧化肽的工艺优化[J]. 食品科学, 2020, 41(20): 278-284. DOI:10.7506/spkx1002-6630-20190822-224.
[27] 胡刚, 王春维, 周海, 等. 酶解猪血红蛋白工艺条件的研究[J]. 饲料工业, 2009, 30(23): 18-22.
[28] 吉薇. 南极磷虾蛋白源二肽基肽酶-Ⅳ(DPP-Ⅳ)抑制肽的研究[D]. 湛江: 广东海洋大学, 2017: 28-29.
[29] NONGONIERMA A B, FITZGERALD R J. Dipeptidyl peptidase Ⅳ inhibitory properties of a whey protein hydrolysate: influence of fractionation, stability to simulated gastrointestinal digestion and food-drug interaction[J]. International Dairy Journal, 2013, 32(1): 33-39.
[30]] 孟昌伟, 陆剑锋, 薛莲, 等. 白鲢鱼排酶解蛋白的制备及营养成分
分析[J]. 肉类研究, 2011, 25(7): 24-28.
[31] 付劢, 陈继兰, 王攀林, 等. 鸡胚蛋白的酶解工艺优化及抗氧化性
研究[J]. 食品科技, 2020, 45(9): 35-42. DOI:10.13684/j.cnki.spkj.
[32] NONGONIERMA A B, FITZGERALD R J. Strategies for the discovery and identification of food protein-derived biologically active peptides[J]. Trends in Food Science and Technology, 2017, 69: 289-305. DOI:10.1016/j.tifs.2017.03.003.
