Ni‐Co‐W合金电沉积行为及成核机理
2021-05-17温林洁张丽楠周宗熠李运刚杨海丽
温林洁,张丽楠,周宗熠,李运刚,杨海丽
(华北理工大学冶金与能源学院,现代冶金技术教育部重点实验室,河北唐山063210)
Ni‐Co 合金具有良好的延展性、软磁性,被广泛应用于各种磁性器件领域[1]。但仍存在硬度较低、高温稳定性较差等问题,限制了其更广泛的应用[2]。W 及其合金具有良好的摩擦性能、硬度和高温稳定性[3]。在镍基合金中加入W 元素可以有效地提高其硬度和高温稳定性[4]。电沉积法具有操作简便、设备简单及成本低等优点[5],是制备 Ni‐Co‐W 合金的主要手段。M.A.Farzaneh 等[2]研究了电流密度对Ni‐Co‐W 合金晶粒尺寸的影响;郭跃萍等[4]研究了pH 值对 Ni‐Co‐W 合金软磁性的影响 ;Caio Felipe Baldessin 等[6]研究了 Ni 和 Co 的含量对 Ni‐Co‐W 合金结晶度的影响。目前有关Ni‐Co‐W 合金的电沉积机理尚未研究,本文采用电沉积法制备Ni‐Co‐W合金,通过循环伏安、阴极极化曲线、电化学阻抗谱、计时电流等方法对Ni‐Co‐W 合金的电沉积行为及成核机理进行研究。
1 实验
1.1 电解液及其组成
单金属Ni 电沉积的电解液组成为:150 g/LNiSO4·7H2O + 300 g/L 柠檬酸钠;Ni‐W 合金电沉积的 电 解 液 组 成 为 :150 g/L NiSO4·6H2O + 30 g/L Na3WoO4·2H2O + 294 g/L 柠檬酸钠 ;Ni‐Co‐W 合金电沉积的电解液为 :150 g/L NiSO4·6H2O + 15 g/L CoSO4·7H2O+20 g/L Na3WoO4·2H2O+294 g/L 柠檬酸钠。
测试时,上述电解液均用质量分数均为15%的稀硫酸和NaOH 溶液调节电解液的pH 值为5.0,并控制电解液温度为30 ℃
1.2 测试方法
采用德国ZAHNER 公司IM6eX 电化学工作站对Ni‐Co‐W 合金的电沉积行为和成核机理进行研究,选用三电极体系:工作电极为玻碳旋转圆盘电极(美国 BASi,RDE‐2 型,电极面积约 7.07 mm2,转速1 ~ 10000 rpm 可调),参比电极为 Ag/AgCl 电极,对电极为铂丝电极。循环伏安曲线测试电位扫速为20、40、60和80 mV/s,扫描范围在0.2~−1.5 V之间;阴极极化曲线测试电位扫速为5 mV/s,扫描范围为−0.4~−1.6 V,旋转圆盘电极转速为100、400、900和1600 r/min;电化学阻抗谱测试扰动信号振幅5 mV,测试频率范围100 mHz~100 kHz。
2 结果与讨论
2.1 循环伏安曲线分析
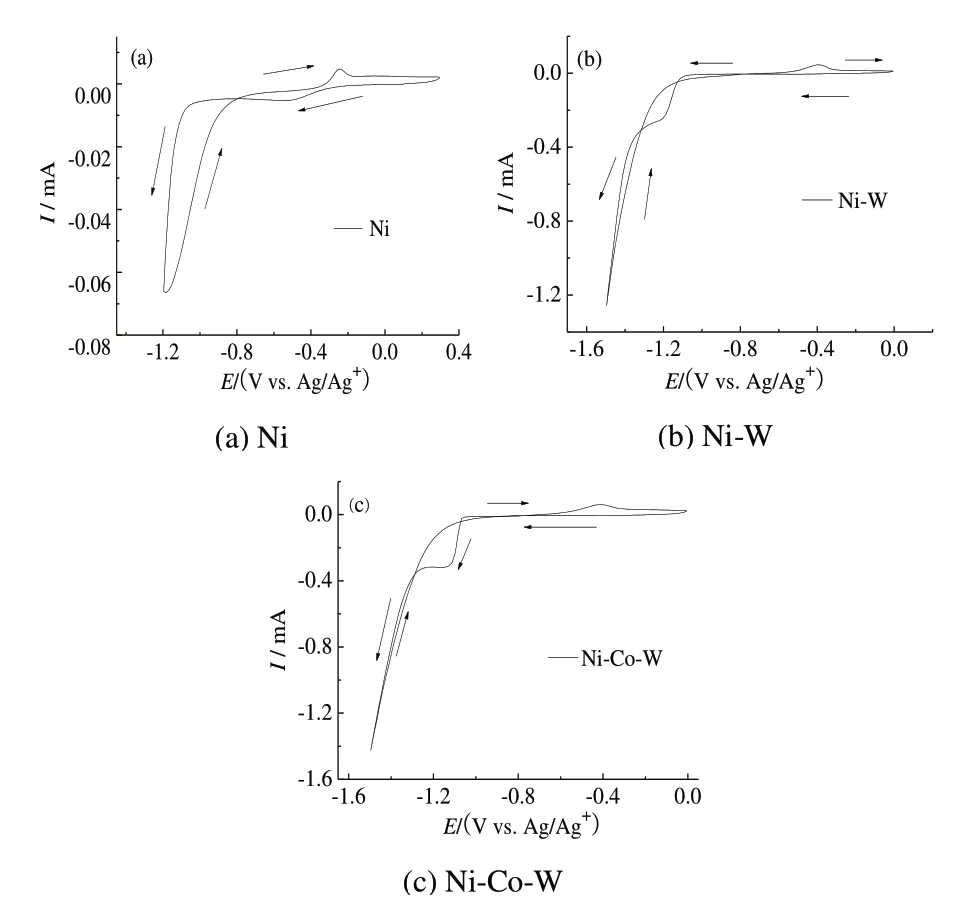
图1 Ni、Ni‐W、Ni‐Co‐W 循环伏安曲线Fig.1 Cyclic voltammetry curves of Ni,Ni‐W,Ni‐Co‐W
图1(a)、(b)和(c)分别为 Ni、Ni‐W、Ni‐Co‐W 电沉积循环伏安曲线。由图1 可知,Ni、Ni‐W、Ni‐Co‐W 的沉积电位分别为−1.11 V(沉积电流显著增大)、−1.2 V 和−1.1 V,且均存在成核环,说明三者的沉积均存在成核行为[7],Ni‐Co‐W合金的沉积电位最正。
图2(a)是不同扫速下 Ni‐Co‐W 合金的循环伏安曲线。由图2(a)可知,随着扫速的增大,Ni‐Co‐W合金还原峰电位负移。图2(b)是还原峰峰电位(Ep,c)与扫速的对数(lnv)的关系曲线。由图2(b)可知,Ep,c~lnv关系曲线呈良好的线性关系,说明 Ni‐Co‐W合金的电沉积反应为不可逆过程[8]。

图2 不同扫速下Ni‐Co‐W 合金电沉积的循环伏安曲线和Ep,c~lnv关系曲线Fig.2 Cyclic voltammetry curves and Ep,c~lnv relation‐ship of Ni‐Co‐W alloy electrodeposited with differ‐ent scan rate
2.2 阴极极化曲线分析
图3 是不同转速下 Ni‐Co‐W 合金电沉积的阴极极化曲线。由图3可知,随着转速的增大,沉积电流变大,这是因为转速的增大可减薄扩散层,使金属离子更易到达电极表面放电,电极反应速率加快[9]。

图3 不同转速下Ni‐Co‐W合金电沉积阴极极化曲线Fig.3 Cathodic polarization curves of Ni‐Co‐W alloy electrodeposited with different rotation rate
为了研究不同电位下Ni‐Co‐W 合金电沉积反应的速率控制步骤,做−1.1 V 和−1.2 V 时(混合控制区)I‐1~ω‐1/2关系曲线 ,如图4 所示。由图4 可知 ,I‐1~ω‐1/2均呈良好的线性关系,满足 Koutecky‐Levich关系[10],说明反应受扩散和动力学混合控制。

图4 不同电位下I‐1~ω‐1/2关系曲线Fig.4 I‐1~ω‐1/2curves with different potentials
2.3 电化学阻抗谱分析
图5 是不同电位下 Ni‐Co‐W 合金电沉积的电化学阻抗谱。由图5 可知,当电位为−1.1 V 时,阻抗谱高频端依然是由Cdl和Rct并联造成的容抗弧,低频端是由吸附作用造成的小容抗弧,由吸附电阻Rads和吸附电容Qads组成。当电位增大到−1.2 V时,阻抗谱变成了一个容抗弧,反应变为了只有电化学极化电阻时阻抗谱。均未出现Warburg 扩散电阻特征[11],说明合金的电沉积主要受动力学过程控制,当电位为−1.1 V 时,动力学过程由电化学极化和吸附过程组成;当电位为−1.2 V时,动力学过程仅为电化学极化过程。
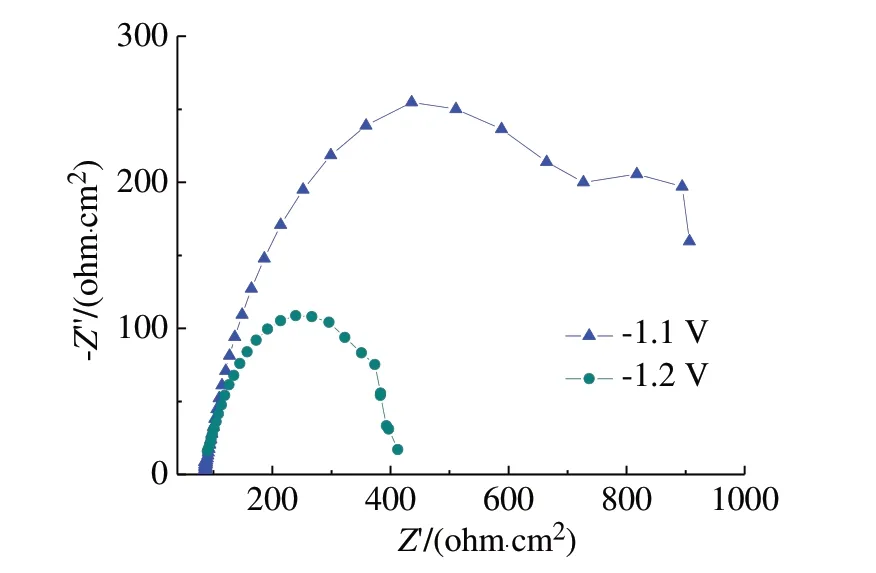
图5 不同电位下Ni‐Co‐W合金电沉积的电化学阻抗谱Fig.5 Electrochemical impedance spectra of Ni‐Co‐W alloy electrodeposited with different potentials
2.4 计时电流分析
图6(a)是不同电位下 Ni‐Co‐W 合金电沉积的计时电流I~t曲线。由图6(a)可知,随着电位的负移,反应达到最大沉积电流(Im)所需的时间(tm)缩短,说明成核速率逐渐加快,这是因为电位的负移会导致阴极极化加大,成核的驱动力变大,合金的成核率上升。
通过检验恒电位阶跃初期I~tn暂态曲线的线性关系 ,可以判断 Ni‐Co‐W 合金电沉积结晶成核机理。当n=1/2 时,为瞬时成核机制;当n=3/2 时,为连续成核机制。根据图6(a)中I~t曲线数据,取n=1/2得到 Ni‐Co‐W 合金电沉积初期I~t1/2暂态曲线,如图6(b)所示。由图6(b)可知,不同电位下,I与t1/2明显呈线性关系,表明在−1.1 V、−1.2 V 电位下,Ni‐Co‐W合金电沉积结晶机制为瞬时成核[12]。

图6 不同电位下 Ni‐Co‐W 合金电沉积 I~t 和 I~t1/2暂态曲线Fig.6 I~t and I~t1/2 curves of Ni‐Co‐W alloy electrode‐posited with different potentials
为研究不同电位下Ni‐Co‐W 合金的成核机制,作不同电位下合金电沉积的(I/Im)2~t/tm无因次曲线,如图7 所示。电位为−1.1 V 和−1.2 V 时的无因次曲线与理论瞬时成核曲线更加相近,说明Ni‐Co‐W 合金的成核机制为瞬时成核,这与检验恒电位阶跃初期I~t1/2暂态曲线的线性关系所得结论一致。
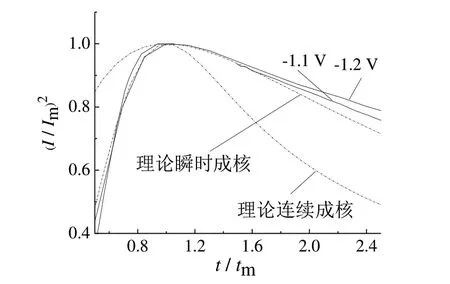
图7 不同电位下 Ni‐Co‐W 合金电沉积的(I/Im)2~t/tm无因次曲线Fig.7 (I/Im)2~t/tm dimensionless curve of Ni‐Co‐W alloy electrodeposited with different potentials
3 结论
(1)Ni‐Co‐W 合金的电沉积过程存在成核行为,电极反应是一个不可逆过程。
(2)Ni‐Co‐W 合金的电沉积过程由动力学和扩散混合控制,主要受动力学控制。
(3)Ni‐Co‐W合金的成核机制为瞬时成核。
