32例三阴性乳腺癌患者易感基因胚系突变分析
2021-05-17隆建萍闫有圣马秀芬毛红岩张庆华独晓燕高华方
隆建萍 闫有圣 杨 涛 马秀芬 毛红岩 张庆华 独晓燕 高华方*
1.甘肃省妇幼保健院(兰州,730050);2.国家卫健委科学技术研究所
乳腺癌的发病率及死亡率在女性恶性肿瘤中均位居第一位[1-2]。三阴性乳腺癌(TNBC)是指缺乏雌激素受体(ER)、孕激素受体(PR)及人类表皮生长因子-2(HER-2)表达的乳腺癌[3],相对于其他分子分型乳腺癌其预后较差,且更早发生局部复发或者远期转移[4-5]。BRCA1/2是最早发现的遗传性乳腺癌易感基因[6-8],在三阴性乳腺癌患者中BRCA1/2基因突变携带者率显著增高[9]。目前研究表明,除了BRCA1/2以外,已发现了十余种与乳腺癌相关的易感基因[10-12]。然而,即使对所有已知的乳腺癌相关基因进行综合分析,也只能在20%~30%具有明显遗传性癌症综合征临床特征的女性中找到明确的致病基因突变[13-14]。本研究应用二代测序的方法对于32例TNBC患者进行全外显子组测序,通过全外显子组分析完善中国人群中乳腺癌易感基因的突变谱,为乳腺癌的预防、相关遗传咨询及高危健康人群筛查提供依据。
1 对象和方法
1.1 对象
收集2018年1月-2019年12月在甘肃省妇幼保健院乳腺科确诊的乳腺侵入性导管癌患者50例,其中三阴性32例为研究对象,均为女性。病例入组标准:术后石蜡病理证实为浸润性乳腺癌;免疫组化证实ER<1%,PR<1%,HER-20~1+或者荧光原位杂交(FISH)证实为阴性;病历资料完整且有预后随访信息。所有入组患者均采集外周血5ml,EDTA抗凝,至于-80℃保存备用。本研究获得甘肃省妇幼保健院伦理委员会批准,临床资料收集和标本采集均获得患者知情同意。
1.2 全外显子组测序分析
1.2.1基因组DNA提取采用外周血基因组DNA提取试剂盒(QIAamp DNA Blood Mini Kit )提取患者外周血基因组DNA,利用核酸分析仪Qubit 2.0(Invitrogen)进行核酸定量,提取的基因组DNA在-20℃保存备用。
1.2.2全外显子组捕获测序基因组DNA经Covaris超声破碎仪随机打断成长度为180-280bp的片段,采用Agilent SureSelect Human All Exon V6试剂盒进行建库和外显子组捕获。全外显子组建库样本在Novaseq6000测序仪(Illumina, San Diego, USA)上进行双端150bp测序分析。
1.2.3生物信息学分析测序片段通过BWA软件(V 0.7.9a)与参考基因组(GRCh37/hg19)进行比对[15]。采用Picard V.2.22.9(http://broadinstitute.github.io/picard/)软件去除PCR重复序列,然后进行下游的数据分析。变异检测采用 GATK(v3.2)软件进行,包括采用碱基质量分数校正、InDels位置和质量分数校正、SNVs和InDels变异发现和分型[16]。变异采用变异功能预测软件VEP(Ensembl 73)进行变异注释[17]。
1.2.4全外显子基因变异筛选采用以下流程进行变异筛选:①通过千人基因组数据库、gnomAD、dbSNP数据库筛选东亚人群中频率<1%,并且本地正常人群数据库中变异频率<5%的稀有变异。其中功能性的编码区和剪接位点的变异将进入下一步分析,主要包括功能缺失型变异(获得终止密码子的变异,移码变异和关键剪接位点变异)、错义变异、非移码的缺失/插入。②采用ClinVar, HGMD和BRCA Exchange数据库剔除已知的良性和可疑良性的变异。③通过HPO数据库、Phenolyzer数据库等筛选与乳腺肿瘤相关的基因变异。筛选获得的意义不明的编码区错义变异采用变异功能预测软件:SIFT和PolyPhen-2软件进行功能预测。依据美国医学遗传学与基因组学学会(ACMG)发布的《序列变异解读标准和指南》对每个变异进行分类。参照国际基因变异命题体制(http://www.hgvs.org/mutnomen)进行变异的命名。
1.3 Sanger测序验证
对生物信息学分析获得的候选致病基因突变位点,在其周围设计上下游扩增引物,PCR反应后获得目标区域产物,采用BigDye3.1(ABI)测序试剂盒进行测序反应,产物经乙醇沉淀法纯化后在ABI3500测序仪上进行序列分析。
1.4 统计分析
采用SPSS 22.0进行统计学分析,应用t检验分析乳腺癌患者临床病理数据与基因突变的相关性,Fisher确切检验比较易感基因突变与遗传性乳腺癌高风险乳腺癌患者临床特征之间的关系。
2 结果
2.1 乳腺癌患者临床特征分析
本研究纳入32例乳腺癌患者,均经病理确诊为TNBC,确诊年龄(50.3±12.1)岁,其中早发型(年龄≤45岁)13例。所有患者均无肿瘤家族史。
2.2 BRCA1/2基因突变分析
32例中14例检测到BRCA1/2罕见变异,其中致病性(P)或可疑致病性(LP)变异6例,突变携带频率为18.8%;意义未明性变异8例,突变携带频率为25.0%,(表1)。BRCA1基因变异患者8例,BRCA2基因突变患者6例;突变类型中错义突变8例,为主要的突变类型。14例BRCA基因变异患者平均年龄为44.1±14.2岁,与非BRCA基因变异者(55.2±7.5)相比确诊年龄存在显著性差异(t=-2.859,P<0.01)。
6例BRCA1/2基因P/LP变异的患者中,gsfy_019和gsfy_041检测到了BRCA1变异c.5468-1_5474del;gsfy_004和gsfy_034检测到了c.4749_4750del;在gsfy_020患者中检测到BRCA2已知致病变异c.51_52del,查阅dbBRCA Chinese V2.0数据库[18],在中国人中未见报道。
8例BRCA1/2基因变异根据ACMG指南分类为意义未明变异(VUS),其中BRCA2基因变异c.6027A>C在数据库已知变异中未查询到,属于新突变;3个变异BRCA2:c.3794G>T、c.7901T>A,BRCA1:c.4616T>C首次在中国人群中发现。gsfy_044患者检测到BRCA1基因变异NM_007294.3:c.5511G>C,p.(Trp1837Cys),该变异在clinvar数据库的致病性分类结果存在冲突(LP/P/VUS);gsfy_035患者检测到BRCA2基因变异NM_000059.3:c.7901T>A,p.(Met2634Lys),致病性分类结果为VUS。
6例BRCA1/2已知致病性基因突变中5例为早发型乳腺癌,8例携带BRCA1/2基因意义未明变异中4例年龄<45岁,18例未携带BRCA1/2基因变异中4例为早发型,早发患者中BRCA1/2基因突变率显著高于晚发的患者(Fisher=7.072,P=0.023)。
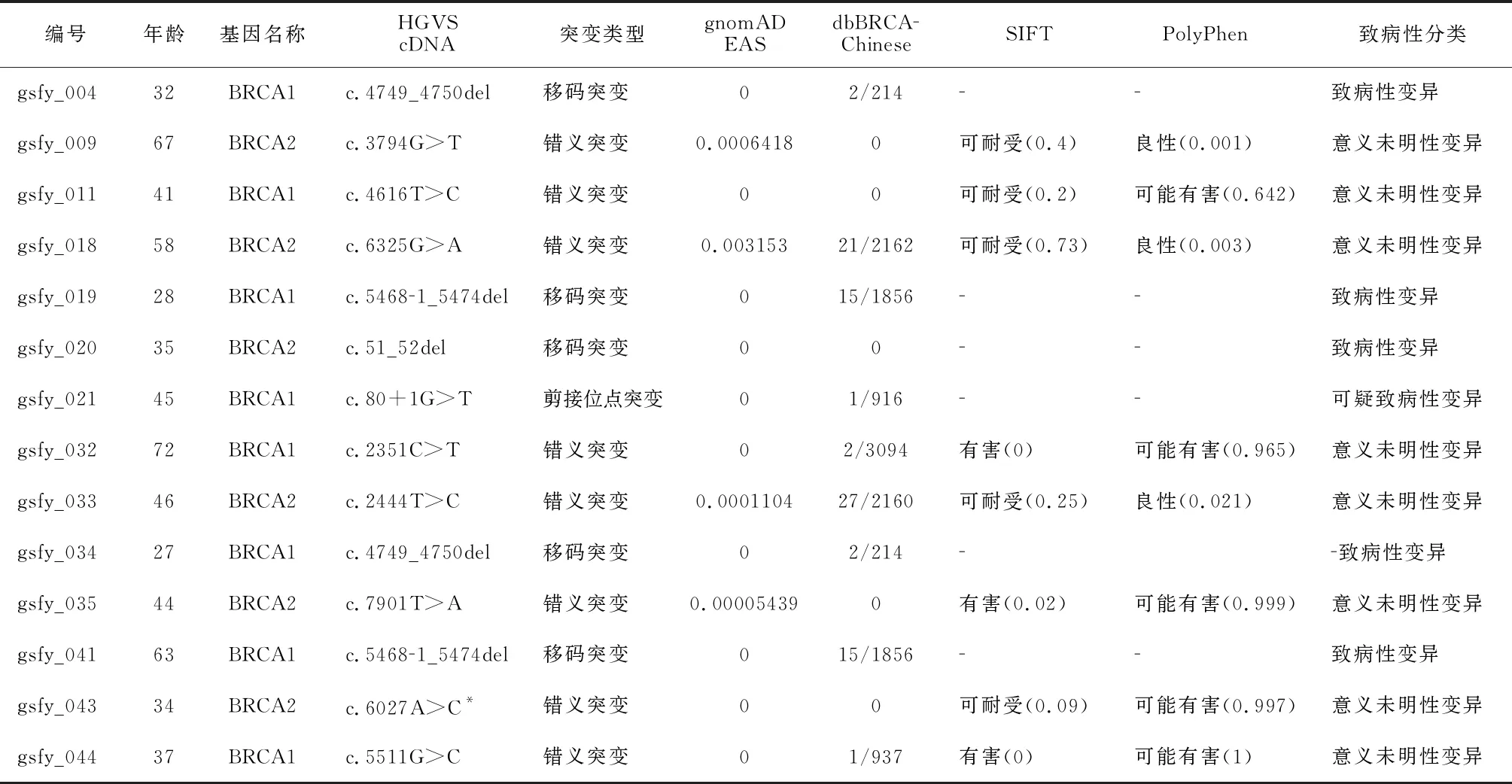
表1 32例TNBC患者BRCA1/2基因突变
2.3 其他乳腺癌易感基因突变分析
通过全外显子组分析32个病例中检测到83个乳腺肿瘤易感基因变异,每个患者约携带2.6个变异,其中2个以上患者携带的乳腺癌易感基因包括ALK、APC、CDH1、PTCH2、RB1CC1、RAD51D 、RAD54L、TSC1等。根据ACMG指南,9个变异为致病性和可疑致病性变异(表2),74个变异为意义未明变异,致病和可疑致病突变检出率为28.1%(9/32)。
83个变异涉及62个已知与乳腺肿瘤相关的易感基因,涉及到DNA同源重组修复的基因包括ATM、BARD1、BRIP1、CHEK2、PALB2、RAD50、RAD51D、RAD54L。其中RAD54L基因可疑致病变异NM_001142548.1:c.1093_1169+15dup,患者gsfy_031和gsfy_045被检测到;gsfy_022检测到了RAD51D基因NM_001142571.1:c.184C>T致病变异。4例患者同时检测到STAT5A基因变异c.1226C>T,突变频率为为0.0625(4/64),gnomAD数据库东亚人群频率为0.002827,SIFT预测结果为有害[deleterious(0.01)],PolyPhen预测结果[probably_damaging(0.964)],依据ACMG指南分类为意义不明变异。
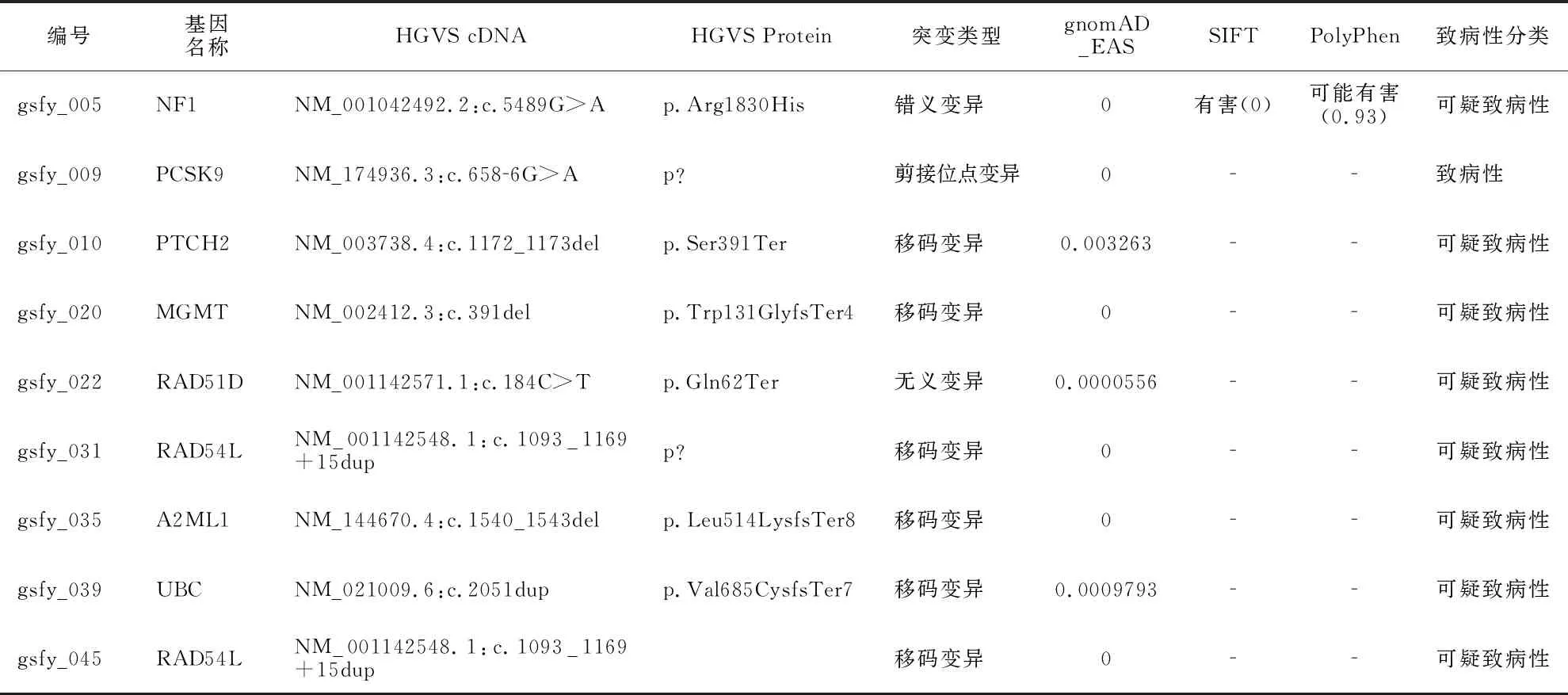
表2 32例TNBC患者非BRCA1/2基因突变分析结果(致病和可疑致病变异)
3 讨论
BRCA1/2是TNBC患者中最常见的易感基因突变,在TNBC病例中,BRCA1/2致病性胚系突变的检出率约为乳腺癌总体突变率的2倍[9,19]。在本研究采用高通量测序技术分析32个TNBC患者全外显子组,探讨乳腺癌患者乳腺癌易感基因突变的分布情况。32例患者BRCA1/2致病性突变携带频率为18.8%,高于既往文献报道[9]。
有研究显示在早发性乳腺癌患者中(年龄≤40岁)BRCA1/2基因突变频率更高,一项遗传咨询队列的研究显示,在146例早发性TNBC患者中检测到64例患者携带有BRCA1/2基因突变,突变率达到了43.8%[20]。本研究中6例BRCA已知致病性基因突变中5例为早发型乳腺癌,8例携带BRCA1/2基因意义未明变异患者中4例年龄<45岁,而在其他18例未携带BRCA基因变异的患者中只有4例为早发型。进一步证实了BRCA1/2基因突变与早发型TNBC相关。美国国立综合癌症网络(NCCN)指南也推荐在TNBC患者常规进行BRCA基因突变筛查[21-22]。
在检测到14个BRCA1/2基因突变中,BRCA1:c.5468-1_5474del突变在2例患者中检测到,该突变是中国人群中最常见的突变,提示可能存在建立者效应[23-24]。BRCA1:c.4749_4750del突变也在2个患者中被检测到,查阅了dbBRCA Chinese V2.0该突变在中国人群中只有2例报道,这个变异是否属于西北地区热点突变需要进一步研究去验证。 本研究在BRCA2基因检测到一个新变异c.6027A>C,该变异在gnomAD数据库中没有频率,在ClinVar, HGMD和BRCA Exchange数据库中均未查询到,致病性分类为意义未明变异,对于其致病性需要通过更大样本量的研究去验证。8例患者检测到BRCA1/2基因变异为错义变异,依据ACMG-指南分类为意义未明变异,这些变异是否致病或者良性仍然需要大量的数据去验证,可以作为临床分析的参考。
患者gsfy_044检测到BRCA1基因变异NM_007294.3:c.5511G>C(p.(Trp1837Cys)),该变异在BRCA1基因cDNA水平5511位鸟嘌呤被胞嘧啶替换,导致蛋白序列第1837位色氨酸转变为半胱氨酸。功能研究显示,与野生型相比,这种突变体导致BRCA1蛋白结合活性、特异性、转录因子活性均受损,并导致严重的蛋白折叠缺陷[25]。Trp1837Cys位于物种间保守区域BRCT2,该区域已知与多个蛋白发生相互作用[26]。生物信息学分析显示该突变可能会破坏蛋白的结构和功能(SFT:deleterious(0.02);PolyPhen:probably_damaging(0.999))。尽管以上的证据显示BRCA1:c.5511G>C有致病的可能性,但是目前的证据还不足以将其确定为致病致病性变异,所以仍然将该变异列为意义不明变异。
患者gsfy_035 检测到BRCA2基因变异NM_000059.3:c.7901T>A,p.(Met2634Lys),该变异在BRCA2基因cDNA水平7901胸腺嘧啶替换为腺嘌呤,导致263位蛋氨酸被赖氨酸替换。生物信息预测结果显示该突变导致蛋白质结构和功能受损(SFT:deleterious(0.02);PolyPhen:probably_damaging(0.999))在gnomAD数据库中8842例检测个体发现1例携带该变异。BRCA Exchange 数据库将该变异分类为意义未明变异。
除BRCA1/2基因突变外,已经发现多个与肿瘤相关的基因可能导致遗传性/家族性乳腺癌的发生,包括ATM、BRIPI、CHEK2、NBN、PALB2、RAD51C和RAD51D,但是现有的研究显示只有BRCA1、BRCA2、PALB2和FANCM与TNBC有密切的相关性[12]。本研究对于32个TNBC进行了全外显子组测序,分析与肿瘤相关的基因突变,发现了83个乳腺肿瘤易感基因变异,其中9个变异为致病性和可疑致病性变异,检出率为28.1%。Couch等[15]采用靶向测序方法在TNBC患者中分析除了BRCA1/2的15个肿瘤易感基因,结果发现在TNBC患者中只能检测到3.7%的致病性变异。本研究中采用的全外显子测序技术,致病性变异检出率远高于靶向测序分析,主要是全外显子测序可以发现更多的肿瘤易感基因。
本研中检测到的83个变异涉及62个已知与乳腺肿瘤相关的易感基因,主要涉及到DNA损伤修复相关的基因,如ATM、BARD1、BRIP1、CHEK2、PALB2、RAD50、RAD51D、RAD54L。 但是本研究中并没有发现相关易感基因的热点突变,大部分突变均为新发现的变异,致病性尚不明确,所以对于TNBC易感基因的研究仍然需要大量的研究去发现和证实。
在32例TNBC患者中有4例检测到STAT5A基因变异c.1226C>T(rs143067673),突变频率为0.0625(4/64),远高于gnomAD数据库东亚人群频率0.002827(58/251320)。STAT5A基因编码的蛋白质是转录因子STAT家族的成员[27]。在对细胞因子和生长因子的反应中,STAT家族成员被受体相关激酶磷酸化,然后形成同源或异质二聚体,并移位到细胞核中作为转录激活因子[28]。该蛋白被激活,并介导许多细胞配体的反应,如白介素2(IL2)、白介素3(IL3)、 白介素7(IL7)、 粒细胞-巨噬细胞集落刺激因子(GM-CSF)、促红细胞生成素、血小板生成素、生长激素[29]。该蛋白在骨髓瘤和淋巴瘤中与TEL/JAK2基因融合相关的激活不依赖于细胞刺激,已被证明是肿瘤发生的关键[30-31]。NPM1/ALK可诱导STAT5A基因表观遗传沉默,STAT5A蛋白可通过抑制NPM1/ALK表达而起到抑癌作用[32]。ATAT5A可能与TNBC的表型具有一定的相关性,该结果需要扩大样本量进一步验证。
本研究结果显示,BRCA1/2是TNBC患者最重要的易感基因,其他与DNA损伤修复相关的基因突变可能与TNBC患者的表型有一定的相关性,这些初步的研究结果将对患者的治疗也预后评估产生一定的积极作用。
