p16与高危型人乳头瘤病毒感染关系及在不同宫颈病变患者中表达
2021-05-17胡又丹靳健美陈丽融刘常燕
胡又丹 靳健美 陈丽融 刘常燕
四川省达州市中西医结合医院(635000)
宫颈癌是最常见的妇科恶性肿瘤之一,全球每年约有50万名妇女被诊断出宫颈癌,死亡率在50%以上[1]。高危型人乳头瘤病毒(HR-HPV)持续感染是导致宫颈癌发生的主要原因[2]。目前研究发现的HPV病毒种类高达100多种,其中在宫颈癌患者中发现有30种[3]。P16是一种抑癌基因[4]。有研究表明,P16蛋白表达与子宫颈上皮内瘤变(CIN)及宫颈癌的发生关系密切,检测P16水平可用于宫颈疾病的诊断及治疗预后[5]。本研究通过对不同HPV分型宫颈病变患者p16表达分析,探讨其及与HR-HPV感染关系。
1 资料与方法
1.1 一般资料
回顾性收集本院2017年6月-2019年6月收治的宫颈疾病患者104例临床资料,年龄(38.7±17.3)岁(19~73岁),其中HR-HPV阳性高级别鳞状上皮内瘤变(HSIL)60例(CINⅡ级36例、CINⅢ级24例),HR-HPV阳性宫颈炎15例,HR-HPV阴性宫颈炎15例,HR-HPV阳性宫颈癌(CC)14例。收集患者宫颈活检病理组织检测HPV感染情况及P16蛋白表达水平。纳入标准:①确诊宫颈疾病;②患者及家属知晓本研究内容并签署知情同意书。排除标准:①患者有放化疗史;②既往接受过激素治疗;③资料不全。本研究经本院伦理委员会审批。
1.2 试剂
HPV分型检测试剂盒及宫颈脱落细胞保存液购自广东凯普生物科技股份有限公司,P16蛋白免疫组化试剂盒购自invitrgen公司。
1.3 检测方法
1.3.1样本收集宫颈刷收集患者子宫颈脱落细胞,保存于细胞保存液;收集患者阴道镜检查中获取的宫颈活检组织,10%中性福尔马林固定,石蜡包埋,切片4μm。
1.3.2 HPV分型按照试剂盒说明书进行HPV基因组DNA提取、PCR扩增及核酸分子杂交检测等操作,对收集的患者宫颈脱落细胞进行分型检测,其中低危型有5种亚型:6、11、42、43、44;高危型有13种:16、18、31、33、35、39、45、51、52、56、58、59、68;亚洲亚型3种:53、66、cp8304。
1.3.3 P16蛋白表达将制备好的切片烤片后顺序漂洗脱蜡至水,于磷酸缓冲液(PBS)漂洗3次,加入H2O2阻断内源性过氧化物酶,再PBS缓漂洗3次,滴加特异性一抗,37℃孵育2h, PBS漂洗3次,于EnVision复合物孵育30min, PBS漂洗3次,水洗、复染、封片,显微镜下观察结果。
1.3.4判读标准HPV分型检测:以肉眼观察,通过芯片上HPV分型分布特异性点的阳性反应来判断HPV亚型,蓝色圆点为阳性位点,多位蓝紫色圆点则为混合感染。每张芯片设置PCR反应质控点和杂交显色质控点。P16蛋白表达:阳性细胞数<5%为阴性(-),5%~24%为弱阳性(+),25%~50%之间为阳性(++),>50%为强阳性(+++)。
1.4 统计学方法
采用SPSS 20.0统计学分析。计数数据用(%)表示,组间比较行χ2检验。检验水准α= 0.05。
2 结果
2.1 不同HR-HPV病理分型与P16表达关系
13种高危型HPV分型中,p16蛋白表达阳性率均≥50%,其中阳性率≥80%有7种,p16蛋白表达总阳性率为84.3%。见表1。
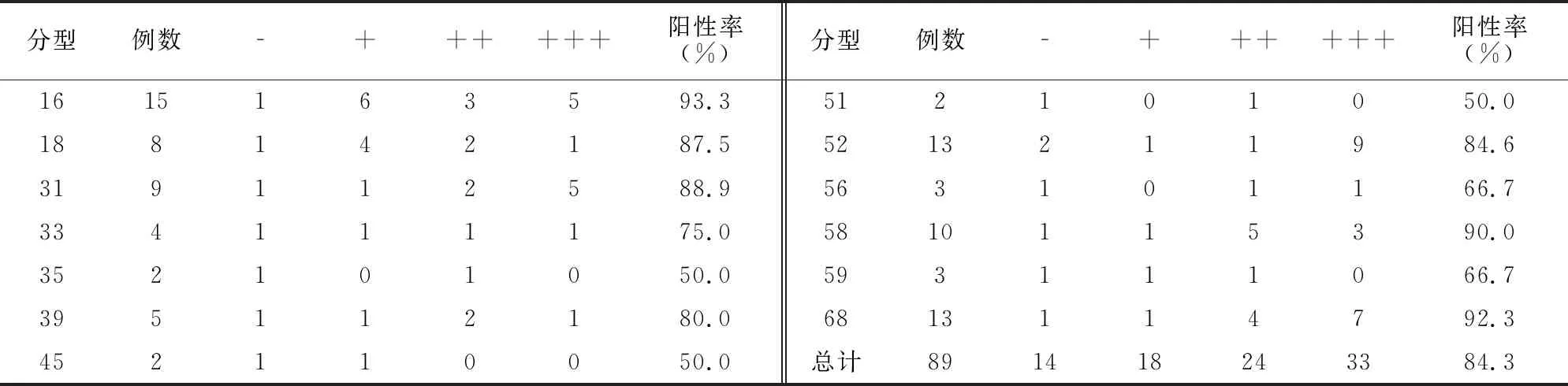
表1 不同HR-HPV分型P16表达分布情况(例)
2.2 P16表达水平与HPV感染
P16蛋白表达(-)28例,感染20例(71.4%);(+)18例,感染16例(88.9%);(++)25例,感染23例(92.0%);(+++)33例,感染32例(97.0%)。P16蛋白表达水平越高HPV感染率越高(χ2=9.813,P=0.02)。
2.3 不同宫颈病变者P16表达
免疫组化分析,不同宫颈病变者p16蛋白表达阳性率存在差异,且CIN病变患者中CINⅢ级患者p16阳性率高于CINⅡ级患者(均P<0.05)。见表2。
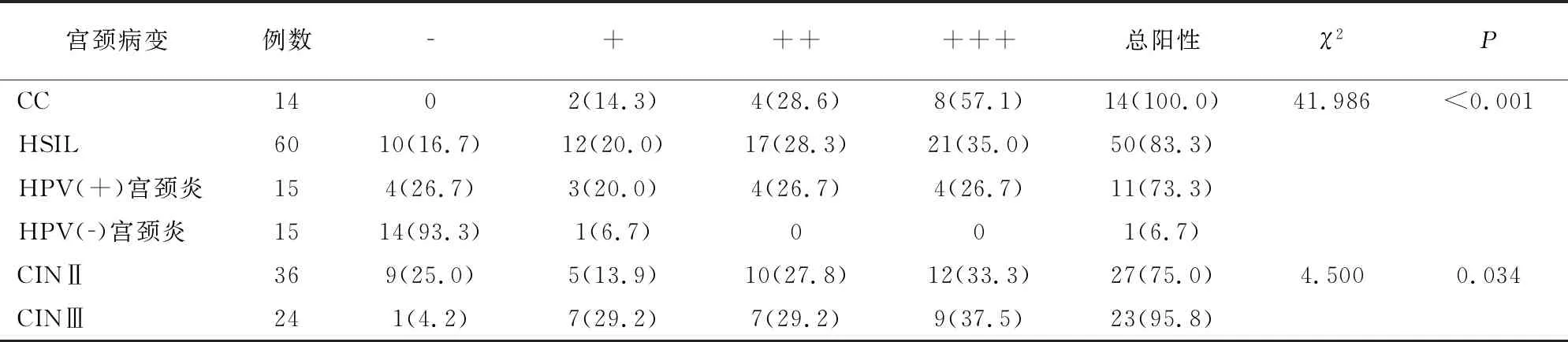
表2 不同宫颈病变者p16蛋白表达比较[例(%)]
3 讨论
HPV感染是宫颈癌发病的主要原因, 90%的宫颈癌患者伴有HR-HPV感染。宫颈癌的发生与HPV感染有明确相关性,HPV持续感染会导致宫颈上皮内瘤变并逐渐发展为浸润性宫颈癌[6]。宫颈疾病从CINⅠ~CINⅢ是一个连续渐进过程,一般从轻度病变发展为宫颈癌大约需要10年的时间[7]。因此早期宫颈疾病检查和治疗十分重要。
HPV感染的一般症状为寻常疣、生殖器疣等[8]。目前已分离出的HPV有130多种,不同型别HPV引起的临床表现各不相同。HPV抵抗力较强,传播途径一般为直接或间接接触、母婴传播、性传播[9]。P16基因表达蛋白定位于细胞核内,在细胞分裂周期中起重要作用[10]。是CDK4的抑制因子,参与细胞增殖的负调节,p16通过与Cyclin D竞争性结合CDK4级CDK6,对Cyclin D活性起到抑制作用,使其底物高度去磷酸化,导致转录因子E2F持续抑制,从而使细胞周期停滞在G1期,抑制细胞增殖[11]。已有研究表明,HPV感染会导致E7蛋白高表达,从而抑制Rb与E2F结合,导致Rb失活,促使p16过表达,并破坏p16-Rb反馈系统,使p16失去正常功能,引起细胞增殖肿瘤发生,宫颈组织中p16蛋白的高表达水平可间接提示HR-HPV感染[12]。在以往研究中,p16蛋白常被作为判断宫颈细胞发育的生物标志物[13];最近有研究提出宫颈组织中p16蛋白表达量增加与宫颈上皮内瘤变程度呈正相关[14]。
本研究检测结果显示,感染13种高危型HPV分型患者的p16蛋白表达阳性率均在50%以上,其中有7种分型阳性率在80%以上,p16蛋白表达总阳性率为84.3%。表明在感染高危型HPV患者中,p16蛋白表达水平均较高;且P16蛋白表达水平越高HPV感染率越高,表明p16蛋白表达水平与高危型HPV感染有关。对不同宫颈病变程度患者p16蛋白表达水平检测发现存在差异,病变程度越高p16蛋白表达阳性率越高,CINⅢ级患者p16阳性率高于CINⅡ级患者。提示,检测p16蛋白表达水平对宫颈疾病程度及高危型HPV感染程度判断均有一定参考价值,可能作为HR-HPV患者预后的参考指标。
综上所述,宫颈病变患者p16表达水平与宫颈病变程度及高危HPV感染有关,p16表达水平越高HPV感染率越高,宫颈病变程度越高p16表达阳性率越高。提示临床,检测p16表达可能有助于宫颈疾病的诊断。
