膀胱癌影像报告及数据系统对膀胱癌肌层浸润的诊断价值
2021-05-17鄂天娇王小林郑桂华
鄂天娇 冯 峰 王小林 郑桂华
膀胱癌在国际恶性肿瘤的排名中位于第9 位[1],在我国居男性肿瘤的第7 位[2],多见于老年男性,病理上以尿路上皮癌较为多见。尿路上皮癌可分为低级别和高级别2 种,其中高级别尿路上皮癌又可分为肌层浸润型癌和非肌层浸润型癌,由于二者治疗方式及预后有很大不同[3-4],故两者的术前准确评估对于该肿瘤的临床治疗方法及预后意义重大。磁共振检查由于其出色的软组织分辨力及功能成像的应用逐渐成为膀胱癌的首选影像学检查方法[5]。膀胱癌影像报告及数据系统(VI-RADS)于2018 年创建,其核心是将膀胱癌多参数MRI的影像报告标准化,并提出了5分制VI-RADS 评分,旨在提示膀胱肌层浸润的可能性。本研究旨在通过分析膀胱癌病灶的多参数磁共振与病理资料,探讨该评分系统对膀胱癌肌层浸润的诊断价值。
方 法
1. 病例资料
回顾性搜集并分析我院自2018 年1 月至2019 年11 月的全部经手术病理证实的膀胱癌病例共77 例,其中男62 例,女15 例。全部病例中单发62 例,多发15 例;对于多发病灶的病例,纳入病理结果可明确对应的全部病灶。本研究共纳入101个病灶。
2. 多参数MRI检查及VI-RADS评分方法
全部病例均在术前行多参数磁共振检查,患者禁食4~6小时,于检查前2小时排空膀胱内尿液后禁食、水。采用1.5T 超导型磁共振扫描仪(Siemens Magnetom Espree 1.5T)进行成像,扫描范围由腹主动脉分叉处至耻骨联合下缘水平。
检查序列包含横轴面T1WI,横断面、矢状面和冠状面TSE T2WI、单次激发平面回波成像(singleshot echo-planar imaging,SS-EPI)、弥散张量成像(diffusion tensor imaging,DWI)及自动生成表观扩散系数(apparent diffusion coefficient,ADC)图、动态增强扫描(dynamic contrast enhanced MRI,DCE),扫描参数见表1。用高压注射器静脉注射对比剂Gd-DTPA,注射流速为2.0 ml/s,紧接着用等量生理盐水冲管,注射剂量为0.2 mmol/kg,扫描时间为5 min。
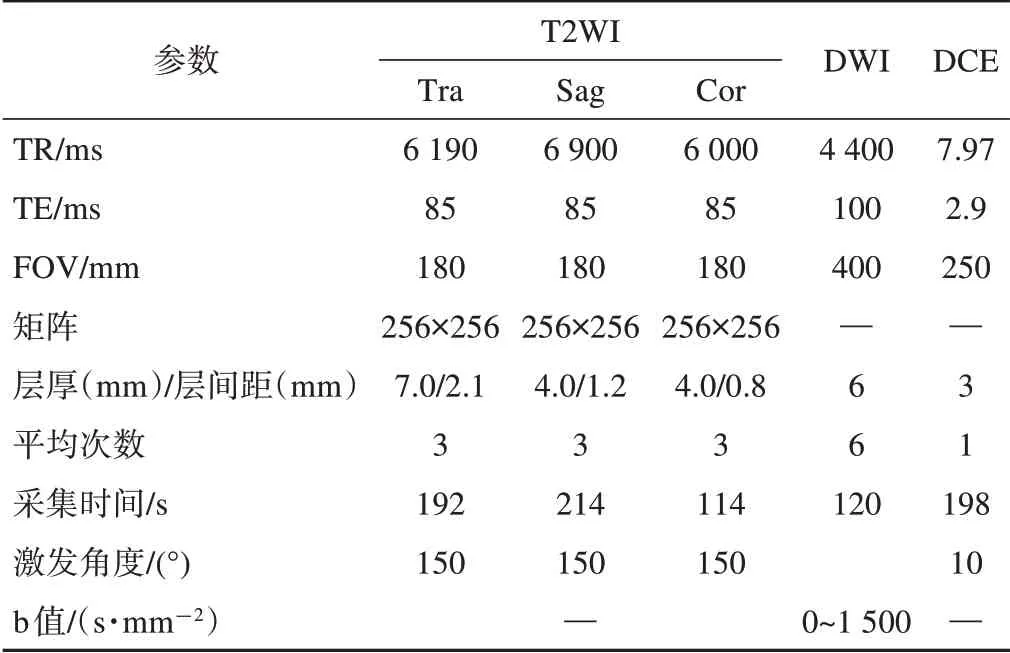
表1 MRI扫描参数
将扫描图像传入PACS 系统,分别由2 位具有5年和3 年磁共振诊断经验的医师间隔至少2 周时间严格按照VI-RADS 评分标准采用盲法对全部病灶的T2WI、DWI、DCE 图像进行评分,并与每个肿瘤的术后病理结果进行比较,除去病理结果不明确、图像质量不佳无法评分的病灶,2 位阅片者间的分歧通过协商解决。
3. 统计学方法
统计学分析使用SPSS 20.0及MedCalc 16.0软件,通过Kappa 检验验证2 位观察者间的评分一致性。使用Spearman 相关分析评估VI-RADS 评分与膀胱癌病灶肌层浸润的关联。绘制T2WI、DWI、DCE 及VIRADS 评分的受试者工作特征(receiver operating characteristic,ROC)曲线,判断最佳诊断阈值,并通过计算诊断灵敏度、特异度及曲线下面积(area under the curve,AUC)评估VI-RADS 及其关键序列对肌层浸润性膀胱癌的诊断效能。采用u 检验比较肌层浸润与非肌层浸润膀胱癌在T2WI、DWI、DCE、及T2WI+DWI+DCE 的VI-RADS 评分差异。P<0.05为差异有统计学意义。
结 果
共纳入膀胱癌患者77 例,年龄31~90 岁,平均(70±16)岁。其中男性62 例,平均年龄(73±17)岁;女 性15 例,平 均 年 龄(66±18) 岁。70 例(90.9%,70/77)患者以无痛性肉眼血尿收治入院,1例(1.3%,1/77)症状为排尿困难,体检发现者6 例(7.8%,6/77)。病灶单发62 例(80.5%,62/77),多发15 例(19.5%,15/77),共纳入病灶101 个。全部病例均行手术治疗,对于行经尿道膀胱肿瘤切除术的患者,还应切除肿瘤底部的肌层组织,以评估有无肌层侵犯。术后病理示高级别尿路上皮癌87 个,其中20 个(23.0%,20/87) 病 灶 有 肌 层 浸 润,67 个(77.0%,67/87)病灶未见肌层浸润;低级别尿路上皮癌14个,均未见肌层浸润。
2 位观察者按照VI-RADS 评分标准对101 个病灶进行评分,评分结果与病理对照见表2。观察者间的T2WI、DWI 及DCE 的Kappa 值分别为0.793、0.765、0.828,对VI-RADS 总体评分的一致性良好,Kappa值为0.923。经u 检验,肌层浸润和非肌层浸润病灶的T2WI、DWI、DCE 和VIRADS 评分上的差异均有统计学意义。Spearman 相关分析得出T2WI、DWI、DCE和VI-RADS评分均与膀胱癌肌层浸润相关。
VI-RADS 评分鉴别肌层浸润和非肌层浸润膀胱癌病灶的ROC 曲线见图1。T2WI、DWI、DCE及VIRADS评分的最佳界值为3.0,以3分为界值,相对应的各个序列诊断效能的相关数据见表3。其中:T2WI的灵敏度、特异度、准确度和AUC 分别为85.00%、98.77%、83.17%和0.978;DWI 的上述指标分别为85.00%、98.77%、84.16%和0.981;DCE 的分别为90.00%、98.77%、84.16%和0.965;VI-RADS 的分别为90.00%、98.77%、84.16%和0.986。
病灶位于膀胱侧壁34 个(33.67%,34/101),膀胱顶9 个(8.91%,9/101),三角区12 个(11.88%,12/101),前壁15 个(14.85%,15/101),后壁21 个(20.79%,21/101),输尿管口9 个(8.91%,9/101),呈弥漫分布1 个(0.99%,1/101)。81 个非肌层浸润膀胱癌病灶中,有74 个呈外生性菜花样凸向膀胱腔内,6 个为扁平状,1 个为混合性生长;而20 个肌层浸润膀胱癌病灶中,外生性菜花状病灶7 个,扁平状沿膀胱壁生长的5 个,混合性生长的病灶有8 个。膀
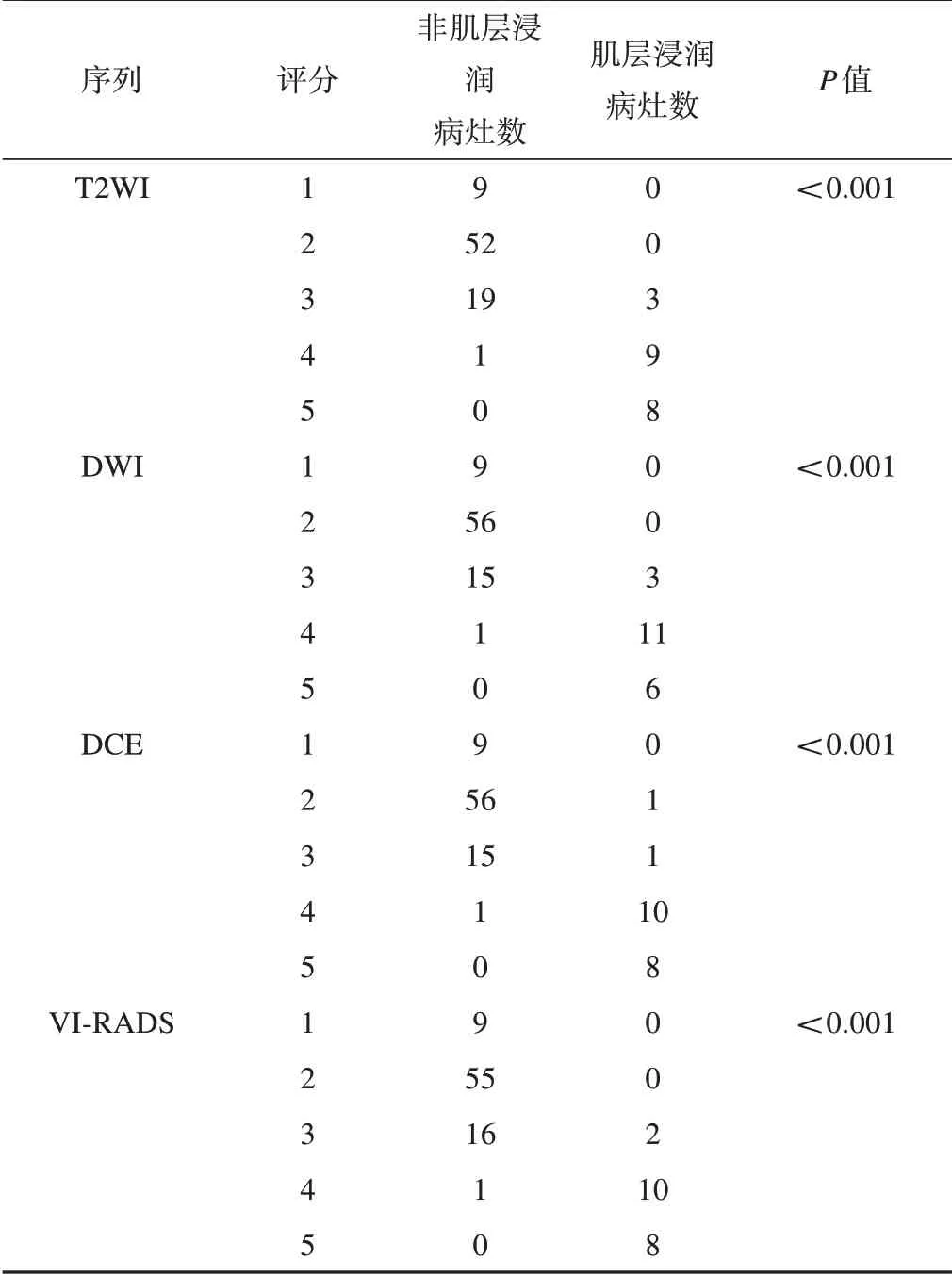
表2 评分结果与病理对照
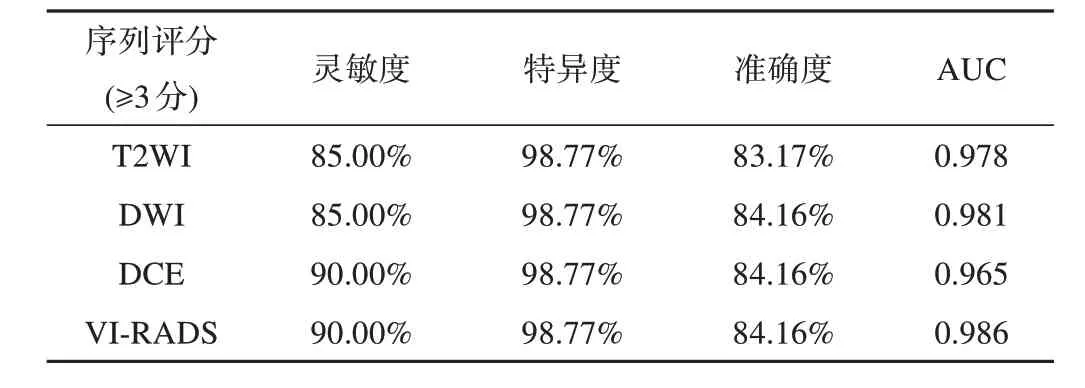
表3 T2WI、DWI、DCE及VI⁃RADS的诊断效能
胱肿瘤生长方式与肌层浸润间的关系见表4、5。
讨 论
本组膀胱癌病例中男性患者的平均年龄为73 岁,女性患者平均66 岁,对于老年患者,治疗前准确地评估病灶与膀胱肌层的关系,有助于减少不必要的侵入性治疗,提高患者的整体生活质量。
传统上膀胱癌的局部分期依赖于经尿道膀胱肿瘤切除术(TURBT),影像学检查主要用来评估淋巴结及远处转移情况,但TURBT有发生膀胱穿孔的风险,并且约48%的患者肿瘤分期被低估[6-8]。近年来磁共振检查由于其出色的软组织分辨力及功能成像的应用而成为膀胱癌的首选影像学检查方法[9]。多参数磁共振成像包括常规成像序列和功能序列,前者包括T1WI、T2WI,后者包括DWI、DCE-MRI 等,已有较多研究表明多参数磁共振可能作为膀胱癌的首选检查并成为诊断和分期的有力工具[10],但仍存在图像质量参差不齐、缺乏统一的诊断标准及扫描规范的问题,影响放射科医师与临床医师之间的沟通。

图1 T2WI(SC)、DWI(DW)、DCE(CE)及VI-RADS评分诊断膀胱癌肌层浸润的ROC曲线

表4 膀胱肿瘤生长方式与肌层浸润的关系

表5 膀胱肿瘤生长方式与VI⁃RADS评分的关系
膀胱癌影像报告及数据系统(VI-RADS) 于2018 年由日本腹部放射学年会、欧洲泌尿学会和欧洲泌尿影像学会共同发表,该评分系统首次提出膀胱癌MRI的5分制评分方法,用于术前评估膀胱癌病灶侵犯膀胱肌层的可能性,并且对膀胱MRI 的检查设备和技术方面提出了指导和建议[5,11]。
本研究回顾性分析了101 个膀胱癌病灶,对于观察者间一致性,T2WI、DWI、DCE 的Kappa 值分别为0.793、0.765、0.828,本组病灶评分存在的分歧主要是位于膀胱顶部、三角区及输尿管口病灶的3 分和4 分之间。Wang 等[12]的研究中,评分出现分歧的病灶亦多位于输尿管口及膀胱颈,因此,对特殊解剖部位病灶的VI-RADS 评分情况有必要进一步调查研究。在VI-RADS 评分系统中,最终是由T2WI、DWI、DCE 评分汇总得出的膀胱肌层受侵概率,T2WI 虽然可较清楚地显示肿瘤与膀胱壁肌层的分界,但可能由于肿瘤引起的纤维化或炎症而导致评分过高,弥散加权成像(DWI)有可能将肌层信号强度与二者区分,从而降低假阳性率[11],因此,将常规形态学图像与包括DWI 的功能成像相结合可改善MRI 的整体诊断性能。本研究结果表明VI-RADS 总体评分一致性良好,Kappa值为0.923%。
在本组病灶评分过程中,也遇到一些困难,例如当T2WI 评分为4 分,即肌层低信号线中断,而DWI及DCE 评分均≤3 分,即未见DWI 高信号的肿瘤延伸至固有肌层和DCE 上肿瘤早期增强局灶性延伸至固有肌层时,如何判定VI-RADS 评分,这在VI-RADS并未提及。笔者认为这种情况可能和膀胱充盈不良或充盈过饱影响T2WI 判断导致评分过高有一定关系,因此,图像质量、患者准备及膀胱充盈情况对VIRADS评分很重要。
膀胱癌中约30%的病例为多发[9]。本组病例中有15 例患者为多发病灶,约占总病例数的19.5%(15/77),若只纳入评分最高的病灶,则可能会提高肌层浸润性病灶所占的比例,影响总体统计结果;VI-RADS 也指出应记录多个肿瘤。因此,本研究尽可能地纳入可以明确VI-RADS 评分及术后病理的全部病灶,其中肌层浸润性膀胱癌20 个,非肌层浸润性膀胱癌81个。
本研究中VI-RADS评分为1分和2分的病灶共64个,病理结果全部为非肌层浸润型膀胱癌(图2);评分为3 分的病灶18 个,其中16 个为非肌层浸润型膀胱癌(图3),2 个为肌层浸润型膀胱癌;评分为4分的病灶11个,除1个为非肌层浸润型膀胱癌外,其余均为肌层浸润型膀胱癌;评分为5 分的病灶8 个,全部为肌层浸润型膀胱癌(图4)。本研究结果显示:对于VI-RADS 评分为1分和2分的病灶,病灶为非肌层浸润的可能性接近100%;对于VI-RADS 评分为4分和5 分的病灶,病灶为肌层浸润的可能性也接近100%;对于VI-RADS 评分为3 分的病灶,大部分(16/18)为非肌层浸润,少数(2/18)为肌层浸润病灶。而在Wang 等[12]的研究中,VI-RADS 评分为3分的肿瘤,三分之二是肌层浸润型癌,三分之一是非肌层浸润型癌,这可能和本研究样本量较小有关,但同时也说明VI-RADS 评分为3 分时难以确定肿瘤的浸润深度。
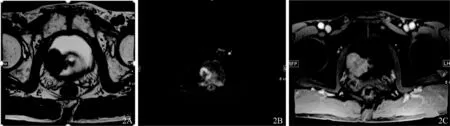
图2 膀胱非浸润性尿路上皮癌(68岁男性)A.轴位T2WI示膀胱右侧壁菜花样肿块突入膀胱腔内,肿块内见低信号的蒂,肌层低信号连续,T2WI评分2分;B.轴位DWI示病灶弥散受限,蒂呈低信号,DWI评分2分;C.DCE示增强早期固有肌层未见强化,增厚的内层早期强化,DCE评分2分。VI-RADS评分为2分。

图3 膀胱高级别尿路上皮癌(63岁男性)A.轴位T2WI示膀胱左侧壁宽基底占位,肌层可疑受侵,T2WI评分4分;B.轴位DWI示病灶弥散受限,膀胱肌层未见异常信号,DWI评分3分;C.DCE示增强早期内层强化,肌层未见早期强化且连续性未见中断,DCE评分3分。综上,VI-RADS评分为3分。D.病理示病灶累及黏膜下层,固有肌层未见癌侵犯(HE×40)。

图4 膀胱浸润性高级别尿路上皮癌(62岁男性)A.轴位T2WI示膀胱前壁肿块,局部肌层低信号连续性中断,T2WI评分4分;B.轴位DWI示病灶弥散受限,突破膀胱肌层,DWI评分4分;C.DCE示增强早期病灶及膀胱肌层强化DCE评分4分。综上,VI-RADS评分为4分。D.病理示膀胱浸润性高级别尿路上皮癌,突破深肌层(HE×40)。
本研究中仅1 个VI-RADS 评分4 分的病灶为非肌层浸润病灶,该病灶位于膀胱顶部,呈宽基底混合性生长,由于T2WI 上肌层低信号连续性中断,同时轴位DWI 并没有清楚的显示病灶底部与膀胱壁交界面的细节,可能影响该病灶的最终评分结果,因此,在今后的研究中,应采用轴面和矢状面、冠状面相结合的DWI序列。
本研究存在一些不足之处:第一,本研究的样本量较少,导致肌层浸润性膀胱癌和VI-RADS评分为3分的病灶数均较少,可能存在一定偏倚;VI-RADS评分为3 分提示肌层浸润的效能也有待进一步确定。第二,本研究为回顾性研究,存在一定程度的选择性偏倚。第三,本研究仅纳入首诊病例,VI-RADS 在复发组病例中的应用情况还有待研究。
总之,本研究结果表明,VI-RADS 对术前评估膀胱癌有无肌层浸润有较高的临床实用价值,有助于增强放射科医生和临床医生之间的沟通,未来仍需要大样本的前瞻性多中心研究以验证该结果,成像方案以及诊断标准仍需进一步完善。
