二氢吡啶酮的不对称催化合成进展
2021-05-17贺顺龙陈运荣
贺顺龙,李 飞,陈运荣
(1.辽宁石油化工大学 石油化工学院,辽宁 抚顺113001;2.上海科技大学 物质科学与技术学院,上海201210)
吡啶酮结构[1]广泛地存在于天然产物分子[2]和具有生理活性的药物分子中[3⁃5]。如通过对Rho激酶的抑制作用以调节血管平滑肌收缩的二氢吡啶酮衍生物[6](1),可用于治疗高血压和相关疾病。从铜绿微囊藻中提取出对丝氨酸蛋白酶胰蛋白酶、凝血酶、弹性蛋白酶和胰凝乳蛋白酶具有抑制活性的吡啶 酮 衍 生 物HH960(2)[7],以 及 受 体 拮 抗 剂P2X7(3)[8],可以对炎性、免疫、神经或肌肉骨骼疾病起作用。此外,通过对二氢吡啶酮还原可得哌啶酮,其常见于生物活性分子的核心结构。比如从海洋生物中提取的α⁃葡萄糖苷酶抑制剂舒尔西因(4)[9],在治疗B型肝炎方面显示出巨大的潜力,而诺吉霉素类似物已被批准用于治疗非胰岛素依赖型糖尿病。由于吡啶酮结构分子在多个领域的重要性,对发展其高效、多样性的合成方法具有重要意义,特别是实现具有光学活性的吡啶酮类分子合成的不对称催化方法具有更好的研究价值。其中,由于丰富的化学活性,手性二氢吡啶酮是合成手性吡啶酮衍生物的一个重要中间体(见图1),其不对称催化合成引起了化学家们的广泛关注,并且已取得了显著的进展。
对于具有六元环状结构的二氢吡啶酮的不对称催化合成,目前最为高效的合成策略是通过不对称环加成反应构建,包括不对称氮杂⁃Diels⁃Alder反应(简称氮杂⁃D⁃A反应)和[3+3]环加成反应等。其中,氮杂⁃D⁃A反应是合成氮杂六元环的最直接方法之一[10],该方法使用α,β⁃不饱和亚胺与烯醇等价物经历逆电子需求的狄尔斯⁃阿尔德反应即可合成二氢吡啶酮母核结构。近年来发展的多种不对称催化方法都应用于该反应中,实现手性二氢吡啶酮的高化学、区域和立体选择性合成。此外,手性氮杂⁃卡宾催化的烯胺与α,β⁃不饱和酰基化合物的不对称[3+3]环加成反应,作为不对称氮杂⁃D⁃A反应的很好补充,被应用于手性二氢吡啶酮的不对称催化合成 中[11⁃16]。
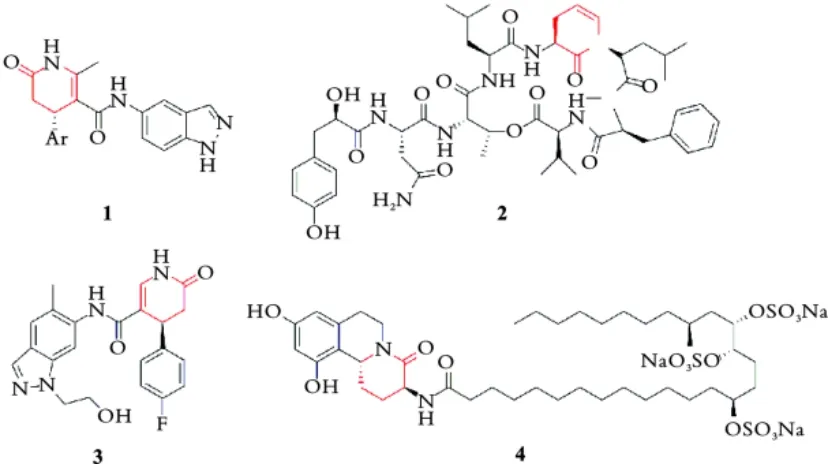
图1 含有手性(二氢)吡啶酮结构的天然产物以及具有生理活性的小分子Fig.1 Natural products containing chiral(dihydro)pyridone structure and bioactive molecular
1 不对称氮杂⁃D⁃A反应
富电子烯烃与α,β⁃不饱和亚胺(1⁃氮杂双烯)的反电子需求氮杂⁃D⁃A反应[17⁃18]是合成六元含氮杂环最为有效的方法,最早由D.L.Boger教授及其同事发展[19⁃21]。随后,不对称催化剂的反电子需求Hetero⁃Diels⁃Alder反应也被陆续发展并用于各类手性杂环化合物的不对称合成[22⁃26],其中不对称氮杂⁃D⁃A反应被广泛用于手性二氢吡啶酮类杂环化合物的手性合成。
1.1 手性NHC催化合成二氢吡啶酮
以廉价和无金属污染为特点,有机催化氮杂⁃D⁃A反应显示出独特的优势,而氮杂⁃环卡宾(NHC)也因易于合成且催化活性高被广泛研究,可用于各种醛、烯酮、酯、Michael受体和其他底物的反应,被证实是有效的有机催化剂。
2006年,J.W.Bode等[27]提出通过质子化捕获与催化剂结合的共轭Breslow中间体形成的烯醇或烯醇盐用于碳碳键构筑。利用这一策略实现了手性氮杂⁃环卡宾7催化的氮杂双烯5与α,β⁃不饱和醛6的高对映选择性氮杂⁃D⁃A反应,并以优异的非对映和对映选择性(以dr和ee简记)合成二氢吡啶酮8(见图2,图中百分数均为摩尔分数,下同)。
2011年,叶松课题组报道了烯酮9作为亲双烯体与1⁃氮杂双烯10在氮杂⁃环卡宾12催化下合成二氢吡啶酮11[28]。作者使用二取代基的烯酮作为底物,可以在环加成反应中构建一个手性季碳中心。研究发现,反应结束后,加入DME可以使反应以高的非对映选择性(dr>20∶1)得到反式产物,作者推测其可能的原因是产物在DME碳酸铯作用下使顺式产物异构成反式产物(见图3)。
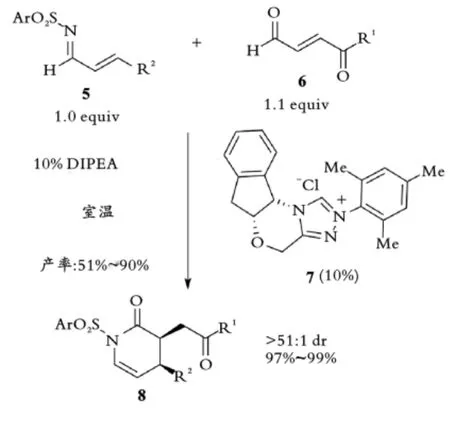
图2 Bode课题组手性NHC催化氮杂⁃D⁃A反应Fig.2 Bode,s chiral NHC catalyzed Aza⁃D⁃A reaction
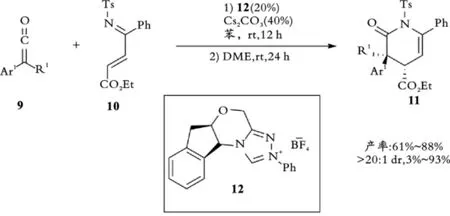
图3 叶松课题组手性NHC催化氮杂⁃D⁃A反应Fig.3 Ye,s enantioselective Aza⁃D⁃A reactions catalyzed by Chiral N⁃Heterocyclic Carbenes
2012年,叶松课题组在之前工作基础上通过使用手性NHC催化剂16催化α⁃氯代醛13作为亲双烯体代替烯酮与α,β⁃不饱和醛亚胺14发生不对称[4+2]环加成反应(见图4),合成了高度官能化的手性二氢吡啶酮产物15[29]。

图4 叶松课题组手性NHC催化α⁃氯醛与亚胺的氮杂⁃D⁃A反应Fig.4 Ye,s chiral NHC catalyzes the Aza⁃D⁃A reaction of α⁃chloroaldehyde and imine
2012年,Rovis教授课题组使用直链醛17作为底物,通过氮杂⁃环卡宾16催化生成烯醇化物,接着在氧化剂与碱的共同作用下产生烯醇负离子,与α,β⁃不饱和醛亚胺18发生不对称氮杂⁃D⁃A反应,高效构建手性二氢吡啶酮19[30](见图5)。
2013年,池永贵课题组应用三氮唑衍生的NHC催化剂25催化酯22与α,β⁃不饱和亚胺23发生不对称[4+2]环加成反应[31](见图6)。
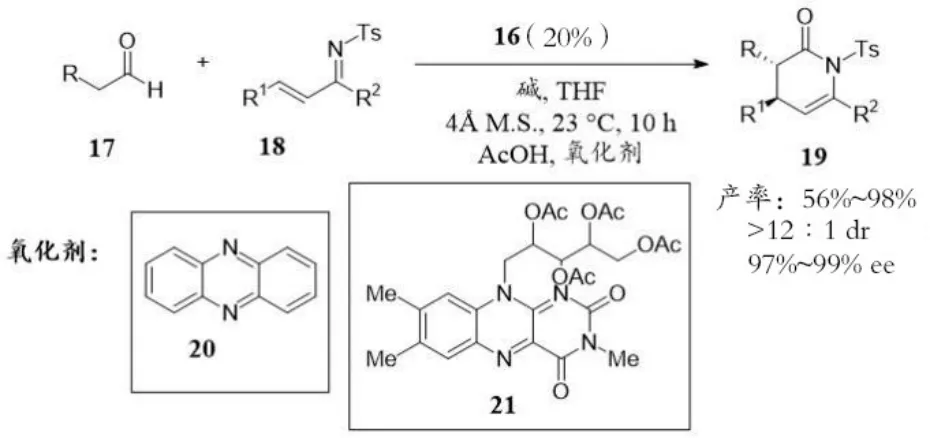
图5 Rovis课题组手性NHC催化氮杂⁃D⁃A反应Fig.5 Rovis,s chiral NHC catalyzes oxidative Aza⁃D–A reaction
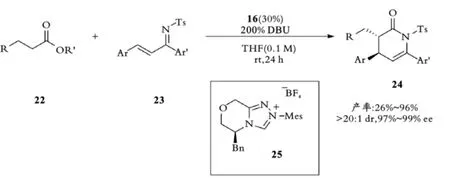
图6 池永贵课题组手性NHC催化氮杂⁃D⁃A反应Fig.6 Chi,s chiral NHC catalytic Aza⁃D⁃A reaction
2015年,叶松课题组选择α⁃氯代醛26与三氟甲基N⁃Boc氮杂双烯27在手性NHC催化下发生[4+2]环加成反应得到相应的3,4⁃二取代⁃6⁃三氟甲基二氢吡啶酮产物28[32]。2016年,叶松课题组使用类似的NHC催化剂催化α⁃氯代醛26与糖精衍生物29发生不对称[4+2]环加成反应[33](见图7)。
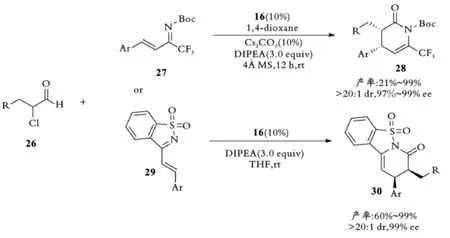
图7 手性NHC催化α⁃氯醛与不饱和亚胺的反应Fig.7 Chiral NHC catalytic reaction ofα⁃chloroaldehyde with unsaturated imines
2016年,赵宇课题组使用手性NHC催化剂16催化苯并呋喃衍生的N⁃Ts亚胺31与α⁃氯代醛的不对称[4+2]环加成反应[34]。该反应以较高的产率和对映选择性(对所有的底物均得到dr>20∶1,ee>99%的产物)得到顺式选择的苯并呋喃衍生的二氢吡啶酮产物,该反应的催化剂载量低至1%(摩尔分数)。作者使用脯氨酸衍生物36催化31与脂肪醛反应生成反式2⁃羟基哌啶衍生物34(见图8),证明手性胺催化和NHC催化的互补性。
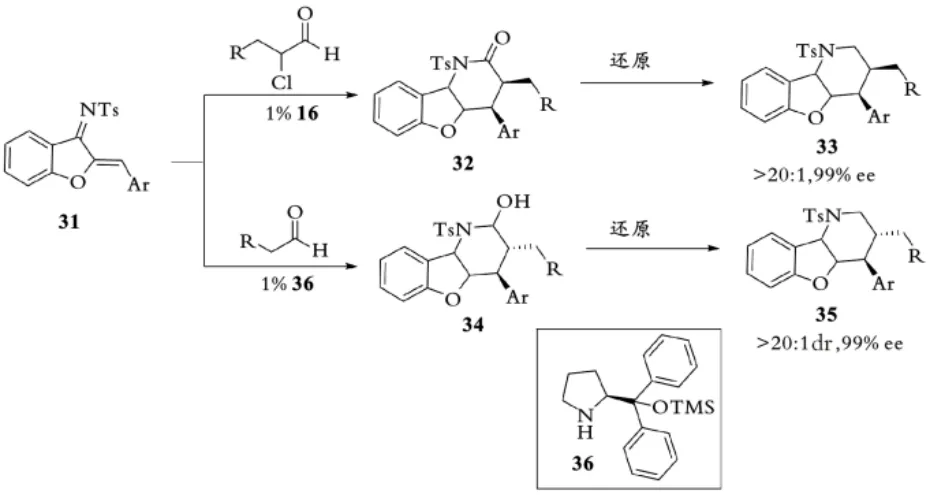
图8 赵宇课题组催化不对称合成哌啶衍生物Fig.8 Zhao,s catalyzed asymmetric synthesis of piperidine derivatives
1.2 手性二级胺催化不对称合成二氢吡啶酮
脯氨酸衍生物含有四氢吡咯结构,易与醛发生缩合产生亚胺,该亚胺发生异构可得到烯胺中间体,是很好的亲双烯体,适合用来进行反电子需求的Diels⁃Alder反应。2008年,陈应春课题组报道了α,β⁃不饱和N⁃Ts亚胺37与醛38的有机催化不对称反电子需求的氮杂⁃D⁃A反应[35](见图9)。
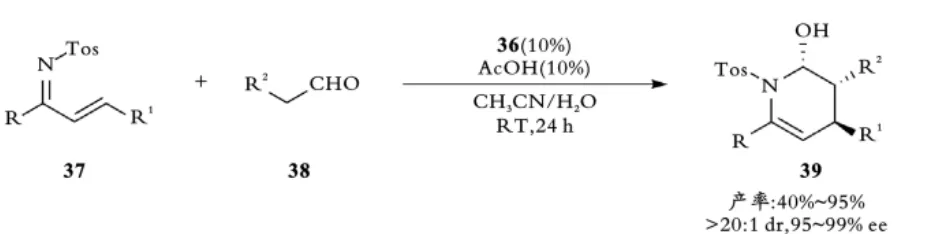
图9 陈应春课题组醛与不饱和亚胺的氮杂⁃D⁃A反应Fig.9 Chen,s Chiral amine catalyzed Aza⁃D⁃A reaction of aldehyde with unsaturated imine
1.3 手性异硫脲催化不对称合成二氢吡啶酮
2012年,Smith课题组以手性异硫脲衍生物43作为亲核催化剂,利用α⁃亚甲基羧酸40与α,β⁃不饱和亚胺41实现二氢吡啶酮42的合成(见图10)[36]。

图10 Smith课题组手性异硫脲催化羧酸与亚胺反应Fig.10 Smith,s chiral isothiourea catalytic carboxylic acid react with imine
2015年,Pericàs课题组利用固相催化的优势,将异硫脲催化剂51固定在苯并四甲醚聚合物上,使用流动技术将α,β⁃不饱和亚胺47与特定的羧酸48进行反应,高对映选择性合成二氢吡啶酮产物49,52[37](见图11)。
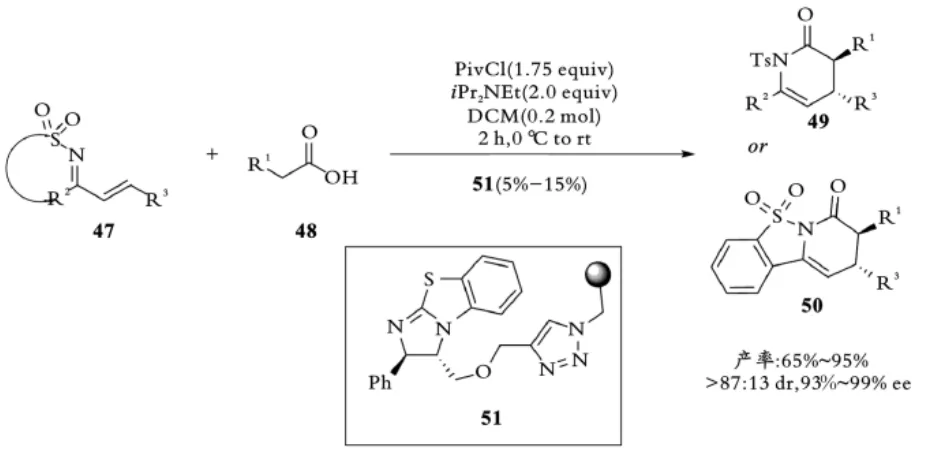
图11 Pericàs课题组聚乙烯负载催化剂催化亚胺与酸酐反应Fig.11 Pericàs,s polystyrene⁃supported catalysts catalyst imine with Acid anhydride
同年,Smith课题组扩大了手性异硫脲催化合成二氢吡啶酮的底物范围,利用衍生自α,β⁃不饱和γ⁃酮酸酯的α,β⁃不饱和酮亚胺53作为双烯体,与α⁃亚甲基羧酸52反应,以高对映选择性合成了一系列具有反式取代的二氢吡啶酮产物54(见图12)[38]。

图12 Smith课题组异硫脲介导的二氢吡啶酮的合成Fig.12 Smith,s isothiourea⁃mediated synthesis of dihydropyridinones
2016年,Smith课题组对先前报道的反应进行拓展,将α,β⁃不饱和磺酰亚胺变更为糖精衍生的不饱和亚胺56,并研究了该类底物在异硫脲催化下与直链羧酸55的氮杂⁃D⁃A反应[39],同样能够以较好的收率和高的对映选择性得到相应的三环稠合二氢吡啶酮57产物(见图13)。
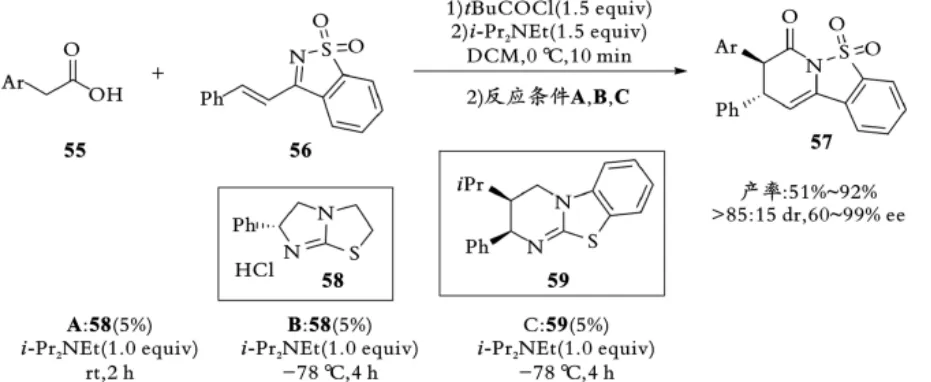
图13 Smith课题组异硫脲介导的二氢吡啶酮的合成Fig.13 Smith,s isothiourea⁃mediated synthesis of dihydropyridinones
同年,Smith课题组发现咪唑鎓在不被酸活化时接受亲核试剂的进攻是非常慢的,但当被酸活化后,可以容易接受亲核试剂的进攻[40]。他们利用这个特性设计出手性异硫脲盐酸盐43作为催化剂在平衡中与咪唑鎓作用并将其活化,同时游离出异硫脲亲核催化剂,该亲核催化剂立即与活化的咪唑鎓发生交换反应,进一步异构产生亲双烯体,进而与不饱和亚胺61发生高立体选择性氮杂⁃D⁃A反应(见图14)。
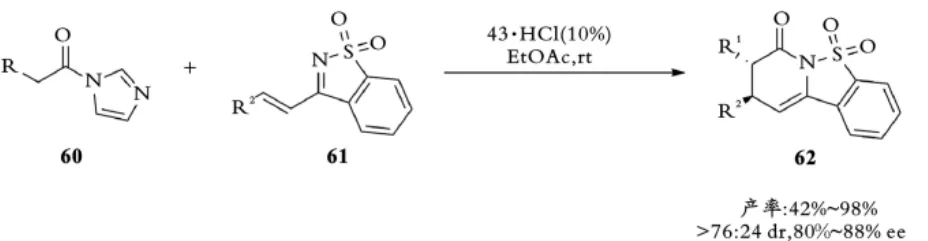
图14 Smith课题组手性异硫脲催化的二氢吡啶酮的合成Fig.14 Smith,s isothiourea⁃mediated synthesis of dihydropyridinones
1.4 手性磷酸催化不对称合成二氢吡啶酮
手性磷酸催化不对称合成二氢吡啶酮,可以利用酸性条件下现场生成的α,β⁃不饱和亚胺参与不对称氮杂⁃D⁃A反应,因此可以发展不对称多组分反应。2009年龚流柱课题组报道了手性磷酸67催化噁唑酮63、肉桂醛64和伯芳胺65参与的不对称三组分[4+2]环加成反应,以高非对映以及对映选择性合成3⁃氨基二氢吡啶酮66[41]。其中N⁃苯乙基取代的手性产物可在酸性条件下实现关环合成苯并[a]喹啉嗪(见图15)。
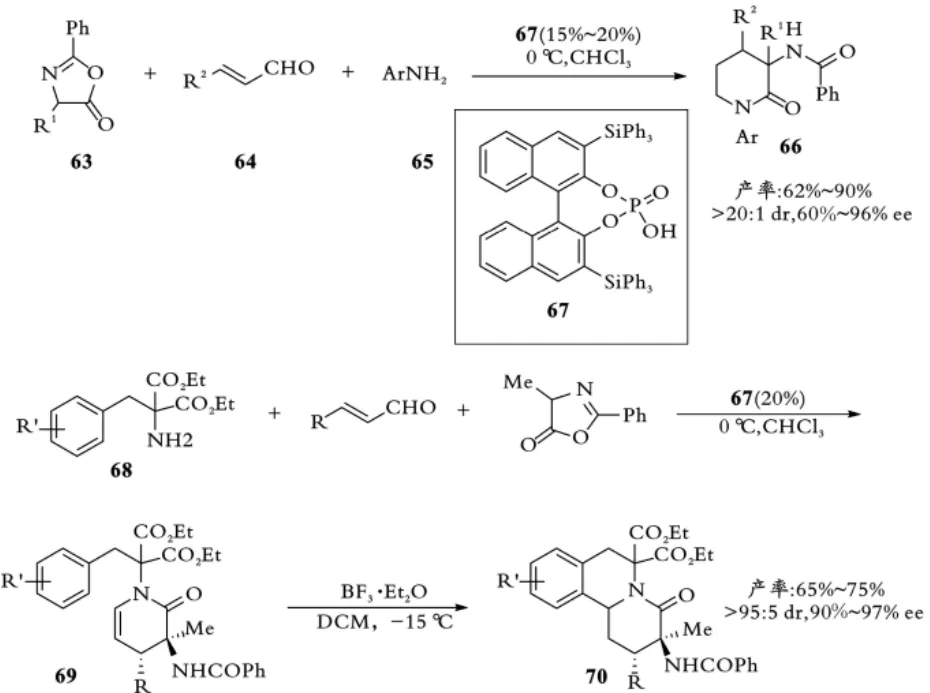
图15 龚流柱课题组手性磷酸催化三组分[4+2]环加成反应Fig.15 Gong,s asymmetric three⁃component[4+2]cycloaddition reaction by chiral phosphoric acid
2013年,Masson课题组报道了在手性磷酸催化剂74存在下的R3为具有吸电性酯基的α,β⁃不饱和亚胺71与烯酰胺72之间的不对称氮杂⁃D⁃A反应,高效合成手性二氢吡啶酮N,N⁃缩酮产物73[42](见图16)。
1.5 手性Lewis酸催化不对称合成二氢吡啶酮
2007年,Carretero课 题 组报道了镍与配体78组成的手性路易斯酸催化α,β⁃不饱和酮亚胺75与丙基乙烯基醚76的不对称反电子需求的Diels⁃Alder反应[43],以优异的内型非对映选择性和对映选择性合成顺式的哌啶衍生物77(见图17)。
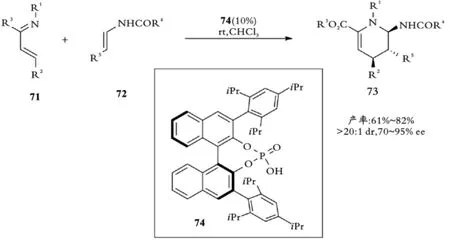
图16 Masson课题组手性磷酸催化氮杂⁃D⁃A反应Fig.16 Masson,s catalytic Aza⁃D⁃A reaction by chiral phosphoric acid

图17 Carretero课题组手性路易斯酸催化不对称Diels⁃Alder反应Fig.17 Carretero,s Chiral Lewis acid catalyzed asymmetric D⁃A reaction
1.6 其他催化剂催化不对称合成二氢吡啶酮
2012年,王锐课题组报道手性一级胺⁃硫脲催化剂82实现的环酮烯醇盐79与α,β⁃不饱和亚胺80不对称[4+2]环加成反应,以高非对映选择性和对映选择性合成具有螺环手性的二氢吡啶酮产物81[44](见图18)。
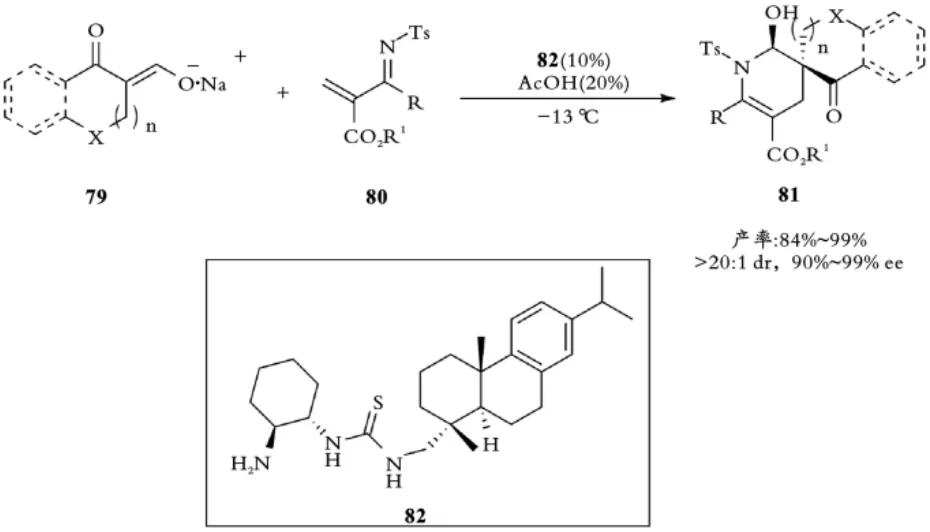
图18 王锐课题组手性双功能硫脲催化剂催化氮杂⁃D⁃A反应Fig.18 Wang,s Chiral bifunctional thiourea catalyzed Aza⁃D⁃A reaction
2019年,黄慧才课题组使用手性方酰胺催化剂86实现了α,β⁃不饱和N⁃Ts亚胺83与噁唑酮84的不对称[4+2]环加成反应,合成了一系列苯并呋喃稠合的二氢吡啶酮衍生物85[45]。该反应产率最高可达92%,dr>20∶1,ee可达99%(见图19)。
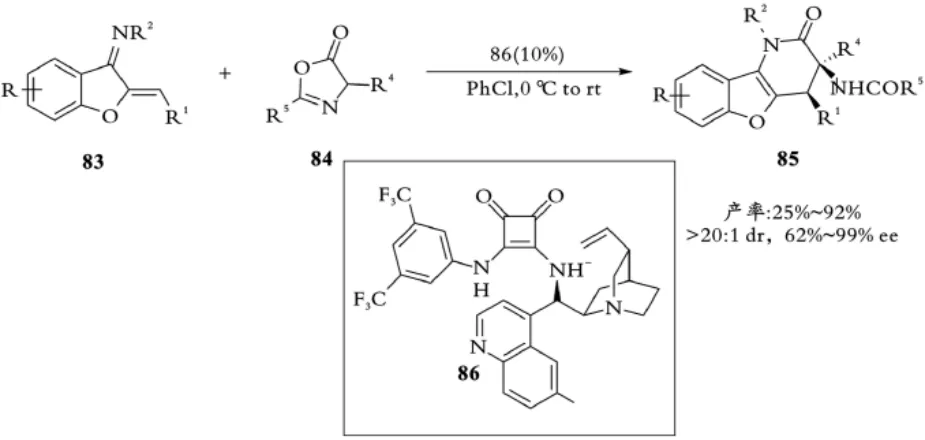
图19 黄慧才课题组亚胺与噁唑酮的不对称氮杂⁃D⁃A反应Fig.19 Huang,s Chiral squaramide catalyzed asymmetric Aza⁃D⁃A reaction of imine and oxazolone
2 不对称[3+3]环加成合成二氢吡啶酮
相比于不对称[4+2]环加成合成二氢吡啶酮,不对称[3+3]环加成面临着更多的挑战,目前报道的研究中的催化模式比较单一,大部分以手性NHC(氮杂⁃环卡宾)作为催化剂促进环化反应的进行,其基本反应模式是NHC催化剂活化各类底物,如2⁃溴代不饱和醛、不饱和酸和酯,以及不饱和醛与氧化剂的组合,生成α,β⁃不饱和酰基化合物,继而利用烯胺衍生物与该活泼中间体的[3+3]环加成反应实现二氢吡啶酮的不对称催化合成。
2013年,Biju课题组使用以三氮唑为母核的手性N⁃环卡宾催化剂7成功实现α⁃溴代⁃α,β⁃不饱和醛87与β⁃氨基⁃α,β⁃不饱和酮88的不对称[3+3]环加成反应,以高立体选择性合成二氢吡啶酮产物89[11]。该反应具有反应条件温和、催化剂负载量低以及官能团兼容性好等一系列优点(见图20)。
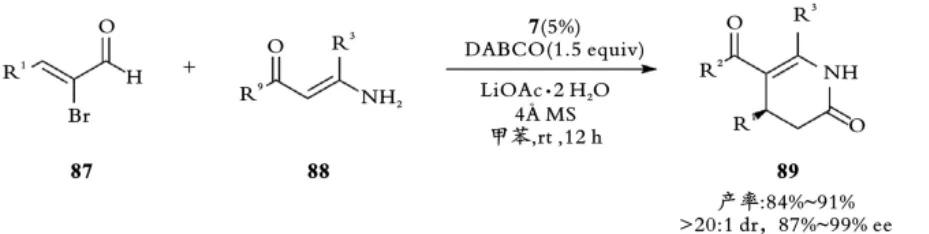
图20 Biju课题组手性NHC催化的不对称[3+3]环加成反应Fig.20 Biju,s Chiral NHC⁃catalyzed asymmetric[3+3]cycloaddition
2013年,池永贵课题组报道了手性氮杂⁃环卡宾16催化α,β⁃不饱和酯90与N⁃Ts亚胺91之间的不对称[3+3]环加成反应合成手性二氢吡啶酮92(见图21)。该方法可以使用空间要求高的β,β⁃二取代α,β⁃不饱和酯作为底物,从而实现光学富集的含有季碳立体中心二氢吡啶酮的不对称合成[46]。
2014年,叶松课题组用三氮唑衍生的手性NHC催化α⁃溴代丙烯醛93与内磺酰亚胺94的[3+3]环加成反应,以高收率和对映选择性得到三环稠合的手性二氢吡啶酮产物95[12](见图22)。
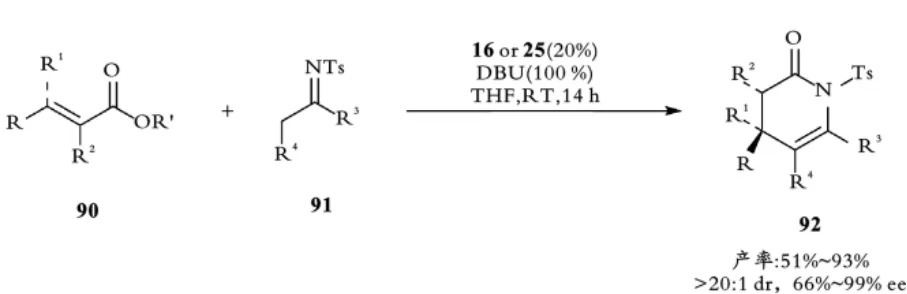
图21 池永贵课题组手性NHC催化α,β⁃不饱和酯与亚胺的不对称[3+3]环加成反应Fig.21 Chi,s Chiral NHC catalyzed the asymmetric[3+3]cycloaddition ofα,β⁃unsaturated esters with imines
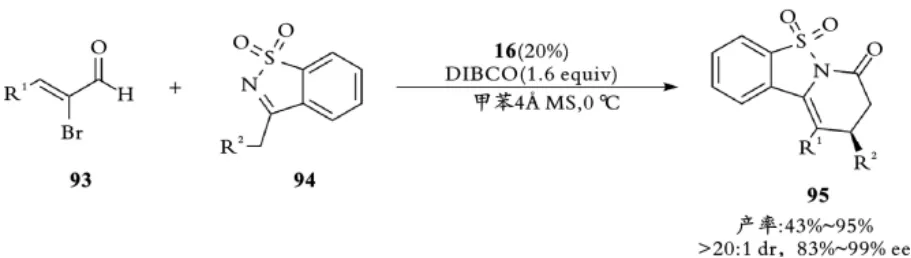
图22 叶松课题组手性NHC催化不饱和醛不对称[3+3]环加成反应Fig.22 Ye,s Chiral NHC⁃catalyzed asymmetric[3+3]cycloaddition of bromoenals
同年,他们利用环卡宾催化剂将α,β⁃不饱和羧酸96,99与内磺酰亚胺97,100在三甲基乙酰氯和N,N⁃二异丙基乙胺存在下实现不对称[3+3]环加成反应(见图23),以良好的产率和较好的对映选择性得到三环稠合二氢吡啶酮产物98,101[47]。
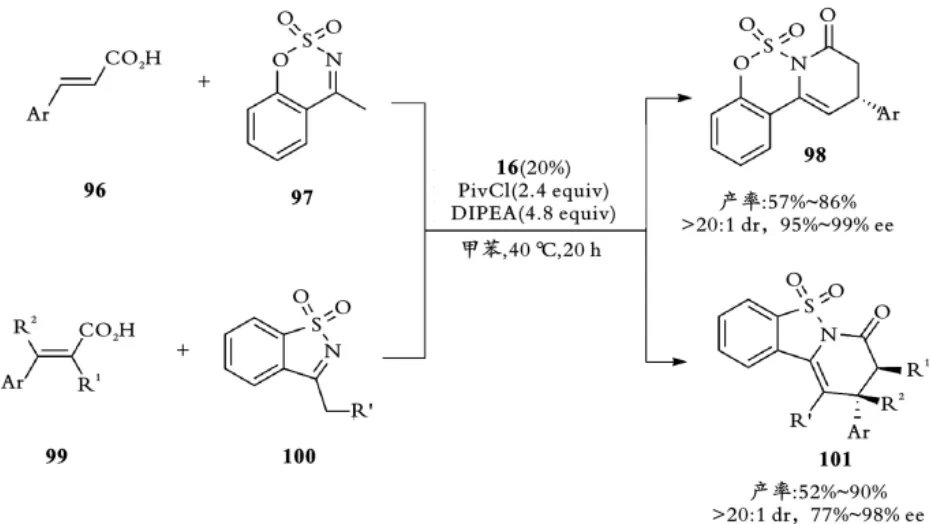
图23 叶松课题组手性NHC催化不饱和羧酸不对称[3+3]环加成反应Fig.23 Ye,s Chiral NHC⁃catalyzed asymmetric[3+3]cycloaddition ofα,β⁃unsaturated carboxylic acids
2015年,钟国富课题组开发了氮杂⁃环卡宾催化的N⁃羟基邻苯二甲酰亚胺(NHPI)取代的3,3⁃二取代丙烯酸酯和N⁃Ts酮亚胺的高对映选择性[3+3]环化反应[14]。反应中使用NHPI丙烯酸酯作为反应前体,提高反应活性的同时,也使得参与反应的原料变得容易制备。该反应在低当量催化剂催化以及室温条件就可以进行,以良好的产率和较高的对映选择性合成二氢吡啶酮产物。
3 其他反应
除以上的两类反应,还有一些其他催化不对称反应可以制备手性二氢吡啶酮,如池永贵课题组[48]和叶松课题组[49]报道的氮杂环卡宾催化的α,β⁃不饱和酯和羧酸与亚胺的[4+2]成环反应,Voituriez课题组报道的金催化的二炔分子内成环反应[50]。
4 结论
手性二氢吡啶酮是天然产物以及具有生理活性的小分子药物中常见的骨架,通过不对称催化的方法高效合成该类手性化合物吸引了众多有机化学家的兴趣,并在过去的十几年间取得了显著进展。目前,实现手性二氢吡啶酮不对称合成最有效方法是不对称环加成反应,包括不对称氮杂⁃D⁃A反应([4+2]环加成反应)和不对称[3+3]环加成反应。其中,对于不对称[4+2]环加成反应,一系列不同的不对称催化体系都可以应用其中,但是目前该方法使用的α,β⁃不饱和亚胺底物都局限于β⁃单取代类型,仅能在手性二氢吡啶酮4⁃位构建手性叔碳中心。而对于不对称[3+3]环加成反应,仅有手性NHC催化剂可应用于该反应之中,同时底物范围也较为受限。此外,目前被广泛研究的二氢吡啶酮大多为3,4⁃二氢吡啶酮,而对于另外两类3,6⁃二氢吡啶酮以及5,6⁃二氢吡啶酮的不对称催化研究还较为有限。期待有机化学家们将来发现更多新的反应类型、新的催化剂体系,可以克服以上难题,实现手性二氢吡啶酮产物的更高效、精准、多样化的不对称合成。
