微小RNA-146a靶向沉默三磷酸腺苷结合盒转运体A1调控THP-1巨噬细胞源性泡沫细胞胆固醇流出
2021-05-17幸世峰孙理华骆小梅
幸世峰,孙理华,骆小梅
动脉粥样硬化(atherosclerosis,AS)是影响人群健康的重大疾病。新疆是AS高发区域,故该地区的AS防控面临着严峻的挑战[1]。研究表明,AS是一种免疫介导的动脉管壁慢性炎症,其发病机制十分复杂[2]。血管壁炎症激活被认为是AS发生、发展的关键因素,其中巨噬细胞扮演着关键角色:一方面巨噬细胞来源的泡沫细胞是AS斑块脂质条纹期的标志;另一方面,巨噬细胞来源的泡沫细胞在各种促炎因子的刺激下,可分泌大量促炎因子、趋化因子及其他因子,进一步加剧斑块内巨噬细胞聚集、脂质蓄积和基质降解[3]。因此,抑制巨噬细胞脂质蓄积(泡沫化)和炎症因子释放是防治AS的重要途径[4]。
巨噬细胞胆固醇代谢稳态失衡是泡沫细胞形成过程中的主要特征。胆固醇流出对减少细胞内胆固醇蓄积、抑制泡沫细胞形成和防治AS发生具有重要意义[5]。三磷酸腺苷结合盒转运体A1(ATP-binding cassette transporter A1,ABCA1)等膜蛋白是以三磷酸腺苷(ATP)为能源,将细胞内游离胆固醇转运到细胞膜表面,能有效减少细胞内的胆固醇蓄积。而ABCA1又受多种因子调节,其中核因子-κB(nuclear factorκB,NF-κB)信号通路是其最重要的调节途径。在AS部位和纤维斑块部位均发现了激活的 NF-κB,而正常血管很少或没有表达NF-κB,证实NF-κB在AS的发生、发展过程中起重要作用。既往研究发现,AS越严重,则微小RNA(miR)-146a表达水平越高,说明miR-146a表达调控与AS发生存在因果关系[6]。miR-146a是miR-146家族一员,是先天性和适应性免疫中细胞分化和细胞功能的重要调节剂,其受到脂多糖(lipopolysaccharide,LPS)刺激后可通过抑制NF-κB依赖性的两种衔接蛋白——IL-1受体相关激酶1(IL-1 receptor-associated kinase 1,IRAK-1)和TNF受体相关因子 6(TNF receptor related factor 6,TRAF6)而在巨噬细胞中起到炎症制动作用[7]。但泡沫细胞miR-146a表达上调是否对ABCA1表达有抑制作用及是否导致胆固醇逆向转运减少而参与AS形成的发病机制目前尚不清楚。本研究拟通过使用miR-146a mimics及miR-146a inhibits转染THP-1巨噬细胞源性泡沫细胞,观察miR-146a对THP-1巨噬细胞源性泡沫细胞胆固醇流出和ABCA1表达的影响,以探讨miR-146a在AS发生发展中的作用机制,以期为AS的防治提供新的思路。
1 材料与方法
1.1 THP-1细胞培养及巨噬细胞源性泡沫细胞模型建立 本次实验时间为2018年12月—2020年6月。将THP-1细胞(人单核细胞株)放置在含10 mmol/L HEPES、10%胎牛血清、青霉素、链霉素的RPMI-1640细胞培养液中,在37 ℃、5% CO2培养箱中静置培养。待细胞到达对数生长期时(培养24~36 h),采用完全培养基调整细胞浓度为5×105个/孔并接种于6孔板中,加入含终浓度为100 ng/ml的佛波酯(phorbol 12-myristate 13-acetate,PMA)的基础培养基2 ml。培养24 h后观察细胞贴壁、形态变化并拍照。THP-1细胞呈单个圆形悬浮,密度约为5×106/ml,分布均匀,折光度较好。经PMA诱导后单个圆形、悬浮细胞逐渐形成梭形或不规则形状,并有伪足形成的贴壁细胞,即分化为巨噬细胞(见图1)。再采用含50 μg/ml氧化型低密度脂蛋白(oxidized low-density lipoprotein,ox-LDL)的无血清培养基培养48 h,使其吞噬脂质形成巨噬细胞源性泡沫细胞。

图1 PMA诱导THP-1细胞分化前后Figure 1 Before and after differentiation of THP-1 cells induced by PMA
1.2 胆固醇流出检测方法 将巨噬细胞源性泡沫细胞分为空白对照组,培养液中不加任何其他试剂;阳性对照组,培养液中加入10 μmol/L肝X受体激动剂T0901317;阴性对照组,培养液中加入100 nmol/L ABCA1小干扰RNA(siRNA);模拟物组,培养液中加入40 nmol/L miR-146a mimics;抑制剂组,培养液中加入40 nmol/L miR-146a inhibits。采用液体闪烁计数法检测胆固醇流出效率:THP-1细胞经PMA诱导分化为巨噬细胞后,加入3H标记的胆固醇(0.5 μCi/ml)共同孵育、标记24 h,后采用RPMI 1640培养液再培养24 h。采用液体闪烁液裂解细胞,收集培养液和裂解的细胞中3H标记的胆固醇含量,并以每分钟流出计数(counts per minute,CPM)表示。胆固醇流出效率=细胞内CPM/(细胞内CPM+培养液中CPM)×100%。
1.3 Annexin V-FITC/PI双染流式细胞术 将巨噬细胞源性泡沫细胞以1×106的密度接种于培养瓶内,汇合度达到80%后分别转染miR-146a mimics(模拟物组)、miR-146a inhibits(抑制剂组)及In-NC(NC组)。48~72 h 后采用胰酶消化收集细胞,固定,采用Annexin V-APC和7-AAD(江苏凯基生物技术股份有限公司)双染细胞。37 ℃温浴30 min后,应用流式细胞仪检测细胞凋亡情况。0.25%胰蛋白酶消化贴壁细胞,离心5 min,去胰蛋白酶。采用稀释缓冲液重悬细胞,调节细胞悬液浓度至5×105个/ml。取195 μl细胞悬液,加入5 μl Annexin V-FITC混合,室温下反应。加入10 μl碘化丙啶(PI,20μg/ml),反应10 min后上机检测各细胞水平。
1.4 实时荧光定量反转录聚合酶链式反应(RT-PCR)将巨噬细胞源性泡沫细胞分别以5×105个/孔接种到6孔板并培养至生长对数期,按照要求分别加入In-NC(NC组)、miR-146a mimics(模拟物组)、miR-146a inhibits(抑制剂组)、miR-146a mimics+ NF-κB抑制剂(模拟物+PDTC组)、miR-146a inhibits+NF-κB抑制剂(抑制剂+PDTC组),然后经Li-pofectamine 2000转染试剂瞬时转染至细胞中,转染24 h后加入Trizol消化各组细胞,按照TRIzol Reagent(Invitrogen公司,USA)说明书提取总RNA,紫外分光光度计测定其浓度和纯度。采用TransScript® One-Step RT-PCR和TransScript® miRNA First-Strand cDNA Synthesis(北京全式金生物工程有限公司)试剂盒进行反转录反应,严格按照试剂盒说明书进行操作。再行荧光定量PCR扩增基因片段,反应条件:95 ℃预变性20 s;95 ℃变性 10 s,60 ℃退火20 s,70 ℃延伸10 s,共45个循环。以β-actin作为内参,采用2-ΔΔCt法计算NF-κB通路p65、p50及ABCA1的mRNA相对表达量,引物序列见表1。
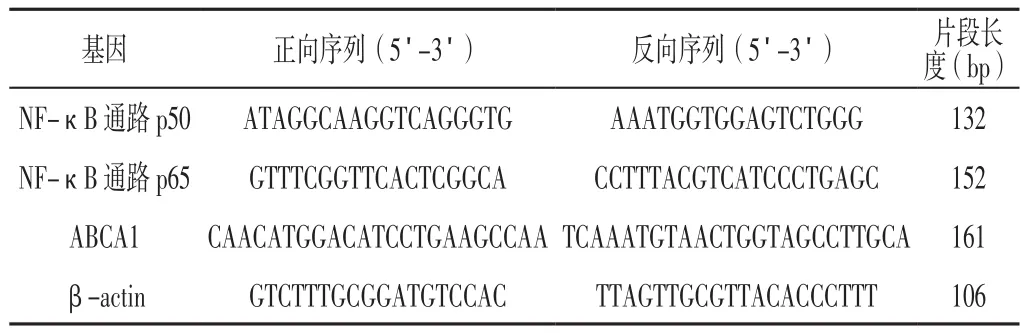
表1 引物序列Table 1 Primer sequence
1.5 Western blotting法 巨噬细胞源性泡沫细胞转染48 h后采用含0.1% PMSF的RIPA裂解液消化、收集各组细胞,提取细胞蛋白,采用BCA法测定蛋白浓度。每组取50 μg蛋白进行SDS-PAGE电泳。将蛋白电转移到聚偏二氟乙烯(PVDF)膜上,5%脱脂奶粉4 ℃封闭过夜。使用ABCA1、NF-κB和β-actin一抗(1∶500稀释),4 ℃孵育过夜;再加入标记IRDye800的二抗(1∶2 000在PBS中稀释),4 ℃孵育过夜。采用TBST洗涤后,红外荧光成像系统(Rockland)扫描分析NF-κB通路p65、p50及ABCA1的蛋白相对表达量。
1.6 3'UTR荧光素酶报告基因检测 通过RT-PCR从巨噬细胞源性泡沫细胞RNA中扩增ABCA1 3'UTR片段,并定向克隆到psiCHECKTM-2载体(Promega)中的海肾荧光素酶开放阅读框的下游,该载体还包含组成型表达的萤火虫荧光素酶基因。通过Target Scan(http://www.targetscan.org/vert_72/)在线软件预测得出,人的ABCA1 3'UTR具有两个miR-146a结合位点:位点2在物种之间高度保守,位点1仅在人类和灵长类动物中保守,见图2。为了评估miR-146a对人ABCA1 3'UTR的影响,本研究使用了报告基因表达质粒与miR-146a共转染的293T细胞,并分别转染阴性对照模拟物——Con-miR(Con-miR组)及不同浓度(10 nmol/L和20 nmol/L)miR-146a(10 nmol/L miR-146a组和20 nmol/L miR-146a组)。之后使用Multisite-Quickchange(Stratagene公司)在ABCA1的3'UTR内预测miR-146a位点的区域中进行定点突变,构建两个位点的突变载体(SDM1和SDM2),并通过测序确认所构建载体序列的准确性。将野生型(WT)3'UTR荧光素酶报告载体分别用Li-pofectamine 2000转染试剂转染Con-miR(WT+Con-miR组)和miR-146a(WT+miR-146a组),将1 μg的SDM1和/或SDM2 3'UTR荧光素酶报告载体分别用Li-pofectamine 2000转染试剂转染miR-146a(分为 SDM1+miR-146a组、SDM2+miR-146a组、SDM1/SDM2+miR-146a组)。使用Dual-Glo萤光素酶测定系统(Promega)测量萤光素酶活性,将海肾荧光素酶活性标准化为相应的萤火虫荧光素酶活性。
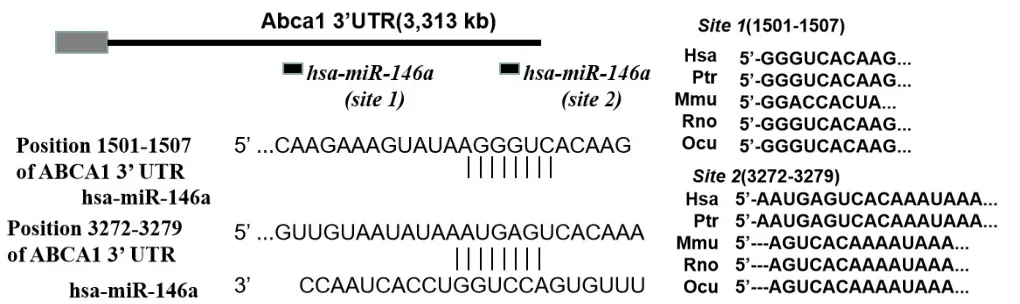
图2 miR-146a与ABCA1 3'UTR结合情况Figure 2 Predicted annealing of miR-146a to the ABCA1 3'UTR
1.7 统计学方法 采用SPSS 20.0统计学软件进行数据处理。上述实验数据均独立重复4次,符合正态分布的实验数据以(±s)表示,多组间比较采用单因素方差分析,组间两两比较采用LSD-t检验。以P<0.05为差异有统计学意义。
2 结果
2.1 miR-146a对巨噬细胞源性泡沫细胞胆固醇流出效率的影响 空白对照组胆固醇流出效率为(21.38±8.94)%,阳性对照组为(58.63±7.31)%,阴性对照组为(14.55±5.72)%,模拟物组为(17.08±4.13)%,抑制剂组为(56.03±5.88)%。五组胆固醇流出效率比较,差异有统计学意义(F=8.43,P=0.02);阳性对照组胆固醇流出效率高于空白对照组,阴性对照组和模拟物组胆固醇流出效率低于阳性对照组,抑制剂组胆固醇流出效率高于空白对照组、阴性对照组和模拟物组,差异有统计学意义(P<0.05)。
2.2 miR-146a对巨噬细胞源性泡沫细胞生物学行为的影响 各组正常细胞、坏死细胞、晚期凋亡细胞、早期凋亡细胞水平比较,差异有统计学意义(P<0.05);模拟物组正常细胞水平低于NC组,抑制剂组正常细胞水平高于NC组和模拟物组,差异有统计学意义(P<0.05);模拟物组坏死细胞、晚期凋亡细胞、早期凋亡细胞水平高于NC组,抑制剂组坏死细胞、晚期凋亡细胞、早期凋亡细胞水平低于NC组和模拟物组,差异有统计学意义(P<0.05),见表2、图3。
表2 三组正常细胞、坏死细胞、凋亡细胞水平比较(±s,%,n=4)Table 2 Comparison of levels of normal cells,necrotic cells and apoptotic cells among the three groups
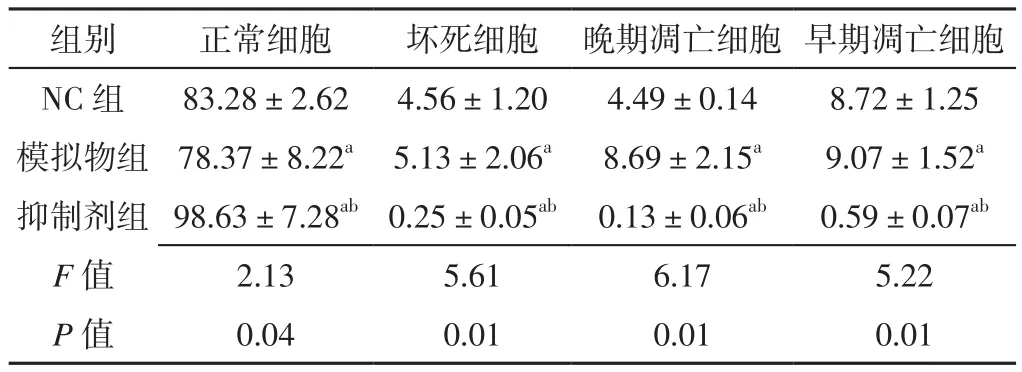
表2 三组正常细胞、坏死细胞、凋亡细胞水平比较(±s,%,n=4)Table 2 Comparison of levels of normal cells,necrotic cells and apoptotic cells among the three groups
注:与NC组比较,aP<0.05;与模拟物组比较,bP<0.05
组别 正常细胞 坏死细胞 晚期凋亡细胞 早期凋亡细胞NC 组 83.28±2.62 4.56±1.20 4.49±0.14 8.72±1.25模拟物组 78.37±8.22a 5.13±2.06a 8.69±2.15a 9.07±1.52a抑制剂组 98.63±7.28ab0.25±0.05ab 0.13±0.06ab 0.59±0.07ab F值 2.13 5.61 6.17 5.22 P值 0.04 0.01 0.01 0.01
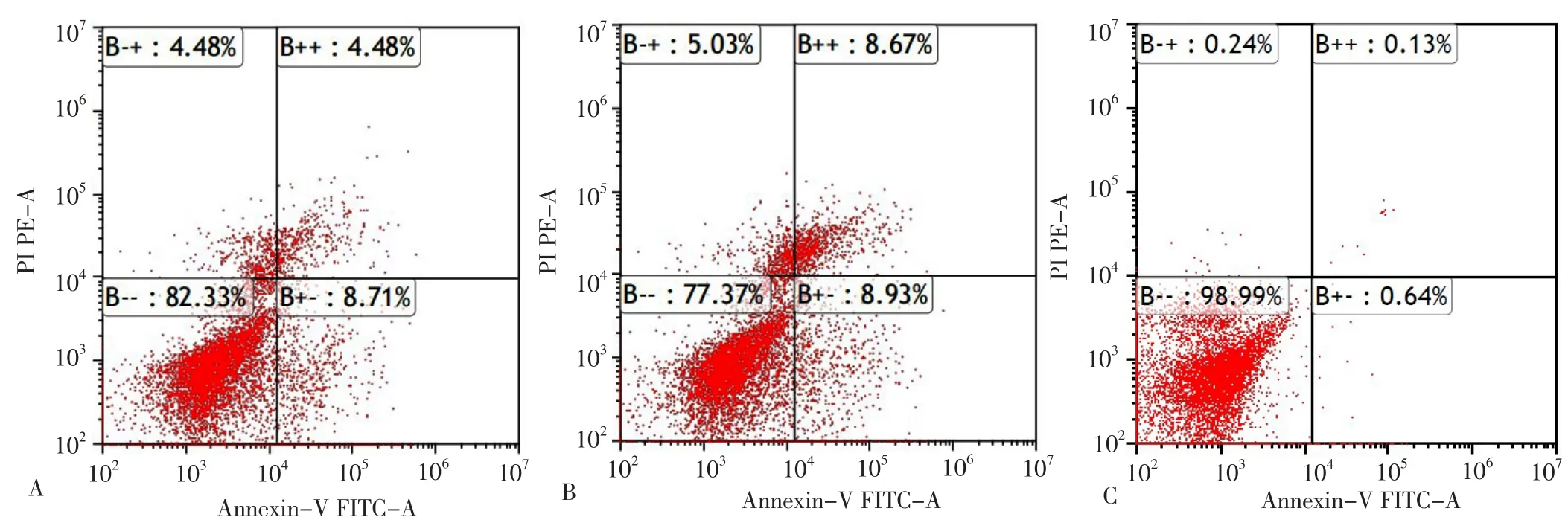
图3 Annexin V-FITC/PI双染流式细胞术检测巨噬细胞源性泡沫细胞凋亡情况Figure 3 Apoptosis of macrophage-derived foam cells by Annexin V-FITC/PI double staining flow cytometry
2.3 抑制NF-κB通路对miR-146a及ABCA1表达的影响各组NF-κB通路p50、p65及 ABCA1的mRNA、蛋白相对表达量比较,差异有统计学意义(P< 0.05);模拟物组NF-κB通路p50、p65的mRNA、蛋白相对表达量高于NC组,ABCA1的mRNA、蛋白相对表达量低于NC组,差异有统计学意义(P<0.05);模拟物+PDTC组NF-κB通路p50、p65的mRNA、蛋白相对表达量低于模拟物组,ABCA1的mRNA、蛋白相对表达量高于模拟物组,差异有统计学意义(P<0.05)。抑制剂组NF-κB通路p50、p65的mRNA、蛋白相对表达量低于NC组,ABCA1的mRNA、蛋白相对表达量高于NC组,差异有统计学意义(P<0.05);抑制剂+PDTC组NF-κB通路p50、p65的mRNA、蛋白相对表达量高于抑制剂组,ABCA1的mRNA、蛋白相对表达量低于抑制剂组,差异有统计学意义(P<0.05),见表3。
表3 各组NF-κB通路p50、NF-κB通路p65、ABCA1的mRNA、蛋白相对表达量比较(±s,n=4)Table 3 Comparison of the mRNA and protein relative expression levels of NF-κB pathway p50,NF-κB pathway p65 and ABCA1 in each group
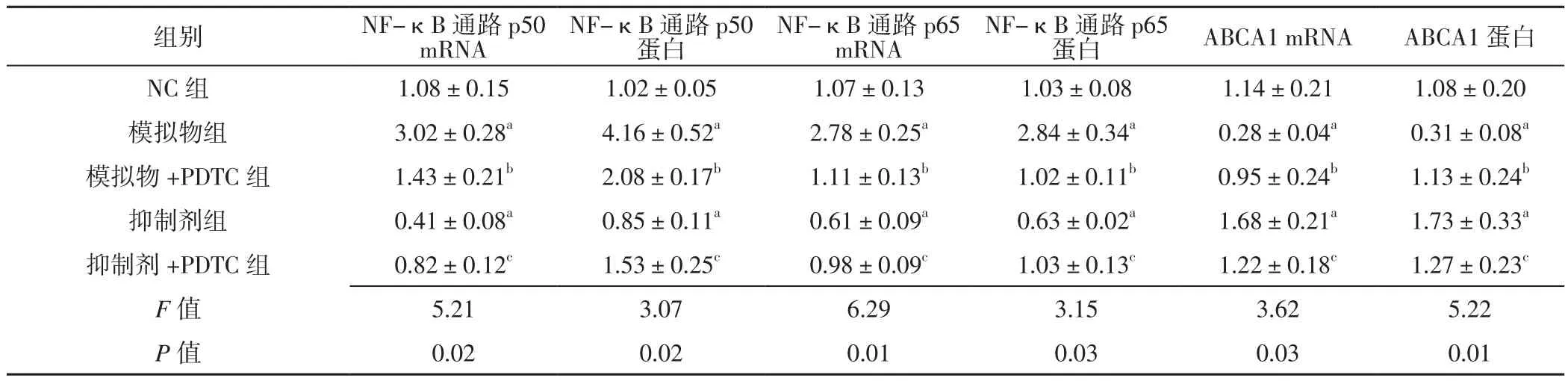
表3 各组NF-κB通路p50、NF-κB通路p65、ABCA1的mRNA、蛋白相对表达量比较(±s,n=4)Table 3 Comparison of the mRNA and protein relative expression levels of NF-κB pathway p50,NF-κB pathway p65 and ABCA1 in each group
注:与NC组比较,aP<0.05;与模拟物组比较,bP<0.05;与抑制剂组比较,cP<0.05
mRNANF-κB通路p50蛋白NF-κB通路p65 mRNANF-κB通路p65蛋白ABCA1 mRNAABCA1蛋白NC 组 1.08±0.15 1.02±0.05 1.07±0.13 1.03±0.08 1.14±0.21 1.08±0.20模拟物组 3.02±0.28a 4.16±0.52a 2.78±0.25a 2.84±0.34a 0.28±0.04a 0.31±0.08a模拟物 +PDTC 组 1.43±0.21b 2.08±0.17b 1.11±0.13b 1.02±0.11b 0.95±0.24b 1.13±0.24b抑制剂组 0.41±0.08a 0.85±0.11a 0.61±0.09a 0.63±0.02a 1.68±0.21a 1.73±0.33a抑制剂 +PDTC 组 0.82±0.12c 1.53±0.25c 0.98±0.09c 1.03±0.13c 1.22±0.18c 1.27±0.23c F值 5.21 3.07 6.29 3.15 3.62 5.22 P值 0.02 0.02 0.01 0.03 0.03 0.01组别 NF-κB通路p50
2.4 miR-146a靶向结合ABCA1 3'UTR情况 Con-miR组ABCA1 3'UTR活性为(100.18±6.12),10 nmol/L miR-146a组 为(53.27±10.18),20 nmol/L miR-146a组为(60.18±8.37);三组ABCA1 3'UTR活性比较,差异有统计学意义(F=5.16,P=0.030);10 nmol/L miR-146a组和20 nmol/L miR-146a组ABCA1 3'UTR活性低于Con-miR组,20 nmol/L miR-146a组ABCA1 3'UTR活性低于10 nmol/L miR-146a组,差异有统计学意义(P<0.05)。WT+Con-miR组ABCA1 3'UTR活性为(100.03±5.28),WT+miR-146a组为(70.18±8.33),SDM1+miR-146a组 为(82.37±11.27),SDM2+miR-146a组为(117.35±6.58),SDM1/SMD2+miR-146a组为(124.10±9.57);各组ABCA1 3'UTR活性比较,差异有统计学意义(F=6.52,P=0.01);WT+miR-146a组和SDM1+miR-146a组ABCA1 3'UTR活性低于WT+Con-miR组,差异有统计学意义(P<0.05);SDM2+miR-146a组和SDM1/SMD2+miR-146a组ABCA1 3'UTR活性与WT+Con-miR组比较,差异无统计学意义(P>0.05)。
3 讨论
细胞胆固醇水平的调控包括胆固醇摄取、内源性合成和外排之间的平衡。既往研究表明,脂质稳态紊乱可导致多种疾病,包括AS、代谢综合征、2型糖尿病及阿尔茨海默病等[8]。巨噬细胞胆固醇代谢稳态失衡贯穿泡沫细胞形成的整个过程,而胆固醇流出是调节巨噬细胞胆固醇动态平衡的关键环节,对减少细胞内胆固醇蓄积、防止泡沫细胞形成和AS发生具有重要意义。研究表明,抑制巨噬细胞脂质蓄积(泡沫化)和炎症因子释放是防治AS的重要途径[4,9]。本研究通过ox-LDL诱导巨噬细胞形成泡沫细胞,为后续实验研究提供了基础。
研究表明,高密度脂蛋白(high density lipoprotein,HDL)及其主要载脂蛋白A1(apolipoprotein A1,ApoA1)在去除细胞中多余胆固醇及其向肝脏运输过程中起关键作用,这一过程称为胆固醇逆向运输[10]。当多余的胆固醇来自动脉斑块中的泡沫细胞时,胆固醇逆向运输被认为是HDL抗AS的基础[11]。ABCA1和ATP结合盒转运蛋白G1(ABCG1)可促进胆固醇从包括巨噬细胞在内的外周细胞中流出,此外ABCA1还负责启动肝脏中的HDL形成,如Tangier病(一种以血浆HDL较低为特征的疾病)的发生与ABCA1基因突变密切相关[12]。miR-146a是一个典型的多功能miR,可在其下游基因的介导下参与免疫、炎症、肿瘤等多种生理病理过程[13-15]。研究发现,动脉硬化病变越严重,miR-146a表达水平越高[7]。但泡沫细胞中miR-146a与ABCA1的关系尚不清楚。本研究结果表明,miR-146a可通过抑制ABCA1表达而抑制其介导的胆固醇流出。
本研究进一步分析了miR-146a对巨噬细胞源性泡沫细胞生物学行为的影响,结果发现miR-146a mimics促进了巨噬细胞源性泡沫细胞的凋亡,提示miR-146a对巨噬细胞源性泡沫细胞的生物学进展具有重要调控作用。研究发现,NF-κB是miR-146a参与AS的最重要信号通路之一,其在LPS、肿瘤坏死因子α(tumor necrosis factor α,TNF-α)、白介素1β(interleukin 1β,IL-1β)诱导的miR-146a转录过程中起关键作用[16]。本研究结果显示,模拟物+PDTC组NF-κB通路p50、p65的mRNA、蛋白相对表达量低于模拟物组,ABCA1的mRNA、蛋白相对表达量高于模拟物组;抑制剂+PDTC组NF-κB通路p50、p65的mRNA、蛋白相对表达量低于抑制剂组,ABCA1的mRNA、蛋白相对表达量高于抑制剂组,提示miR-146a对NF-κB存在依赖性。
研究证实,ABCA1的3'UTR长于其他与AS相关的基因,是多个miR的靶标[17]。如miR-122能靶向沉默ABCA1,在小鼠和非人类的灵长类动物中的沉默降低了胆固醇的合成及肝脏脂肪酸、血浆胆固醇水平,并增加肝脏脂肪酸β-氧化[18-19]。与miR-122相反,miR-758在不同组织和细胞类型中广泛表达,其对ABCA1的作用影响了细胞胆固醇稳态[20]。本研究结果发现,ABCA1 3'UTR具有两个miR-146a结合位点,其中1个位点消除了miR-146a对ABCA1 3' UTR活性的抑制作用。
综上所述,miR-146a可通过抑制ABCA1表达而抑制巨噬细胞源性泡沫细胞胆固醇流出,从而导致AS发生发展,而NF-κB可以减轻miR-146a对ABCA1表达的抑制作用。后续应研究miR-146a的有效调控方法,进而为防止脂质在血管壁蓄积及治疗AS提供新的靶点。
作者贡献:幸世峰和骆小梅进行文章的构思与设计;孙理华进行研究的实施与可行性分析,数据收集、整理、分析,论文的修订;幸世峰进行结果分析与解释,撰写论文;骆小梅负责文章的质量控制及审校,并对文章整体负责、监督管理。
本文无利益冲突。
