METTL3-m6A途径抑制肺动脉平滑肌细胞增殖的实验研究
2021-05-17陈悦唐竞桐罗仕蓉
陈悦,唐竞桐,罗仕蓉
遵义医药高等专科学校,贵州 遵义 563006
肺动脉高压(pulmonary artery hypertension,PAH)指以肺动脉压力和肺血管阻力增高等血流动力学紊乱为主要临床特征的一系列临床症候群,目前已成为一个国际性的医疗保健难题[1]。PAH疾病进展的关键病理特征为肺血管重塑。肺动脉平滑肌细胞(pulmonary artery smooth muscle cells,PASMCs)作为调控血管舒缩功能的关键,在PAH 的重塑过程中被激活,诱发PASMCs 的异常恶性增殖并刺激细胞的持续收缩,导致肺动脉血管壁增厚和管腔狭窄,最终引发肺血管压力和阻力升高及右室负荷增加[2-3]。因此,如何靶向调控PASMCs 的恶性增殖能力抑制肺血管重塑是PAH当前的重要研究前沿[4]。
6-甲基腺苷(N6-methyladine,m6A)作为中心法则中RNA转录后修饰的重要环节,是指在RNA腺嘌呤上第6 号位氮原子上加入或去除甲基团修饰的过程[5]。新近研究表明RNA 的转录后表观调控方式可调控RNA 的转录后代谢全过程,包括对RNA 的转录后剪切出核[6]、稳定性[7]、降解及翻译[8]等。m6A受到多种促甲基化、去甲基化以及甲基化识别蛋白的动态调控。其中,甲基转移样酶3 (methyltransferase like 3,METTL3)作为促进m6A修饰的甲基转移酶复合物核心,可促进RNA 的m6A 修饰介导RNA 的转录后代谢,参与多种疾病的病理过程。
METTL3 在多种肿瘤组织中可引发异常m6A 修饰促进包括胃癌细胞[9]、结直肠癌细胞[10]在内的多种肿瘤细胞增殖效应。然而,METTL3介导的RNA甲基化修饰m6A 是否对于PAH 中PASMCs 的异常增殖功能是否具有调控作用尚不清楚。鉴于PAH 进展过程中PASMCs呈“肿瘤样”细胞增殖改变促进肺血管重塑过程。本研究拟探索参与m6A 修饰的关键促甲基化转移酶METTL3 是否参与PASMCs 的增殖调控功能,明确METTL3 依赖的m6A 修饰是否参与PASMCs 的增殖调控中,为靶向RNA 表观转录后修饰机制在PAH治疗中提供潜在的干预方式。
1 材料与方法
1.1 主要材料 6~8 周龄SD 大鼠共20 只(购置于重庆腾鑫生物技术有限公司)、DMEM 培养液(Gibco,11995115)、FBS (MRC,CCS30009.02)、DTT(Roche,10197777001)、Ⅰ型胶原酶(Sigma,1148089)、兔抗α-SMA(Abcam,ab5649)、兔抗METTL3(Abcam,ab195352)、m6A比色法检测试剂盒(Epigentek,P-9005)、siNC/siMETTL3 (Ribobio,siG180122034132)、RNAi Max (Thermo,13778)、CCK-8 (凯基生物,KGA317)、EdU细胞增殖检测试剂盒(Ribobio,C10310)。
1.2 大鼠PASMCs 的培养及鉴定 取6~8 周龄SD 大鼠共20 只(每次原代培养需6~8 只),颈椎脱臼处死后采用75%酒精浸泡消毒,置入超净工作台中分离获取肺动脉主干和左右肺动脉干,去除外膜结缔组织内膜后眼科剪反复剪碎为1 mm3。置入适量含0.14 mg/mL DTT、2 mg/mL BSA、8.53 mg/mL Ⅰ型胶原酶及0.2 mg/mL D-Hank's配制的消化液中吹打均匀,37℃水浴锅中消化约90 min,每20~30 min观察一次,待消化完全后,离心收集细胞加入适量含10%FBS+1%双抗的DMEM培养液,置于37℃培养箱中培养。扩增至70%左右时传代,利用差速贴壁纯化细胞,将终止消化后的细胞悬液加入培养瓶中继续培养30 min,缓慢翻转培养瓶,将细胞悬液吸出加入到另一培养瓶中继续培养,重复上述操作2次。最后按1∶3的比例接种到新的培养瓶中,隔天换一次完全培养液。取3~5 代细胞进行爬片,采用细胞免疫荧光技术检 测α-平 滑 肌 肌 动 蛋 白(α-smooth muscle actin,α-SMA)的表达以鉴定PASMCs的细胞纯度。
1.3 细胞siRNA 转染 将PASMCs 分为siNC 组与siMETTL三组,按照siRNA转染试剂说明书分别配置10 μmol/L siNC及siMETTL3储存液,根据25 cm2培养瓶大小,转染试剂混合物配置为:2.5 μL siRNA储存液+7.5 μ L siRNA 转 染 试 剂(RNAi Max)+250 μ L DMEC 培养液。配置完成后加入适量不含双抗的完全培养液中混匀待用。对融合70%左右的PASMCs进行换液,PBS润洗一遍,加入上述配置好的含siRNA转染混合物的DMEM 完全培养液,置入37℃培养箱中继续培养24 h,采用RT-qPCR 及Western blot 检测METTL3的表达,验证转染效率。
1.4 m6A比色法测定 采用m6A比色法试剂盒检测下调METTL3 后PASMCs 总体m6A 修饰水平。细胞处理完成后,采用Trizol 法分别提取siNC 组及siMETTL3 组总RNA。将提取出的总RNA 定量后用RNase-free水或TE Buffer溶液稀释至1~8 μL的样品中,确保每个酶标孔内加入的RNA含量为200 ng。根据试剂盒使用说明,用1×Wash Buffer作为母液分别按需配置
Capture Antibody、Detection Antibody、Enhancer Solution、m6A的阳性对照以及Stop Solution等。提取并定量后的RNA,经过m6A RNA的结合、捕捉及清洗等步骤、最终在酶标仪上450 nm 处检测吸光度的变化,并根据OD450吸光度值分别计算出两组PASMCs m6A的相对表达量。
1.5 PASMCs 细胞增殖检测 采用CCK-8 法检测细胞增殖功能。取3~5 代PASMCs,1%FBS 诱导细胞同步化后,接种于96孔板中,设置空白对照孔(不加细胞)、siNC孔以及siMETTL3孔,每孔加入5 000细胞数的细胞悬液200 μL,置于37℃培养箱中培养过夜。采用上述方法分别转染siNC 及siMETTL3 后加入含20%FBS的DMEM完全培养液培养48 h,诱导结束后每孔加入10 μL CCK-8溶液37℃下继续孵育1 h,采用酶标仪在450 nm波长处检测每孔的吸光度;采用EdU检测细胞增殖改变,根据上述分组将细胞接种于96孔中,按照EdU试剂盒说明分别加入EdU标记孵育2 h,4%多聚甲醛固定,甘氨酸脱色后加入适量0.5%Triton通透10 min,PBS洗涤后加入Apollo染色反应液染色,最后加入Hoechst染核后置于荧光显微镜下观察拍照。
1.6 统计学方法 采用GraphPad Prism 8软件进行数据统计分析,计量资料以均数±标准差()表示,两组间差异比较采用t检验,以P<0.05为差异有统计学意义。
2 结果
2.1 PASMCs 细胞鉴定 镜下见细胞为梭形或长梭形,核居中,呈椭圆形或圆形,通过细胞免疫荧光检测,见镜下几乎绝大多数细胞表达PASMCs 特异性标志物α-SMA(图1)。表明通过酶消化法可获取纯度较高的PASMCs用于后续进一步实验。
2.2 siRNA 抑制METTL3 表达可下调PASMCs的m6A总体修饰水平 RT-qPCR结果显示(图2 A),与
siNC 组比较,siMETTL3 组METTL3 mRNA 表达量显著下调,差异具有统计学意义(P<0.05)。Western Blot结果显示(图2B、2C),与siNC组比较,siMETTL3组目的基因METTL1的蛋白表达水平发生显著下调,差异具有统计学意义(P<0.05)。m6A比色法检测结果显示(图2D),与siNC 组比较,siMETTL3 组m6A 修饰发生显著下调,差异具有统计学意义(P<0.05)。
2.3 下调METTL3 可抑制20% FBS 诱导的PASMCs细胞增殖 CCK-8检测结果显示(图3 A),与siNC 组比较,siMETTL3 组OD 值显著下调,差异具有统计学意义(P<0.05)。EdU 检测结果显示,与siNC 组相比(图3B~3C),siMETTL3组EdU阳性细胞数显著下降,差异具有统计学意义(P<0.05)。
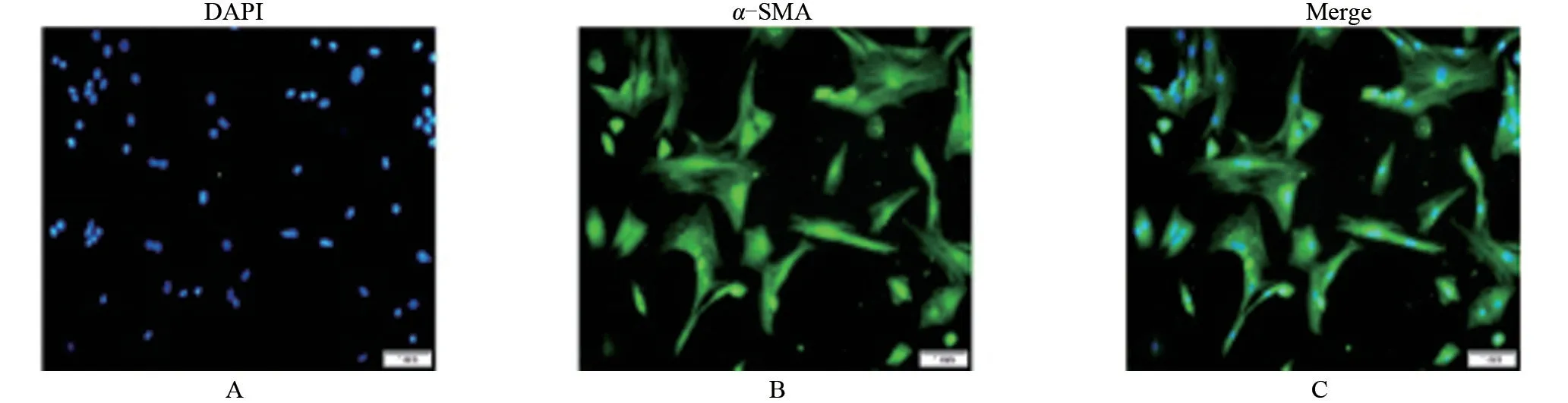
图1 PASMCs免疫荧光鉴定
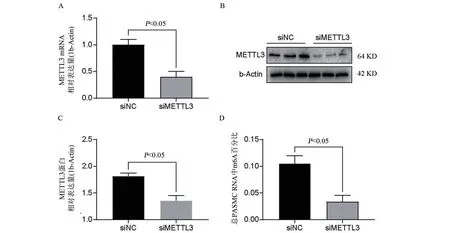
图2 siMETTL3效率验证及对m6A修饰的影响
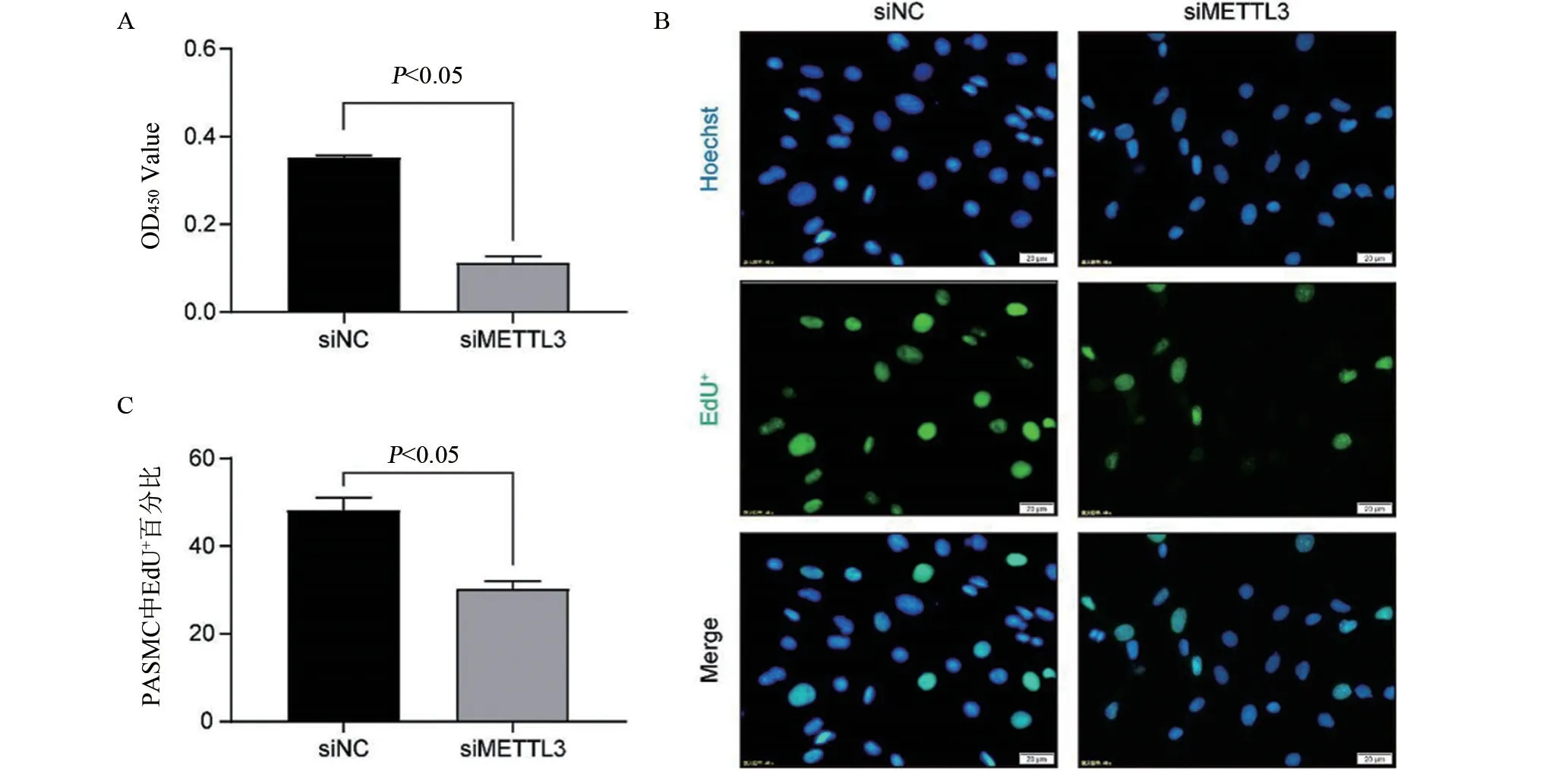
图3 siMETTL3对PASMCs细胞增殖的影响
3 讨论
PAH 已成为当前心脏及呼吸系统疾病领域的重要防治难题,尽管其临床分类多样,但不同类型的PAH 间具有相似的病理生理基础。在PAH 肺血管重塑过程中,PASMCs促增殖与抑制因素的调节平衡失调,导致PASMCs 发生异常恶性增殖。如何靶向调控PASMCs 的增殖失衡是当前PAH 防治的重要环节。PAH与表观遗传的关系密切,既往通过靶向表观遗传机制应对PAH 的防治研究取得重要进展[11-12]。例如DNA 层面的甲基化调控[13]、RNA 层面的非编码RNA干预[14-15]以及蛋白层面的翻译后修饰[16]等。
然而,关于RNA 转录后层面的表观遗传学修饰m6A 与PAH 的关联及作用目前尚无报道。本实验创新性的探讨了表观遗传学中重要的转录后修饰类型m6A 否参与了PAH 肺血管重构过程中PASMCs 的异常恶性增殖过程。以m6A 修饰的关键甲基化转移酶METTL3 为切入点,探索了METTL3 在调控PASMCs的细胞增殖中的作用。研究结果发现,采用小干扰RNA下调METTL1的表达可显著抑制PASMCs的整体m6A修饰水平,并进一步导致PASMCs的细胞活性及EdU阳性细胞比例降低。这些结果说明,敲低METTL3的表达可抑制20%FBS诱导的PASMCs增殖功能。研究表明,METTL3介导的m6A甲基化修饰效应在多种肿瘤的发生发展中扮演重要且复杂的角色[17]。METTL3不仅可促进胰腺癌细胞[18]和膀胱癌细胞[19]增殖及侵袭功能,还可促进子宫内膜癌的增殖及致瘤性[20]。说明METTL3 在促进多种细胞的增殖调控中具有重要作用。我们的研究表明,敲低METTL3 的表达后,m6A 发生显著下调的同时抑制了PASMCs 的细胞增殖功能。进一步夯实了METTL3 介导的m6A 甲基化在表观转录后修饰中的作用。
本研究通过创新性探讨中心法则中RNA 层面的甲基化修饰m6A 对PASMCs 的增殖异常参与肺血管重构过程。基于METTL1 的PASMCs 靶向抑制或可为PAH的治疗提供潜在的干预靶点。尽管如此,本研究尚有不足之处。METTL3 依赖的m6A 修饰如何影响PASMCs 下游关键的促增殖信号分子的RNA 代谢过程机制尚不清楚,有待后续深入研究。
