鹅膏毒肽检测方法的研究进展
2021-05-17刘润卿孙洁芳牛宇敏单文宠
刘润卿,孙洁芳,牛宇敏,单文宠,3,邵 兵*
(1.首都医科大学 公共卫生学院,北京 100069;2.北京市疾病预防控制中心 食物中毒诊断溯源技术北京市重点实验室,北京 100013;3.中国农业大学 动物医学院 北京食品营养与人类健康高精尖创新中心,北京 100193)
毒蘑菇中毒是最常见的食物中毒之一,也是食物中毒致死的最主要原因[1]。一直以来,全球范围内毒蘑菇中毒事件频发。1999年~2016年发生在美国的蘑菇接触病例共有133 700例[2]。意大利[3]、瑞士[4]、爱尔兰[5]等世界各国也时有发生毒蘑菇中毒事件。我国的云南、广西、四川地区毒蘑菇中毒发生率也较高,且多发于夏秋季。2010年~2018年云南省毒蘑菇中毒人数占同期全部食源性疾病爆发事件发病总人数30.37%(9 686/31 892),占总死亡人数50.00%(225/450)[6]。2012年~2017年江西省毒蘑菇中毒人数占同期食源性疾病爆发事件发病总人数13.0%(463/3 565),占总死亡人数82.6%(19/23)[7]。毒蘑菇中毒发生率和病死率高,亚洲中毒患者治疗后病死率仍可达28.4%[8];发病快,临床表现多样,一些毒蘑菇中毒起病急、进展快、预后较差,因此患者中毒后及时进行毒蘑菇毒素的检测,对患者的治疗和预后至关重要。随着科技的发展,传统的检测方法不断推陈出新,新兴的检测技术也在蓬勃发展,为灵敏、精确、高效的毒蘑菇毒素检测提供了有力的技术支持。
1 蘑菇毒素的分类及中毒机理
毒蘑菇种类众多,且与可食用蘑菇不易区别,多因误食而中毒。其中,大部分致死性毒蘑菇毒素为鹅膏肽类毒素。根据其氨基酸的组成和结构又分为9种鹅膏毒肽(AMA)、7种鬼笔毒肽和6种毒伞素。鹅膏毒肽是一种双环八肽,通过与启动环上的组氨酸残基His1085结合[9- 10],专一性抑制真核生物DNA聚合酶Ⅱ活性,导致其无法进行正常转录和细胞内蛋白质合成,从而诱发细胞死亡和肝功能衰竭[11]。鬼笔毒肽是双环七肽,毒伞素为单环七肽,两者专一性的与细胞中肌丝蛋白结合,破坏肌球蛋白与肌丝蛋白正常的聚合-解裂过程[12],从而削弱细胞膜的功能,导致机体中毒。在致死性鹅膏肽类毒素中,致死性最强、含量最高的为α- 和β-鹅膏毒肽,因此对于毒蘑菇毒素的检测主要为针对鹅膏毒肽的检测。
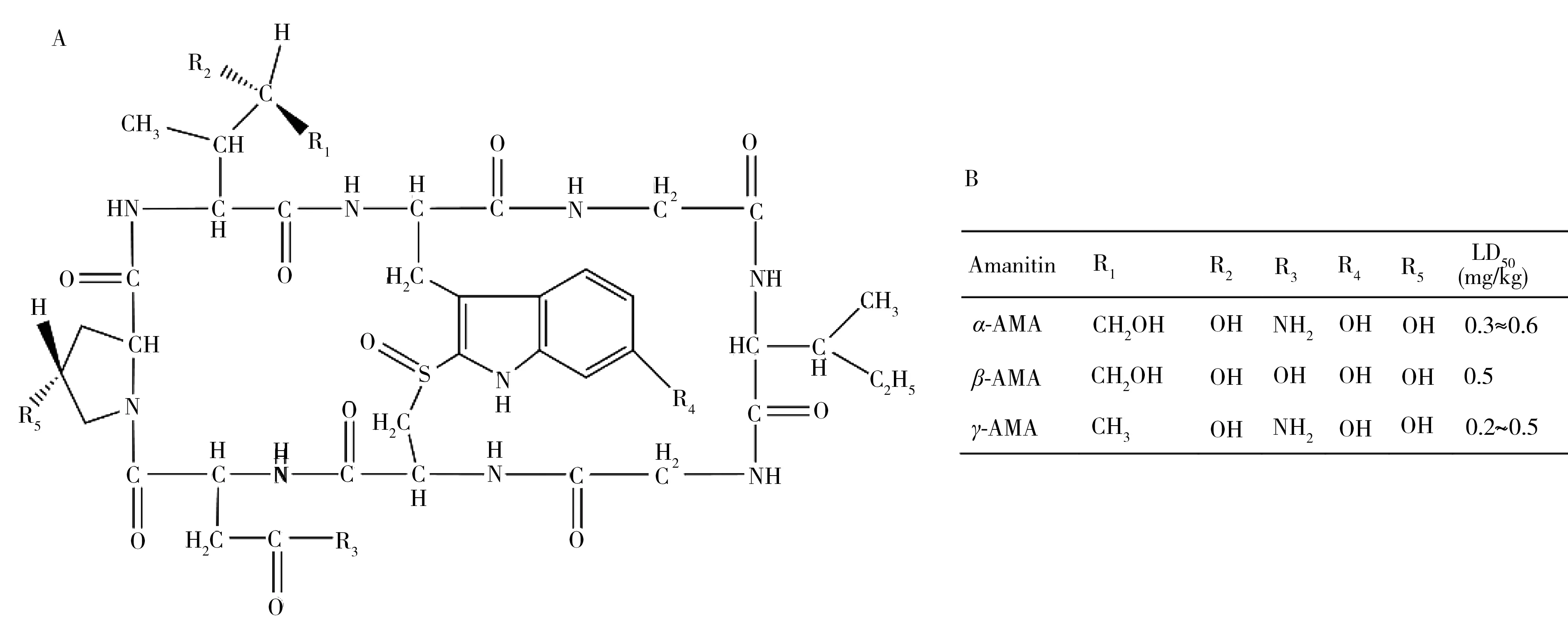
图1 鹅膏毒肽的化学结构(A)及不同种类鹅膏毒肽的取代基与半数致死量(B)Fig.1 Chemical structures of the amatoxin variants(A),and R-group designations for each variant and its median lethal dose(B)
2 检测技术进展
2.1 鹅膏毒肽的色谱及其联用技术进展
基于大型仪器的色谱及其联用技术因具有进样量少、灵敏度高、准确可靠的优点而在鹅膏毒肽的检测中发挥了重要作用。但该类方法由于样品前处理复杂、仪器操作技术要求高,不适用于现场快速筛查。
2.1.1 毛细管电泳检测毛细管电泳(Capillary electrophoresis,CE)检测是一类以毛细管为分离通道、以高压直流电场为驱动力的液相分离、分析技术。Brüggemann等[13]首次尝试用毛细管区带电泳定量患者尿液和毒蘑菇提取物中的α- 和β-鹅膏毒肽。该方法分析需20 min,检出限为1 μg/mL。Rittgen等[14]建立了一种分离鬼笔环肽、α-、β- 和γ-鹅膏毒肽的CE方法,优化后方法检出限为13~79 ng/mL。Robinson-Fuentes等[15]建立的CE方法,能够在7 min内测定尿液中的α- 和β-鹅膏毒肽。分离条件为毛细管间距75 μm,有效长度41 cm,总长度48 cm,25 ℃,20 kV,PDA检测波长为214 nm。该方法的检出限为1.5 ng/mL,定量下限为5 ng/mL,在5~100 ng/mL范围内具有良好线性和选择性。
2.1.2 气相色谱检测气相色谱(Gas chromatography,GC)检测是一种分离、分析技术。通过用惰性气体作为流动相,使样品组分在流动相和固定相之间瞬间达到平衡,是一种分析速度快、分离效率高的分离分析方法。Schwarzinger[16]采用热裂解-气相色谱/质谱对毒蘑菇毒素进行鉴定和分类,通过分析热解、热辅助水解和甲基化,建立毒蘑菇的色谱库,对鹅膏毒素的检出限可达3.5 ng。
2.1.3 高效液相色谱检测高效液相色谱(High performance liquid chromatography,HPLC)检测技术以液体为流动相,采用高压输液系统,将具有不同极性的单一溶剂或不同比例的混合溶剂、缓冲液等流动相泵入装有固定相的色谱柱,各成分在柱内被分离后,进入检测器进行检测。Jehl等[17]研究了一种HPLC测定人血清、 尿液和胃液中α- 和β-鹅膏毒肽含量的方法。该方法在反相分析柱上进行分离,在280 nm紫外检测条件下定量检测,α- 和β-鹅膏毒肽的检出限均为10 ng/mL。Abbott等[18]开发出一种HPLC方法检测尿液中鹅膏毒肽的含量,为了更精确的定量,通过同位素内标法定量α-鹅膏毒肽,其内标为15N10-α-鹅膏毒肽,而β- 和γ-鹅膏毒肽不使用内标具有更一致的定量,检测样本的α-、β-、γ-鹅膏毒肽的检出限分别为0.458、0.930、0.169 ng/mL。Garcia等[19]开发并验证了一种HPLC紫外二极管阵列(Diode array detector,DAD)和电化学检测的方法,用于定量大鼠肝脏和肾脏中的α-鹅膏毒肽,检测步骤简单、快速,适用于研究α-鹅膏毒肽的药代动力学和组织分布。Morel等[20]采用HPLC在294 nm对蘑菇中的α- 和β-鹅膏毒肽进行分析,检出限分别为20.5、29.1 ng/mL,回收率为83.0%~124.8%。
Li等[21]设计了一种分子印迹聚合物(Molecular imprinting polymers,MIPs)作为HPLC固定相,具有识别和富集α-鹅膏毒肽的作用,通过HPLC分析检测血清中α-鹅膏毒肽的含量,检出限为3.0 ng/mL,线性范围为10~500 ng/mL,回收率为88.5%~95.9%。因为MIP特异性识别界面的存在,即使在复杂的样品基质中也表现出对目标物良好的选择性。
2.1.4 液相色谱联用质谱检测液相色谱与质谱联用技术(Liquid chromatography-mass spectrometry,LC-MS)利用液相色谱作为质谱的进样系统,使复杂的化学组分得到分离,利用质谱作为检测器进行定量和定性分析,可提高检测方法的灵敏度。
Li等[22]开发并验证了一种灵敏、经济的LC-MS/MS法检测血清中的α-鹅膏毒肽,检出限为3.0 ng/mL。Li等[23]使用液相色谱-光电二极管阵列检测-离子阱和飞行时间质谱(Liquid chromatography-photodiode array detection-ion trap and time-of-flight mass spectrometry,LC-PDA-IT-TOF-MS)可实现同一样品中多种鹅膏毒肽的准确识别检测,该研究对毒素的裂解途径和特征片段离子进行深入研究,获得了更好的检测效果。
Wang等[24]建立了一种应用固相萃取柱处理样品,测定蘑菇样品中蘑菇毒素(包括α-、β-、γ-鹅膏毒肽等)的LC-MS方法,检出限可达0.07 mg/kg。Xu等[25]应用在线固相萃取/高效液相色谱-三重四极杆质谱联用技术(Solid phase extraction/high performance liquid chromatography-triple quadrupole mass spectrometry,SPE/LC-MS/MS)建立了超痕量α- 和β-鹅膏毒肽的分析方法,检出限均为0.02 ng/mL,线性范围为0.05~20 ng/mL。Zhang等[26]利用超高效液相色谱-串联质谱(Ultrahigh performance liquid chromatography-tandem mass spectrometry,UPLC-MS/MS)联合固相萃取柱PRiME HLB洗脱平台,简单、高通量地分析血浆、血清和尿液中3种鹅膏毒肽(α-、β-、γ-鹅膏毒肽)含量,实现了血浆中3种鹅膏毒肽低至0.5 ng/g的检测。
Tan等[27]设计了一种基于β-环糊精协同MIP识别的固定相,应用UPLC-MS/MS方法实现血清、尿液以及肝脏中α-、β- 和γ-鹅膏毒肽的同时检测,在尿液、血清、肝脏中的检出限分别为0.16~0.33 ng/mL,0.34~0.42 ng/mL和0.035~0.056 ng/kg,分析速度缩短至8 min。
Xu等[28]制备了一种新的反相/苯基硼酸型混合模式磁固相萃取(Magnetic solid-phase extraction,MSPE)吸附剂用于UPLC-MS/MS法检测鹅膏毒肽(见图2)。该方法的基质效应较低,灵敏度高,检出限低(0.3 μg/kg),从称重、富集、纯化到检测,在20 min内即可完成一次样品的检测。该研究研制出一种吸附蘑菇等样品中鹅膏毒素的MSPE材料,用硅烷化的POSS对氯甲基化微球(Fe3O4@SiO2)和磁性微球进行改性,将3-苯氧基苯甲醛和4-甲酰基苯甲酸偶联,制备了RP/PBA复合型磁性微球(Fe3O4@SiO2@POSS@POB@PBA),使设计的吸附剂表面与目标物的结构相匹配。该吸附剂具有较大的吸附容量和良好的目标选择性,在使用过程及使用后很容易通过磁分离,样品前处理过程简单、快速、高效,并有效地降低了LC-MS/MS测定中的基质影响。
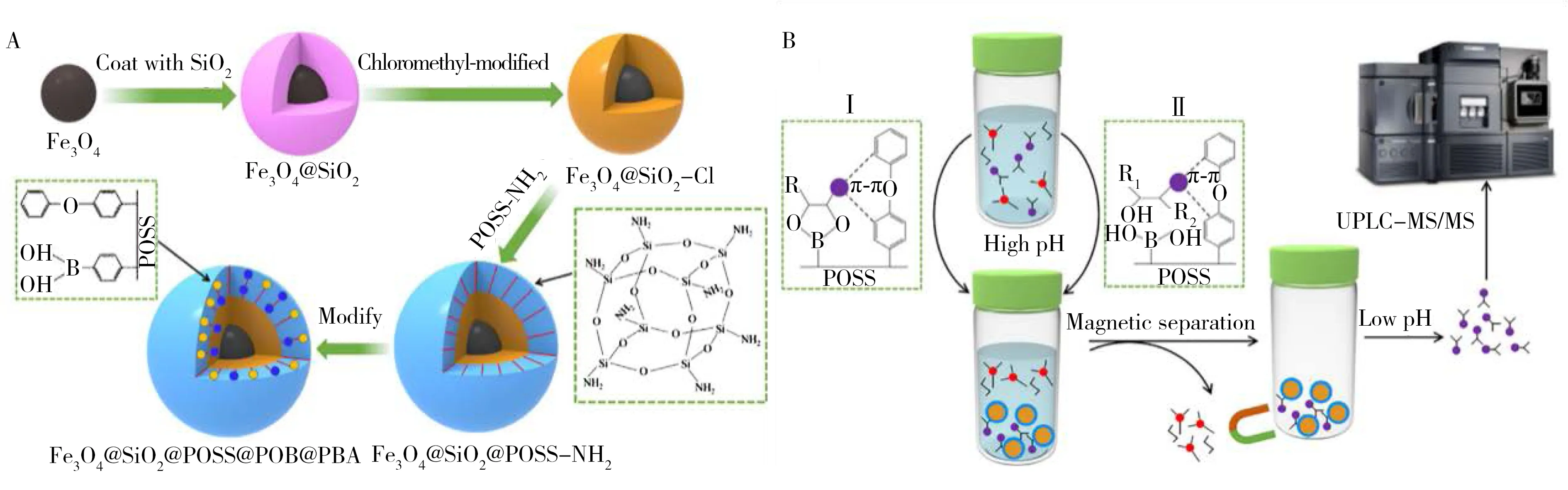
图2 特异性识别捕获鹅膏毒肽的分子印迹材料构建(A);磁性Fe3O4@SiO2@POSS@POB@PBA微球吸附剂特异性回收基质中鹅膏肽毒素及其后续与UPLC-MS/MS的联用检测示意图(B)[28]Fig.2 Construction of molecularly imprinted materials that specifically identify amatoxin(A);schematic diagram of magnetic Fe3O4@SiO2@POSS@POB@PBA microsphere adsorbent specific recovery for amatoxin in matrix and its subsequent detection combined with UPLC-MS/MS(B)[28]
2.2 鹅膏毒肽的快速检测技术进展
2.2.1 基于鹅膏毒肽理化性质的快速检测鹅膏毒肽基于理化性质的检测技术主要有显色反应、吸收光谱检测和荧光检测。这些方法通过一定的化学衍生手段实现鹅膏毒肽光谱性质的变化,具有简单、快捷的优势,但灵敏度低、特异性差,通常需与其他技术联用。Wieland等[29]发展了一种简单显色检测方法,将鲜蘑菇汁液印迹在纸上,干透后滴加浓盐酸,如含有鹅膏毒肽毒素则10 min内显蓝色。虽然操作简单,但灵敏度低,定量困难,仅可能适用于野外采集蘑菇的初步鉴定。 Vlaskin等[30]研究了一种基于荧光光谱快速检测鹅膏毒肽的方法,通过将鹅膏毒肽加入溴化乙啶后会产生新的荧光波段,从而实现检测。
纸层析和薄层层析(Thin layer chromatography,TLC)技术通过不同溶质与固定相和流动相之间作用力的差别,实现了不同物质在固定相上的分离。Wieland等[31]首次利用纸层析技术分离检测毒素,层析结果采用1%的肉桂醛在浓盐酸气体中变色的显色反应进行检测。Sullivan等[32]最先采用薄层层析法分离检测α-、β- 和γ-鹅膏毒肽。Stijve等[33]建立了一种快速、灵敏、高效的薄层色谱法测定鹅膏粗提取物中α-、β- 和γ-鹅膏毒肽含量,每种鹅膏毒肽的检出限为50 ng。
2.2.2 基于免疫识别的快速检测免疫识别检测利用抗原抗体特异性识别对目标物进行检测,具有特异性好、灵敏度高的优点,但易有交叉反应存在,也需考虑假阳性情况。放射免疫检测法(Radioimmunoassay,RIA)是利用放射性核素的测量方法与免疫反应的基本原理相结合的一种放射性核素体外检测法。Faulstich等[34]将鹅膏毒肽的衍生物与胎球蛋白结合作为兔抗原,具有较低的毒性和较高的免疫原性,所获得的抗体与其他鹅膏毒肽不产生交叉反应。RIA提取纯化的IgG结合在活化的尼龙表面,同时共价偶联氚化的鹅膏毒肽免疫球蛋白进行免疫检测,以用于生物基质中目标物的检测,检出限为3 ng/mL。RIA具有灵敏度高、特异性强、精确度佳等优点,但同时也具有价格昂贵、放射性核素对人体存在潜在危害性等缺点。
酶联免疫吸附测定(Enzyme-linked immunosorbent assay,ELISA)技术具有灵敏度高、特异性好、简单快捷等优点。Abuknesha等[35]在绵羊体内制备β-鹅膏毒肽多克隆抗血清,构建了间接竞争酶联免疫吸附测定法(Indirect competitive enzyme-linked immunosorbent assay,ic-ELISA)测定人血清和尿液中的毒素,检出限为80 pg/mL,与α-鹅膏毒肽的交叉反应性为22%。He等[36]研究了一种针对鹅膏毒肽的广谱特异性单克隆抗体,鹅膏毒肽蛋白与包衣抗原竞争性地与单克隆抗体结合,该方法对α-、β- 和γ-鹅膏毒肽的检出限分别为4.55、4.90、4.45 ng/mL。
Bever等[37]应用侧向流动免疫分析(Lateral flow immunoassay,LFIA)技术快速检测尿液中的鹅膏毒肽,在10 min内即可完成检测,且无需对尿液进行任何预处理,对α- 和γ-鹅膏毒肽的检出限为0.3 ng/mL,β-鹅膏毒肽的检出限为1 ng/mL。
Zhang等[38]开发了一种快速、简单的新型表面等离子体共振(Surface plasmon resonance,SPR)免疫检测鹅膏毒肽的方法,构建单链可变区(Single-chain variable fragment,scFv)噬菌体抗体库,筛选并分离了对鹅膏毒肽具有高特异性的重组抗体scFv-A4,以该抗体为基础,所开发的SPR传感器免疫检测的灵敏度为ic-ELISA法的10倍左右,检出限为0.17 ng/mL。该方法抗体制备简单、重复性好,可快速提纯,提升了免疫分析的灵敏度。
He等[39]同样基于重组单链可变片段抗体scFv-A4,开发了以胶体金作为红色标记的快速免疫层析法(Colloidal gold immunochromatography assay,CG-ICA),可在10 min内完成检测,实现了现场快速半定量测定蘑菇样品中的鹅膏毒素。CG-ICA是一种基于竞争反应原理的快速半定量检测方法。样品中的鹅膏毒素与测试线上固定的α-鹅膏毒肽-OVA结合物竞争结合胶体金标记的抗体。与传统的多抗或单抗CG-ICA相比,该方法制备的试纸价格低廉,重复性好。
2.2.3 基于特异性基因片段的检测技术Wooszyn等[40]研究了一种基于基因编码鉴定毒蘑菇中鹅膏毒肽的通用方法提取毒蘑菇中的DNA,再进行聚合酶链式反应(Polymerase chain reaction,PCR)扩增,用于检测鹅膏菌属。He等[41]建立了基于锁式探针(Padlock probe,PLP)的超支化滚动环扩增(Hyperbranched rolling circle amplification,HRCA)技术,用HRCA等温法鉴定蘑菇混合物中的致命鹅膏毒肽,灵敏度比传统PCR法高100倍。HRCA是一种等温的指数扩增技术,通过逐个引物延伸和链置换的级联反应,快速测定特定的核酸序列。挂锁探针为大约100个碱基的单链线性寡核苷酸,由两个序列组成,与目标序列的5'和3'端互补,并由遗传连接区连接。当与目标杂交时,探针的5'和3'末端并列,并连接形成一个闭合的环状分子。环状探针可以在等温条件下用DNA聚合酶进行HRCA指数级扩增。所设计的聚合酶链反应能够识别所有的α-鹅膏毒肽基因序列,并能产生阳性HRCA反应,最终加入SYBR Green I诱导荧光产生,令HRCA结果无需琼脂糖凝胶电泳即可直观读出,大大降低了气溶胶污染的可能性。该方法无需昂贵的设备,可直接读取信号,从而为条件较差的实验室和偏远地区的快速筛查提供了一种快速、特异、灵敏且经济有效的工具。
2.2.4 基于分子印迹传感器的快速检测基于分子印迹传感器的快速检测以MIP实现的特异性分子间作用力或立体结构作为识别基础,搭建各种传感界面,应用不同信号传导方式,实现基质中痕量鹅膏毒肽的识别、富集和检测,具有快捷、可视化、高特异性和高灵敏度等特点,以满足不同情况下的检测需求。
Feng等[42]将碳量子点(Carbon quantum dots,CDs)嵌入印迹聚合物制备了特异性识别的荧光传感器,用于直接检测血清中的α-鹅膏毒肽,方法检出限低至15 ng/mL。MIP中羧基和吡啶官能团可通过协同识别作用提高MIP对α-鹅膏毒肽的识别、捕获能力,所制备的荧光传感器无需任何预处理即可选择性、灵敏地检测血清中的目标物。
Qiu等[43]建立了一种基于石英晶体微天平分子印迹(QCM-MIP)传感器用于检测生物样品中的鹅膏毒肽。首次利用烯丙基硫醇在QCM金电极表面附着可聚合的双键,以合成的α-鹅膏毒肽为模板,4-乙烯基吡啶和A-甲基丙烯酸为双功能单体,在金电极表面沉积MIP涂层。所构建的QCM-MIP对α-鹅膏毒肽具有良好的吸附性能,且重复性和稳定性好,在1.0~50.0 ng/L范围内具有良好的线性响应,检出限可达0.052 pg/L。
Qiu等[44]将MIP捕获界面与光子晶体模板相结合,制备了MIP光子晶体传感器(MIPC),可实现2 min内对食品基质和生物基质中α-鹅膏毒肽的检测,方法具有可视化、重复性好、灵敏度高等优势(图3)。该工艺以合成的部分α-鹅膏毒肽为模板,二氧化硅胶体光子晶体为载体,甲基丙烯酸(MMA)为功能单体,乙二醇二甲基丙烯酸(EDMAA)为交联剂,所合成的MIPC在乙醇溶液中与α-鹅膏毒肽吸附结合后能够引发衍射峰发生位移,实现光学检测。所制备的MIPC传感器线性范围宽(10-9~10-3mg/L)、检出限低(5.0×10-10mg/L)、响应时间短(2 min),在识别过程中伴随着MIPC膜的颜色变化,从而实现了蘑菇、血清、尿液中灵敏的可视化检测。
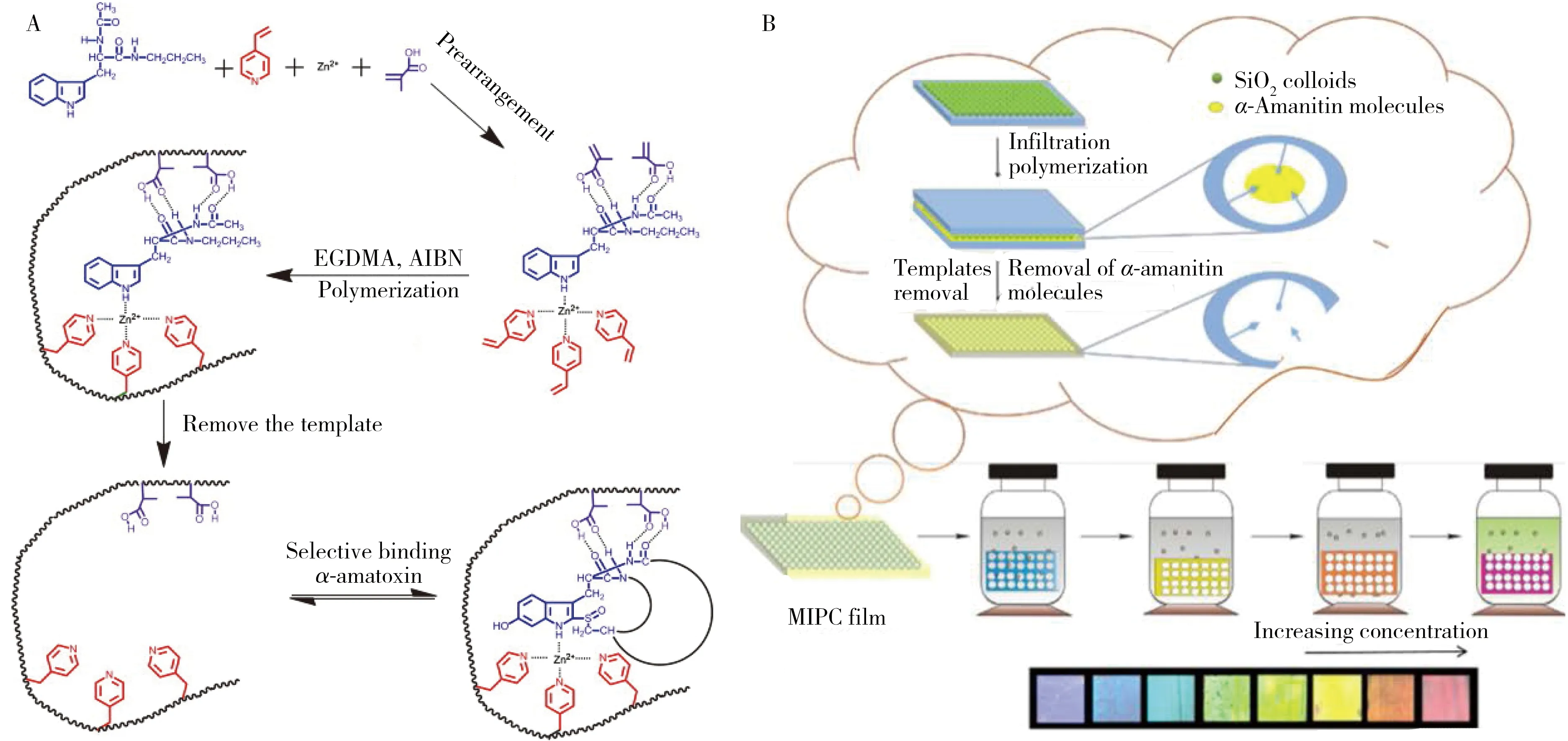
图3 特异性识别捕获鹅膏毒肽的分子印迹前处理材料的构建[21](A);MIP光子晶体传感器对食品和生物基质中α-鹅膏毒素的可视化检测[44]Fig.3 Construction of molecularly imprinted pretreatment materials for specific identification of α-amatoxin(A);visual detection of α-amatoxin in food and biological matries by MIP photonic crystal sensor(B)[44]
表1列出了近年来对鹅膏毒肽进行检测的方法对比。
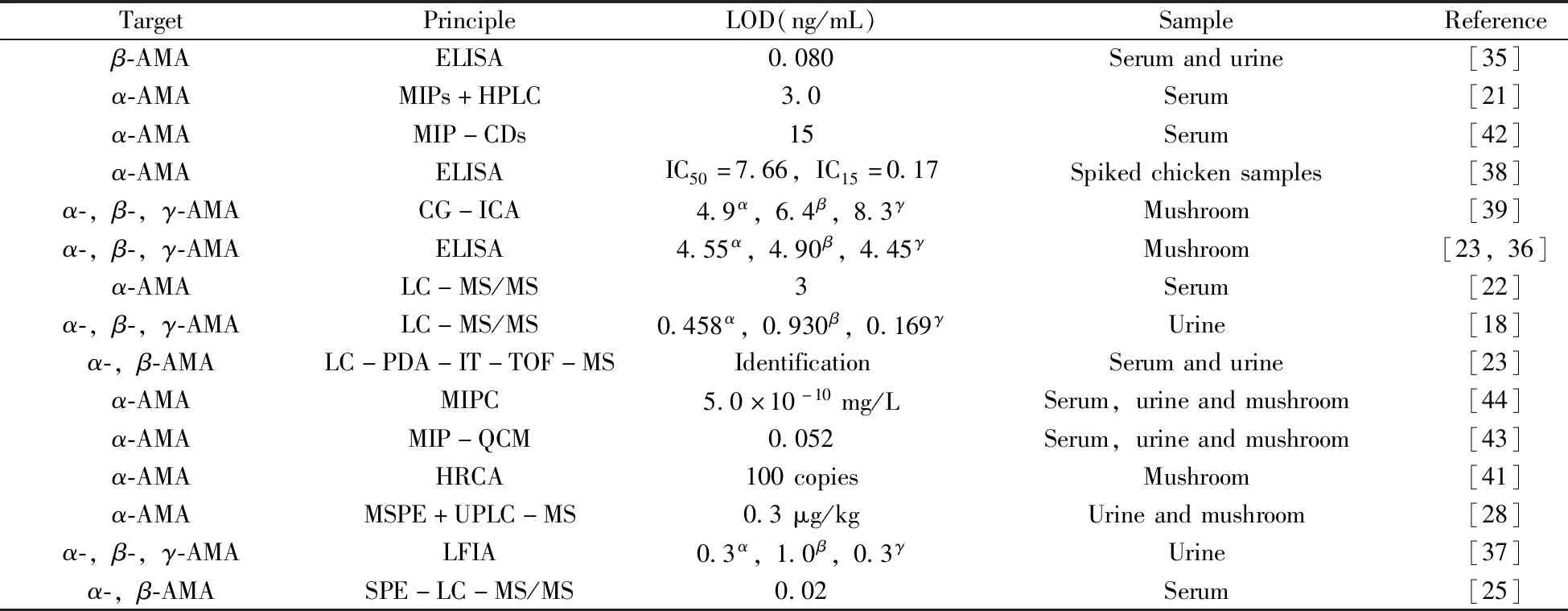
表1 近几年鹅膏毒肽的检测方法对比Table 1 Comparison of detection methods for amatoxin in recent years
3 总结与展望
鹅膏毒肽作为含量最高、致死性最强的毒蘑菇毒素,其检测需求逐渐日常化、基层化。在实际临床应用中,受限于实验室条件、仪器设备及操作人员的专业技术水平,目前已有的检测技术,特别是LC-MS/MS等技术,无法很好地满足基层筛查需求。随着科技进步,检测技术不断革新,从单一技术检测单一毒素,逐渐发展为多技术联合检测混合毒素。这过程中,不断简化前处理方法,提高灵敏度和稳定性,缩短检测时间,满足不同基质的检测要求,是新兴检测技术发展与创新的动力和追求。此外,操作尽量方便简捷,也可为基层检测的实用性、准确性提供保障。因此,在提高仪器检测方法灵敏度的同时,更要关注快速检测方法的创新,开发出更方便、更快捷、更准确的鹅膏毒肽检测方法。
