日粮中添加桑叶多糖对雏鸡免疫功能的影响
2021-05-14耿兵臧云飞王照红李福伟赵东晓董亚茹高金波
耿兵 臧云飞 王照红 李福伟 赵东晓 董亚茹 高金波
摘 要:为了探明桑叶多糖对雏鸡免疫功能的影响,本研究采用超声波辅助水提法,辅以离子交换柱层析对其纯化,得到两种不同分子量的桑叶多糖组分( MLP-I、MLP-II) 。将两种多糖分别以0.5%的剂量添加到雏鸡的基础日粮中。结果表明,桑叶多糖可以显著提高雏鸡免疫器官指数,能够显著促进细胞因子IL-2和IFN-γ的分泌,MLP-II的免疫增强效果优于MLP-I。本研究为桑叶多糖的开发利用提供了技术支撑和理论依据。
关键词:桑叶多糖;雏鸡;免疫
中图分类号:S816.75 文献标识码:B 文章编号:1673-1085(2021)2-0010-04
多糖是普遍存在于植物体内的生物学大分子物质,具有提高机体免疫力、抗病毒、抗肿瘤、抗炎等一系列作用,近年来关于植物多糖的研究较为广泛。桑叶是桑科多年生落叶小乔木桑树(Morus alba L.)的叶,中医又称“铁扇子”[1],桑叶中含有植物甾醇、黄酮类、生物碱类、多糖等功能性活性物质,其多糖成分具有提高动物机体免疫力、抗氧化 、降血糖、降血脂、抗高血压、抗炎和血管舒张剂等多种生物活性[2-7]。侯瑞宏等研究发现,桑叶多糖(MLP)对小鼠的体液免疫功能、单核-巨噬细胞功能、细胞免疫功能等均有显著性的影响,说明MLP具有免疫调节功能[8]。因此,本研究将桑叶经提取、分离、纯化得到两种不同分子量的多糖组分(MLP-I、MLP-II),并将两种不同的多糖组分作用于雏鸡,探讨桑叶多糖对雏鸡免疫功能的影响,为桑叶多糖在家禽养殖上的应用提供理论依据。
1 材料和方法
1.1 材料 细胞因子IL-2和IFN-γ的ELISA检测试剂盒购自江苏晶美生物科技有限公司;200只1 d海兰褐公雏,购自于海阳鸿牧种禽有限公司;酶标仪(ELX800),美国 Bio-Tek 宝特公司产品;台式离心机(TGL-16G),上海安亭科学仪器制造厂生产;超声波清洗浴(KQ-2200DB),昆山股份有限公司生产;其它试验所用化学试剂均为国产分析纯。
1.2 桑叶粗多糖的提取 采用超声波辅助水提法,具体步骤如下:新鲜桑叶在真空烘箱中60 ℃烘干,研磨过80目筛, 制成桑叶干粉。纯净水为溶剂,料液比1∶20,超声波功率为50 W,85 ℃提取时间2.5 h[9],将滤液在真空下利用旋转蒸发器在50 ℃下浓缩,无水乙醇沉淀,真空冷冻干燥,得到的粉末即为桑叶粗多糖。
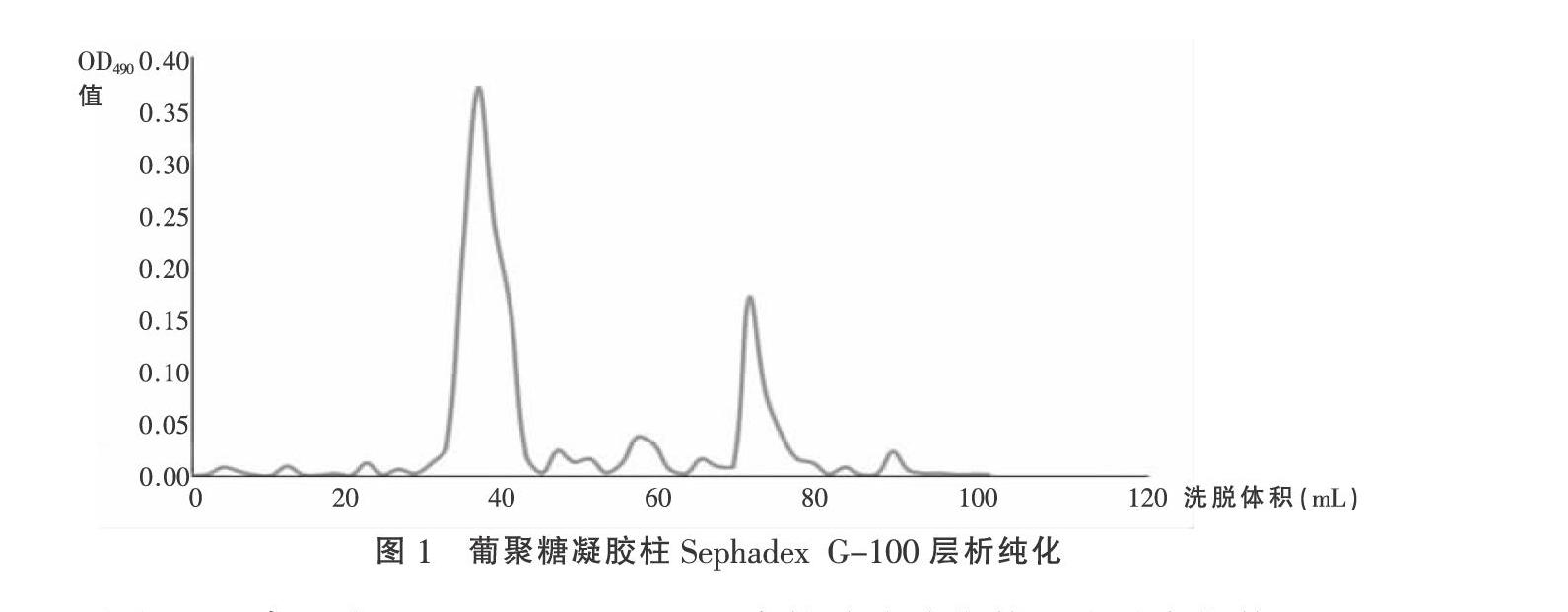
1.3 桑叶多糖的纯化 将粗制MLP溶解于10 mL蒸馏水中,通过0.45 mMMPs膜过滤。滤液通过DEAE-52纤维素阴离子交换柱(26 mm×500 mm)。洗脱液为0.1 mol/L NaCl,流速为1 mL/min。洗脱液的总糖含量用苯酚-硫酸法测定。NaCl洗脱的馏分在Sephadex G-100凝胶柱上以0.5 mL/min的速度洗脱,洗脱峰的洗脱液装入透析袋中进一步纯化浓缩,最后经乙醇沉淀、真空冷冻干燥得到纯化多糖[10]。
1.4 试验动物及分组 将200只1 d海兰褐公雏饲养至7 d后选取150只,随机分为3组(MLP-I组、MLP-II组和空白对照组)。试验组在雏鸡的基础日粮中添加0.5%的桑叶多糖。常规饲养管理,各组的饲养条件、饲养方法等均一致。试验期56 d,预试期5 d。
1.5 检测指标和方法 试验56 d时,每组随机选取30只试验鸡心脏采血,分离血清检测免疫球蛋白G(IgG)、免疫球蛋白M(IgM)、白介素2(IL-2)和γ-干扰素(IFN-γ)含量;禁食12 h后称重、屠宰,取胸腺、脾脏、法氏囊和肝脏等免疫器官,吸干表面液体、除去多余脂肪,称其鲜重,计算免疫器官指数。免疫器官指数=免疫器官鲜重(g)/宰前空腹活重(kg)。
1.6 数据分析 数据采用 Microsoft Excel 2007 和SAS (Version 8e,SAS Institute,1998)软件进行统计分析。试验数据以“平均值±标准差”表示,P<0.05表示差异显著,P<0.01表示差异极显著。
2 结果与分析
2.1 桑叶多糖的分离提纯 苯酚-硫酸法检测结果表明,桑叶多糖的提取率达到8.83%,多糖的纯度为86.97%。用葡聚糖凝胶柱Sephadex G-100层析纯化桑叶多糖,得到两种多糖组分,分别命名为MLP-I、MLP-II,如图1所示。
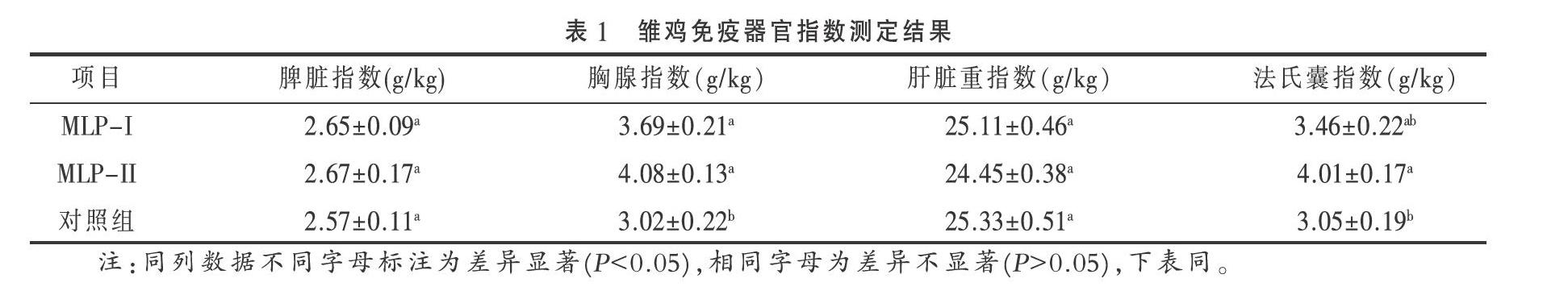
2.2 MLP对雏鸡免疫器官发育的影响 结果见表1。
由表1可见,两种桑叶多糖组分可以显著提高雏鸡胸腺指数和法氏囊指数(P<0.05),MLP-II效果优于MLP-I,两种多糖对雏鸡脾脏指数和肝脏指数没有显著影响(P>0.05)。
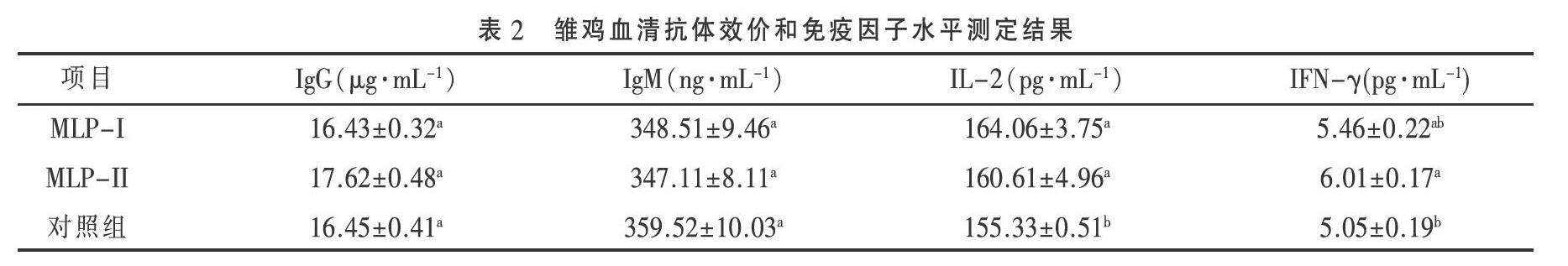
2.3 MLP對雏鸡血清中细胞因子的影响 检测结果见表2。
由表2可见,两种桑叶多糖组分对雏鸡血清中免疫球蛋白IgG、IgM的分泌没有明显的促进作用;MLP-II、MLP-I均可显著提高血清中IL-2和IFN-γ的含量(P<0.05)。
3 讨论
多糖是桑叶中的重要活性物质,具有显著的抗氧化、增强免疫力等功能[11]。多糖主要是利用其结构相似性和受体结合发挥生物活性,调节免疫器官释放相关细胞活性因子,进而提高机体免疫力[12]。胸腺和法氏囊是家禽重要的免疫器官,是多种免疫活性因子分泌的主要部位[13],免疫器官的发育状态与免疫功能密切相关。Ravis等人报道称免疫器官指数可以用来评价机体免疫水平,较大的免疫器官重量通常在一定程度上代表着较强的免疫功能[14]。因此免疫器官指数常用来评价家禽的免疫水平[15]。
本研究纯化的桑叶多糖组分MLP-II、MLP-I对胸腺和法氏囊的发育均具有促进作用,说明桑叶多糖对雏鸡的免疫具有促进作用。这与目前的研究结果相似,陈洪亮[16]研究结果表明,黄芪多糖、牛膝多糖、芦荟多糖能够显著提高肉鸡的法氏囊指数;李维[17]研究结果表明,桑叶多糖能够有效增强小鼠的机体免疫力;张燕等[18]研究结果发现白毛藤多糖能够显著提高三黄鸡雏鸡的免疫器官指数。
血清中IL-2、IFN-γ也是反映机体免疫功能的重要指标。本研究结果表明,日粮中添加桑叶多糖可显著提高雏鸡血清中IL-2和IFN-γ含量,通过提高细胞免疫因子增加机体血液屏障功能,从而提高机体的免疫防御。这与Chen等[10]研究结果相似,即桑叶多糖能显著促进小鼠空肠和气管分泌IL-2、IFN-γ和SIgA,促进盲肠扁桃体IgA+细胞的产生,增强肠道和气管粘膜免疫功能;Fan等[19]将淫羊藿多糖作为疫苗免疫佐剂,发现淫羊藿多糖能够最有效地促进IFN-γ和IL-6 的分泌。说明多糖能够通过增加细胞因子分泌,可能激活了相关免疫应答通路,进而提高机体免疫水平。
4 结论
本研究采用超声波辅助水提法提取桑叶多糖,利用凝胶柱子层析得到两种不同分子量的桑叶多糖组分MLP-I、MLP-II,并分析其对雏鸡的免疫功能影响,发现MLP-I、MLP-II均可以显著提高雏鸡的免疫功能,MLP-II的效果好于MLP-I,为继续开发利用桑叶多糖奠定了理论基础。
参考文献:
[1] 苏方华. 桑叶的化学成分及临床应用研究进展[J]. 中国医药导报,2010,7(14): 9-12.
[2] Arumugam S, Mito S, Thandavarayan R A, et al. Mulberry leaf diet protects against progression of experimental autoimmune myocarditis to dilated cardiomyopathy via modulation of oxidative stress and MAPK-mediated apoptosis[J]. Cardiovascular therapeutics, 2013, 31(6): 352-362.
[3] 姚佳, 乔迪, 郭鑫, 等.桑叶中1-脱氧野尻霉素对糖尿病肾病大鼠的治疗作用[J]. 中国临床药理学与治疗学, 2018, 23(5):517-523.
[4] Ren C, Zhang Y, Cui W, et al. A polysaccharide extract of mulberry leaf ameliorates hepatic glucose metabolism and insulin signaling in rats with type 2 diabetes induced by high fat-diet and streptozotocin[J]. Int J Biol Macromol, 2015, 72(9): 951-959.
[5] Yang N C,Jhou K Y,Tseng C Y. Antihypertensive effect of mulberry leaf aqueous extract containing γ- aminobutyric acid in spontaneously hypertensive rats[J]. Food Chemistry, 2012, 132(4): 1796-1801.
[6] Horng C T, Liu Z H, Huang Y T, et al. Extract from Mulberry(Morusaustralis) leaf decelerate acetaminophen induced hepaticinflammation involving downregulation of myeloid differentiation factor 88 (MyD88) signals[J]. Journal of Food and Drug Analysis, 2017, 25(4): 862-871.
[7] Kurniati N F, Suryani G P, Sigit J I. Vasodilator effect of ethanolicextract of mulberry leaves (Morus alba L.) in rat and rabbit[J].Procedia Chemistry, 2014, 13: 142-146.
[8] 侯瑞宏,廖森泰,劉凡,等.桑叶多糖对小鼠免疫调节作用的影响[J].食品科学,2011,32(13):280-283.
[9] 刘学军,李云平,胡恒彬,等.超声波提取桑叶多糖工艺条件优化[J].北方蚕业,2007,28(3):11-13.
[10] Chen X, Sheng Z, Qiu S, et al. Purification,characterization and in vitro and in vivo immune enhancement of polysaccharides from mulberry leaves[J]. Plos One, 2019,14(1):1-20.
[11] 曾卫湘,郑莎,韩冷,等.53份桑种质桑叶的药用品质综合评价[J].蚕业科学,2018,44(6):905-915.
[12] 何余堂,潘孝明.植物多糖的機构与活性研究进展[J].食品科学,2010,31(17):493-496.
[13] Fan YP,Lu Y,Wang DY, et al.Effect of epimedium polysaccharide-propolis flavone immunopotentiator on immunosuppression induced by cyclophosphamide in chickens[J].Cellular Immunology, 2013, 281:37-43.
[14] Ravis W R, Parsons D L, Wang S J. Buffer and pH effects on propranolol binding by human albumin and α1-acid glycoprotein[J]. Journal of Pharmacy & Pharmacology, 1988,40, 459-463.
[15] Heckert R A, Estevez I, Russek-Cohen E, Pettit-Riley R. Effects of density and perch availability on the immune status of broilers[J]. Poultry Science, 2002,81: 451-457.
[16] 陈洪亮.植物多糖的制备及对肉仔鸡免疫功能影响的研究[D].北京:中国农业科学院,2002.
[17] 李维.桑叶多糖对小鼠免疫调节作用的影响[J].江西农业,2016(13):110-111.
[18] 张燕,孙志良,陈小军.从组织学角度研究白毛藤多糖对鸡免疫器官的影响[J].畜牧兽医科技信息,2007(8):26-27.
[19] Fan Y,Liu J,Wang D,et al.Adjuvanticity of epimedium polysaccharide-propolis flavone on inactivated vaccines against AI and ND virus[J]. Int J Biol Macromol,2012,51(5): 1028-1032.
Effects of dietary mulberry leaf polysaccharides
on immune function of chicks
GENG bing1, WANG zhaohong1, LI fuwei1, ZHAO dongxiao1, DONG yaru1, GAO jinbo1,2*
(1.Shandong Sericulture Research Institute,Yantai 264002, China;
2.Institute of Poultry Research,Shandong Academy of Agricultural Sciences/Shandong Poultry Breeding and Engineering Technology Research Center, Jinan 250100, China)
Abstract:In order to find out the effect of mulberry leaf polysaccharides on the immune function of chicks, ultrasonic-assisted water extraction and ion exchange column chromatography were used to purify mulberry leaf polysaccharides, and two kinds of mulberry leaf polysaccharides with different molecular weight (MLP-I and MLP-II) were obtained. The two polysaccharides were added to the basal diet of chicks at a dose of 0.5% respectively. The results showed that mulberry leaf polysaccharides could significantly increase the immune organ index of chicks and significantly promote the secretion of cytokines IL-2 and IFN- γ. The immune enhancement effect of MLP-II was better than that of MLP-I. This study provides technical support and theoretical basis for the development and utilization of mulberry leaf polysaccharides.
Keywords: Mulberry leaf polysaccharides;chicks;immunity□
