分光光度法的教学实践
2021-05-14李昆盘锦高级技工学校辽宁盘锦124000
李昆(盘锦高级技工学校,辽宁 盘锦 124000)
0 引言
水中铁含量是非常重要的水质指标,铁及其化合物具有低毒性。人体内所需的铁主要来源于食物和饮水。长期饮用含铁量过高的水,会使人呕吐、腹泻、胃肠道紊乱,体内铁含量高的人中风后发生严重脑损伤的危险性较高,因此测定饮用水中铁含量很有必要。
在分光光度法的教学中,采用先理论后实操的教学模式,应用头脑风暴法、小组讨论法、角色扮演法、组间互评、组内自评等教学方法,让学生最大程度地参与到课堂教学中来,告别“填鸭式”的传统教学模式,不但使学生学会了理论原理,同时也锻炼了动手能力,更重要的是增强了他们主动探索的自信心和满足感。理论实践一体化的教学模式对于中职学生的适应性效果良好,使教学工作更为流畅,培养出更多更优秀的化工人才。
1 学情及知识难度分析
仪器分析是在化学分析的基础上逐步发展起来的,由于科技的进步,越来越多测定更精准的分析仪器应用到分析测定中。在众多的分析仪器中,分光光度法是光学分析法的一种,它是通过测量溶液中被测组分对一定波长光的吸收程度,以确定被测物质含量的方法。理论依据为光的吸收定律,相对难度适中。对于已有数学计算能力、一定的无机、有机化学、化学分析基础的学生来说学习这部分知识并不吃力,中职学生除了要求有一定的理论知识基础外,实践操作能力同样重要,甚至更重要,因此给学生创造更多的实操机会,强化其动手能力,并根据所得数据进行分析得到准确的结论尤为关键。
2 课程设计
2.1 理论教学
采用传统板书教学与PPT 相结合的模式,对于光的吸收定律部分采用传统教学模式,而讲解分光光度计结构时,为了能让学生较为直观地认识其内部结构,采用PPT 教学。
2.1.1 光的吸收定律
如图1 所示,当一束平行的单色光通过均匀的有色溶液时,光的一部分被吸收池表面反射回来,一部分被溶液吸收,一部分透过溶液。
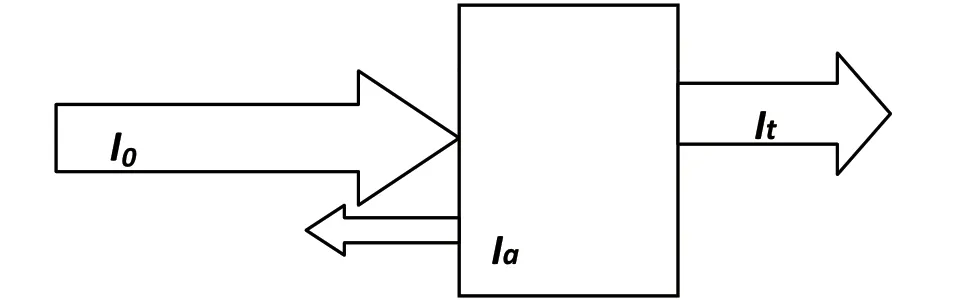
图1 平行光照射有色溶液示意图
关系为:

式中:I0为入射光强度;It为透射光强度;Ia为反射光强度;Ir为吸收光强度。
反射光强度基本不变,其关系可简化为:

透光率:透射光强度It与入射光强度I0之比,用T 表示。

溶液透光率的倒数反映了溶液对光的吸收程度,与溶液浓度、液层厚度和入射光波长有关。表达式为:
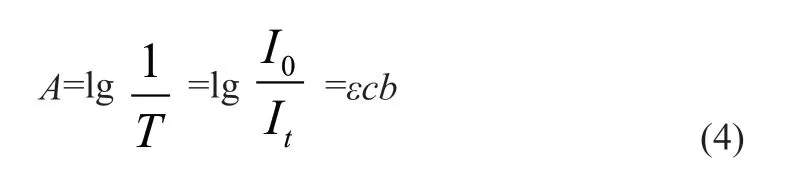
式中:A 为吸光度; ε 为摩尔吸收系数(L/mol·cm); c 为溶液物质的量浓度(mol/L)”;b 为液层厚度(cm)。
物质对光的选择吸收特性可以用吸收曲线来描绘。让不同波长的光通过一定浓度的溶液,分别测出各个波长的吸光度。发现任何一种溶液在特定的波长吸光度有一个峰值,称为最大吸收波长,用λmax 表示。不同浓度的同种溶液最大吸收波长的位置不变,只是吸收峰的高度随浓度的增大而增大,因此可作为定量分析的依据。
2.1.2 分光光度计结构
(1)光源:光源的作用是提供符合要求的入射光。光源必须有足够的输出功率和稳定性。常用的光源有钨丝白炽灯提供的可见光,氢灯或氘灯提供的部分的紫外光源(波长范围为200~350 nm)。为了保证发光强度稳定,也要用稳压电源供电。
(2)单色器:单色器是由色散元件、狭缝和透镜系统的作用组成的。能把复合光变成各种波长单色光的器件称为色散元件。狭缝和透镜系统的作用是调节光的强度,控制光的方向并取出所需波长的单色光。经典的单色器是用棱镜作色散元件,它是根据光的折射现象进行分光。
目前的单色器用光栅作色散元件。光栅是在玻璃表面刻上等宽度等间隔的平行条痕,当平行光照射到光栅上,由于光栅的衍射作用,反射处理的光就按波长顺序分开了,只要设定好所需波长,就能自动转换光栅,调整到所需的波长。
(3)吸收池:盛装被测溶液的吸收池由透明的材料制成。它有两个互相平行而且距离一定的透光平面,侧面和底面是毛玻璃。吸收池是单色器与信号接收器之间光路的连接部分。它的作用是让单色器全部进入被测溶液,并且从被测溶液出来的光进入检测器。
(4)检测器:检测器是光电转换器。光电转换器的响应必须是定量的;对光线波长的响应范围要宽、灵敏度要高、速度要快、稳定性要好。常用的光电转换器有光电池、光电管、光电倍增管、光导管与二极管阵列。
(5)信号显示及数据处理:由检测器将光信号转换为电信号后,可用检流计、微安表、记录仪、数字显示器或阴极射线显示器显示和记录测定结果。
2.2 实操教学
把学生分为4 个测定小组,扮演成水质化验员,通过查找资料得到三种测定方案:(1)利用铁离子测定仪进行分析测定;(2)利用Fe3+氧化Cu,通过Cu 反应前后质量的变化进行测定;(3)利用邻菲啰啉与Fe2+反应生成配合物用分光光度计测定吸光度,进而得到其浓度数值。
小组讨论对比各种测定方法的优缺点,方案一可在测定出水中铁含量数值后使用测定仪检测结果的可靠性;方案二中Fe3+氧化Cu 反应速度太慢,且反应不彻底,不能用于浓度低的铁含量的测定;方案三邻菲啰啉与亚铁反应生成红色配合物,反应速度快,logK稳=21.3,即K稳=1021.3,转化率极高,可最终确定用亚铁离子和配位剂邻菲啰啉反应,生成有色配合物后采用分光光度法测定吸光度,制成工作曲线后,通过对比查出自来水中铁含量。方法确定后,通过查找资料得到邻菲啰啉分光光度法测定铁离子含量方法的具体过程。涉及到的反应式为:
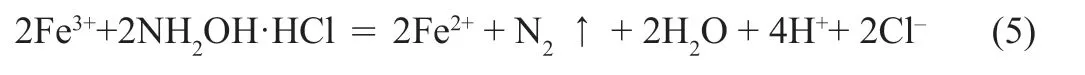
铁离子被还原剂盐酸羟胺还原成亚铁离子,亚铁离子与邻菲啰啉反应,酸度控制在2~9 为宜,生成稳定的橙红色螯合物。
2.2.1 最大吸收波长的确定
由小组协作完成,改变吸收波长,测定同一浓度铁与邻菲啰啉生成配合物的吸光度,最终确定最大吸收波长为508 nm。
2.2.2 实验用品
(1)实验器皿
721 分光光度计(50 mL 比色管、1 cm 吸收池)、电子分析天平、酒精灯、滴管、容量瓶(1 000、250 mL)、锥形瓶(100 mL)、铁三角(石棉网)、移液管(1、10 、25、50 mL)、量筒(10 mL)、玻璃棒、烧杯(150 mL)。
(2)实验药品
邻菲啰啉(1 g/L)、12 结晶水硫酸铁铵(分析纯)、盐酸羟胺(100 g/L)、NH3- NH4Cl 缓冲溶液(pH=8)。
2.3 测定步骤:标准曲线的绘制
(1)铁标准溶液的配制(100 μg/mL)
用分析天平准确称取0.863 g硫酸铁铵[NH4Fe(SO4)2·12H2O],溶于水后转入1 000 mL 容量瓶中,稀释后初步混匀,再加水至接近刻度线,定容,摇匀。
(2)铁标准溶液的配制(10 μg/mL)
用25 mL 移液管移取25.00 mL 100 μg/mL 的铁标准溶液于250 mL 容量瓶,加水稀释至刻度,混匀。
(3)绘制工作曲线
取50mL比色管8支,分别加入铁标准溶液0.00、0.25、0.50、1.00、2.00、3.00、4.00、5.00 mL,各加1+1 盐酸2 mL,1 mL 盐酸羟胺,0.5 mL 邻菲啰啉,3 mL NH3-NH4Cl 缓冲溶液,加水稀释至刻度,静置10 min,在510 nm 处测吸光度,记录数据。以50 mL溶液含铁量为横坐标,对应的吸光度为纵坐标,绘制标准曲线。
(4)生活饮用水铁含量的测定
移取50.00 mL 水样于100 mL 锥形瓶中, 1 mL 盐酸羟胺,小火煮沸10 min,冷却至室温,转入比色管中,0.5 mL 邻菲啰啉,3 mL NH3-NH4Cl 缓冲溶液,加水稀释至刻度,静置10 min,测吸光度。
小组协作通过查阅资料,懂得如何利用分光光度计测定物质吸光度。在实操过程中,强化利用分析天平称量物质质量、使用容量瓶进行标准溶液配制、利用移液管移取一定量溶液等基本分析操作技能。
3 组内自评、组间互评
组内评价操作不规范、违反操作规程、需要改进的地方。强化化验常规器皿的操作,并熟练分光光度计的使用。小组协作完成数据处理,绘制吸光度曲线。
4 结语
先以提问的方式由学生阐述本次课掌握的知识点。对于掌握不准确的地方,小组讨论后,由教师重点讲解。
理实一体化教学突出了学生学的主体地位,让他们充分参与到课堂教学中,调动了学生学习的主动性,一体化教学实际上对教师的要求更高了,教师要提高职业修养和道德素养。课下教师应准备各种材料,使之更适应不同层次学生的需要,使材料更具有逻辑性、趣味性、生活化,课上认真组织学生进行有效的学习,并注重学习结果的反馈与反思。
