高压静电场胁迫对各代麦长管蚜体重及抗氧化酶基因表达的影响
2021-05-14孔艳艳赵惠燕
孔艳艳,赵惠燕
(西北农林科技大学植物保护学院,陕西杨凌 712100)
地球上存在的静电场与生物的生长发育密切相关,近年,随着各类高压电力工程建设的增加以及高压静电场在农业领域(如静电喷雾、静电保鲜、静电育种)等方面的应用,高压静电的增强是否会对生物的生长发育产生影响引起研究人员的重视(Murr, 1966; 吴春艳等, 2004; Zhaoetal., 2011)。众多学者从农业领域开展高压静电剂量以及正负生物效应的研究,以期探究出高压静电在农业生产中所能产生的最大生物学效应(王淑惠等, 1991; Schmiedchenetal., 2018)。昆虫方面的研究表明蟑螂Periplanetaamericana和果蝇Drosophilamelanogaster在高压静电场的影响下,其运动能力发生改变(Jacksonetal, 2011; Newlandetal, 2015);蜜蜂Apismellifera、竹节虫Carausiusmorosus和黄蜂Vespulavulgaris在静电场环境下其耗氧量和取食量均有所增加(Altmann, 1974);蚕卵Bombyxmori早期经高压静电处理后蚕卵孵化期延长,孵化整齐度提高,蚕蛹重量增加(巨云为等, 2010)。
麦长管蚜Sitobionavenae(Fabricius)是麦类作物上的重要害虫,在农业生产研究中具有重要意义;且具有R对策者的显著特点,能较快的对环境变化做出反应,多以无翅孤雌繁殖方式为主,是研究环境胁迫下种群遗传进化的首选实验材料。本团队前期首先从在生态学领域入手,研究表明高压静电处理小麦种子或麦长管蚜都能够间接或直接的影响麦长管蚜生长发育、繁殖力、存活率及种群动态增长(李广雨等, 2016; Luoetal., 2016)。对昆虫个体来说,高压静电场的变化形同一种环境胁迫因子,势必会导致生物体内活性氧(ROS)的产生(李达圣等, 2001; 贺曾等, 2010)。而超氧化物歧化酶(SOD)、过氧化氢酶(CAT)和过氧化物酶(POD)正是生物体内关键的抗氧化酶(Felton and Summers, 1995; Sies, 1995),且酶活力以及基因表达水平的变化不仅反映出生物体受损伤的程度,也体现出生物体对环境胁迫的防御机制(Henkle-Duhrsen and Kampkotter, 2001; 郭洪亮等, 2005; 章轶锋等, 2008)。曹祝等曾对经高压静电处理后的麦长管蚜的抗氧化酶(SOD、POD、CAT)进行活性测定,结果发现其活性变化受高压静电影响显著(曹祝等, 2016)。叶家明等从分子水平上研究高压静电的生物学效应,发现高压静电能够引起染色体畸变(叶家明等, 1985),因此本研究推想麦长管蚜受到高压静电胁迫后是否会影响到其抗氧化酶基因表达水平上的变化,以及麦长管蚜随世代的增加是否会在基因水平上对高压静电场环境产生防御能力。
基因转录调控水平的变化可作为研究遗传进化的有力机制和证据(Dabornetal., 2002; Nicolasetal., 2005)。为了探究这一科学问题,本研究测定了受高压静电胁迫后多世代麦长管蚜4种抗氧化酶基因(CuZnSOD、MnSOD、CAT、POD)转录水平的变化,并通过测定高压静电胁迫后各世代麦长管蚜体重增长率的变化加以佐证,以期为探究麦长管蚜对静电胁迫的防御机制和研究昆虫生态适应及遗传进化提供理论依据。
1 材料与方法
1.1 供试材料
供试虫源:将田间(37°14′ N, 108°04′ E)采集而来的1头无翅孤雌麦长管蚜,饲养在寄主小麦上无性繁殖3~4代,获得单克隆种群。饲养条件如下:温度20±0.5℃;相对湿度60%±10%;光周期16 L ∶8 D、光强3 000 lx(孔艳艳, 2019)。
供试小麦:品种为矮抗58,由农学院小麦遗传育种实验室提供。
1.2 试验方法
1.2.1高压静电场处理
本研究团队前期利用不同剂量高压静电对麦长管蚜进行生长发育、种群参数及抗氧化酶活性等研究,各项指标研究中每个处理均测定60头蚜虫,结果证明4 kv/cm强度的高压静电场下处理20 min(4 kv/cm-20 min),5 kv/cm强度的高压静电场下处理40 min(5 kv/cm-40 min)对麦长管蚜生理指标影响最大(李广雨等, 2016; 曹祝等, 2016; Heetal., 2016),因此本研究选取这两个不同的高压静电处理剂量进行进一步分析。选取籽粒饱满、大小一致的小麦种子和出生12 h内的若蚜,利用高压静电发生器(BM201)进行4 kv/cm-20 min,5 kv/cm-40 min两种剂量高压静电场的处理,将未利用高压静电发生器处理的小麦种子和麦长管蚜作为对照研究。
1.2.2高压静电处理后的小麦培养和蚜虫饲养
经不同处理后的小麦种子分别种植在14.8 cm×12.2 cm×9 cm的塑料花盆中,以营养土为基质,生长条件同1.1。依据小麦生长需求定量浇水,麦苗长至14日龄备用。按1.2.1中方法处理后的若蚜与小麦幼苗按不同处理剂量对应接种,每个世代进行同样处理,至第40代。
1.2.3麦长管蚜相对日均体重增长率(MRGR)的测定
当高压静电处理至第5代、10代、20代、27代、33代、39代时,根据胡想顺等(2004)方法进行相对日均体重增长率的测定,用超微量天平(METTLER-TOLEDO XS3DU)进行称重,每个处理剂量测定60头蚜虫。MRGR计算公式为:
MRGR=(lnW2-lnW1)/DT
1.2.4麦长管蚜4种抗氧化酶基因的引物设计
利用NCBI搜索豌豆蚜Acyrthosiphonpisum、桃蚜Myzuspersicae、高粱蚜Melanaphissacchari、柑橘木虱Diaphorinacitri和褐飞虱Nilaparvatalugens的CuZnSOD基因和MnSOD基因,比对出氨基酸保守区域,利用CODEHOP在线软件(http://blocks. fhcrc.org/codehop.html)设计简并引物(黄菁等, 2002);麦长管蚜的CAT和POD基因片段扩增引物参考Dengetal.(2014, 2016),所设计引物如表1所示。

表1 PCR引物序列
1.2.5RNA提取、RT-PCR扩增及基因克隆
采用Trizol试剂法(TIANGEN,北京)提取总RNA,利用1%琼脂糖凝胶电泳和紫外分光光度计检测RNA质量和浓度。然后按照反转录试剂盒(PrimeScriptTMRT reagent Kit with gDNA Eraser (Perfect Real Time)(RR047A))说明书合成cDNA第一链。
以合成的cDNA为模板进行PCR扩增。反应体系(20 μL):2 x SINGKE Master Mix 10 μL、上游/下游引物各1 μL、cDNA模板2 μL,ddH2O 6 μL。反应程序如下:
CuZnSOD:94℃ 4 min;94℃ 30 s,64~54℃ 45 s(每循环2次退火温度降低2℃),72℃ 1 min,10个循环;94℃ 30 s,54℃ 45 s,72℃ 1 min,40个循环;72℃ 10 min;4℃保存。
MnSOD:94℃ 5 min;94℃ 30 s,66~60℃ 45 s(每循环1次温度降低2℃),72℃ 1 min,4个循环;94℃ 30 s,60℃ 45 s,72℃ 1 min,40个循环;72℃,10 min;4℃保存。
CAT和POD:94℃ 4 min;94℃ 30 s,65~55℃ 45 s(每循环1次温度降低1℃),72℃ 1 min,10个循环;94℃ 30 s,55℃ 45 s,72℃ 1 min,40个循环;72℃,10 min;4℃保存。
2%琼脂糖凝胶电泳对PCR扩增产物进行检测,采用胶回收试剂盒(TIANGEN,北京)纯化回收DNA,回收产物连接到pMDTM19-T载体上,转化至DH5α大肠杆菌感受态细胞。蓝白斑法筛选阳性克隆,每个基因选择不少于3个阳性克隆送至天润奥科生物科技有限公司进行测序。
1.2.6荧光定量PCR
分别取1.2.2中处理至第4代、11代、21代、31代、40代的麦长管蚜3日龄成虫各20头,按1.2.5中方法提取总RNA,用去除植物基因组DNA的反转录试剂盒(TAKARA,RR047A)合成cDNA,每个处理设置3个生物学重复。根据1.2.5中获得的基因片段设计荧光定量PCR引物(表1)。选取核糖体蛋白L7(RPL7)基因作为内参基因(Dengetal., 2016),使用ABI QuantStudio 7 flex实时定量PCR仪,按照相对实时定量TB Green嵌合荧光法(TAKARA,大连)说明书进行基因表达量测定。反应体系(20 μL):2×TB Green Premix Ex Taq II(Tli RNaseH Plus)10 μL、上下游引物(10 μM)各1 μL、cDNA模板2 μL,ROX Reference Dye II(50×)0.4 μL, ddH2O 5.6 μL。反应程序:95℃ 30 s,95℃ 5 s,54℃ 35 s(4个基因均为54℃),40个循环;溶解曲线阶段为:95℃ 15 s,60℃ 1 min,95℃ 15 s。用2-△△Ct的方法计算基因的相对表达量(Deng, 2016)。计算公式为:相对转录水平=2-△△Ct△△Ct=(Ct目标基因-Ct内参基因)样品-(Ct目标基因-Ct内参基因)对照
1.3 数据分析
不同剂量强度的HVEF对麦长管蚜连续处理40代,以高压静电的处理剂量和不同处理世代为因子,利用SPSS 21.0软件对4种抗氧化酶基因相对表达水平进行双因素方差分析;对同一世代不同剂量下和同一剂量不同世代间4种抗氧化酶基因的相对表达量数据和MRGR数据进行单因素方差分析。不同处理间采用Student-Newman-Keuls (SNK)法进行多重比较,显著性差异水平P<0.05。
2 结果与分析
2.1 麦长管蚜相对日均体重增长率的变化
高压静电处理条件下麦长管蚜的相对日均体重增长率随世代的增加呈现先升高后降低的趋势,在第5代和39代时增长率低于对照组,其余世代下均高于对照组,且在第20代和第33代与对照组差异显著。在第39代4 kv/cm-20 min处理剂量的高压静电使麦长管蚜的增长率抑制作用更明显(图1)。

图1 不同剂量HVEF辐射对各世代麦长管蚜MRGR参数变化Fig.1 MRGR of Sitobion avenae at two HVEF treatment levels in succeeding generations注:同一世代不同处理间差异显著性用小写字母表示,同一处理不同世代间差异显著性用大写字母表示(P<0.05)。下图同。Note: The values were presented as means±SE, lower letters a, b, c indicated the significant difference in different treatments, while upper letters A, B, C indicated the significant difference in different generations (α=0.05, SNK test).The same below.
2.2 麦长管蚜四种抗氧化酶基因的扩增结果及序列分析
简并引物(CuZnSOD-F/R,MnSOD-F/R)扩增得到261 bp的CuZnSOD和319 bp的MnSOD的特异性条带,与目标条带大小相符(图2)。经测序得到这两个基因的核苷酸序列,并推导出其氨基酸序列,Blast比对发现克隆片段与Genbank中豌豆蚜该基因的同源性高达99%以上,证明扩增得到麦长管蚜的CuZnSOD和MnSOD基因的部分序列,可用于后续基因相对表达量的检测。
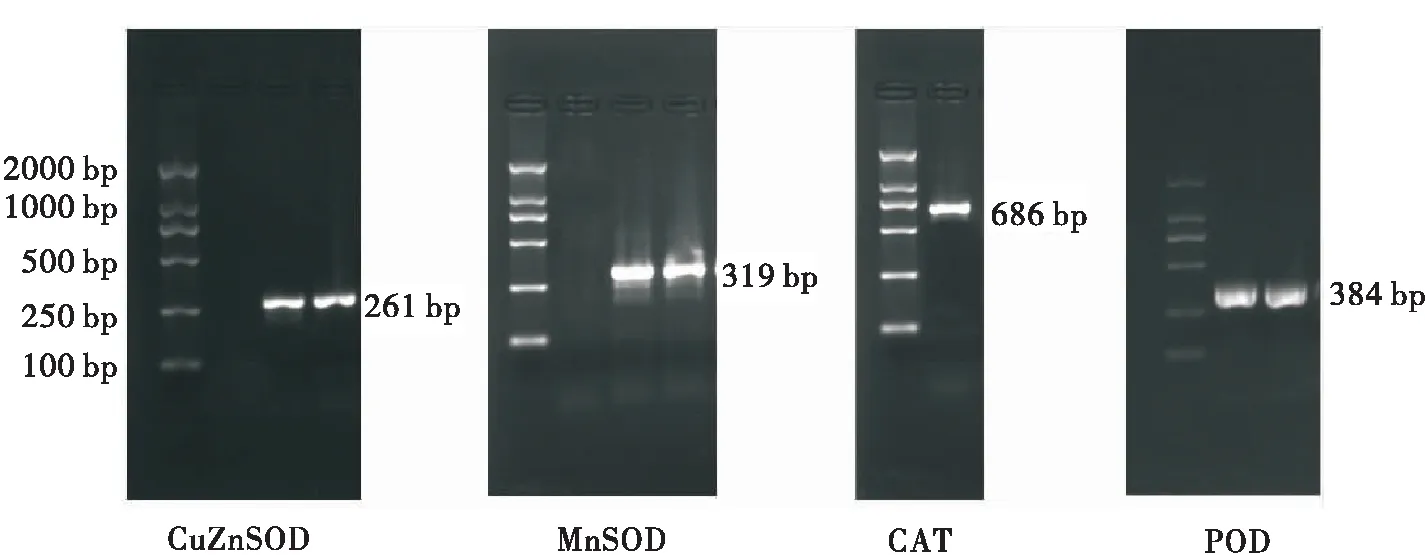
图2 麦长管蚜4种抗氧化酶基因PCR产物的电泳结果Fig.2 Result of PCR amplification of four antioxidant enzyme genes from Sitobion avenae
2.3 抗氧化酶基因相对表达水平
2.3.1不同剂量HVEF辐射下麦长管蚜各世代CuZnSOD基因的表达模式
不同HVEF剂量和不同世代下麦长管蚜CuZnSOD基因相对表达量存在差异(图3)。4 kv/cm-20 min辐射剂量下,CuZnSOD基因的表达量在第31代下调到最低值,而在40代时显著上调。随着世代的增加,5 kv/cm-40 min剂量下麦长管蚜CuZnSOD基因表达总体呈反抛物线型。在第4代和40代,与对照组相比,5 kv/cm-40 min剂量下麦长管蚜CuZnSOD基因的表达显著上调;而在第11~31代基因表达呈下调模式。同一世代不同处理间相比,在21代和31代,5 kv/cm-40 min剂量下CuZnSOD基因表达显著低于对照组和4 kv/cm-20 min处理组。同样在第31代,其表达量达到最低点,而在40代又显著上调。推测第31代至40代是麦长管蚜受高压静电辐射后产生变化的关键世代。
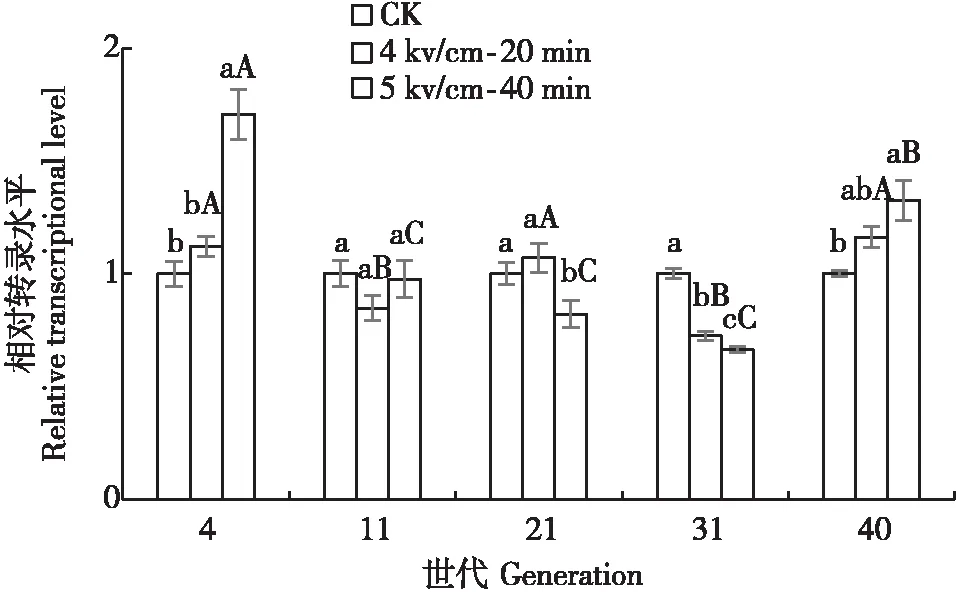
图3 不同剂量HVEF辐射后各代麦长管蚜CuZnSOD基因的相对转录水平Fig.3 Relative expression of CuZnSOD gene of Sitobion avenae at different generations exposed to HVEF
2.3.2不同剂量HVEF辐射下麦长管蚜各世代MnSOD基因的表达模式
从不同世代分析来看,4 kv/cm-20 min剂量的高压静电处理至第40代时,MnSOD表达开始变化,呈显著上调模式(图4)。5 kv/cm-40 min剂量的高压静电胁迫后,MnSOD基因表达模式类似于CuZnSOD基因表达模式即两端高、中间低趋势,即在第4代和第40代时麦长管蚜MnSOD基因表达显著上调;中间世代中MnSOD基因表达变化不显著、与对照也无差异。MnSOD基因与CuZnSOD基因表达的差异可能是两者协同发挥作用。
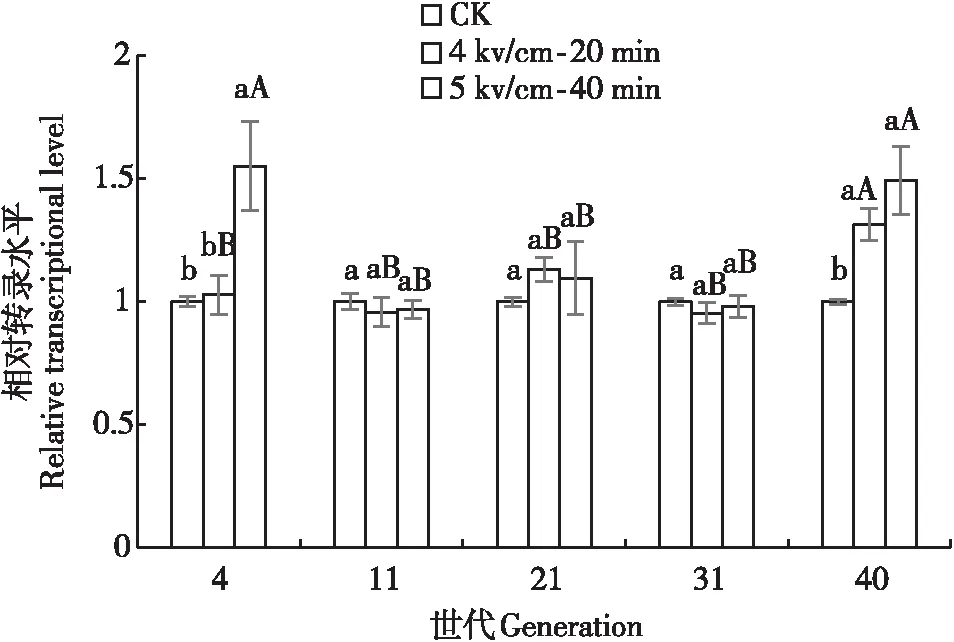
图4 不同剂量HVEF辐射后各代麦长管蚜MnSOD基因的相对转录水平Fig.4 Relative expression of MnSOD gene of Sitobion avenae at different generations exposed to HVEF
2.3.3不同剂量HVEF辐射下麦长管蚜各世代CAT基因的表达模式
经不同剂量高压静电处理后各世代麦长管蚜CAT基因表达也表现出差异(图5),高压静电处理至第4代时,麦长管蚜CAT基因的表达上调,但与对照组差异不显著。第4代以后,两处理剂量下的麦长管蚜CAT基因的表达量均呈下调模式,连续胁迫至第11、31、40代其表达量下调水平与对照相比差异显著。前人对CAT酶活性的测定得到相似的结果,经高压静电胁迫后,各代麦长管蚜的CAT酶活性均受到抑制(Luoetal., 2019)。推测这有可能是因为静电胁迫条件下阻碍了CAT清除蚜虫受静电胁迫直接产生的大量H2O2,也可能阻碍CAT清除来自SOD作用后产生的H2O2,具体机制有待于进一步证明。

图5 不同剂量HVEF辐射后各代麦长管蚜CAT基因的相对转录水平Fig.5 Relative expression of CAT gene of Sitobion avenae at different generations exposed to HVEF
2.3.4不同剂量HVEF辐射下麦长管蚜各世代POD基因的表达模式
对不同处理剂量下各世代麦长管蚜POD基因表达量进行测定,结果表明(图6),随世代的增加,高压静电辐射下麦长管蚜POD基因的表达也表现出反抛物线趋势,在第4代和第40代,两种处理剂量下麦长管蚜POD基因表达均显著上调;而第11代和31代时,POD基因表达显著下调。不同处理间相比,5 kv/cm-40 min处理组在第4代达到最高值,说明短期内麦长管蚜对高剂量HVEF辐射更敏感。而4 kv/cm-20 min处理组在第40代表达量达到最高值,说明该强度下高压静电累积作用能对麦长管蚜POD基因产生严重影响。

图6 不同剂量HVEF辐射后各代麦长管蚜POD基因的相对转录水平Fig.6 Relative expression of POD gene of Sitobion avenae at different generations exposed to HVEF
2.3.5不同剂量HVEF和不同处理世代对基因表达水平的主体间效应检验
将不同剂量HVEF(4 kv/cm-20 min,5 kv/cm-40 min)和处理世代(第4,11,21,31,40代)作为两种影响因子,对其进行双因素方差分析(如表2)。主体间效应检验结果表明,HVEF处理剂量、不同世代两种因素对麦长管蚜四种抗氧化酶基因表达的影响具有交互作用。根据各偏差平方和占总偏差平方和的比例表明,世代变化对麦长管蚜抗氧化酶基因的影响更显著,说明受高压静电处理后麦长管蚜在随世代变化过程中自身机制也发生着改变,这对后代麦长管蚜应对高压静电胁迫能力起着关键作用。
3 结论与讨论
本研究结果表明,不同世代麦长管蚜对高压静电胁迫具有不同的应对能力,且具有一定的规律性。主要表现在以下两点:麦长管蚜受到不同剂量高压静电长期胁迫后体内4种抗氧化酶基因表达量的发生改变:CuZnSOD、MnSOD、POD3种抗氧化酶基因均在第4代和第40代上调,第11~31代基因表达不显著或呈下调模式;从生长发育方面来看,其相对日均体重增长率呈现先增高后降低的趋势,在第5代和第39代低于对照组,中间世代高于对照组。从宏观体重增长变化以及微观基因表达水平上探究出高压静电胁迫后麦长管蚜在世代进化中的变化规律,为进一步探究其防御机制和对生态胁迫的遗传进化研究提供参考。
正常情况下,SOD、POD、CAT基因的表达生物体生长发育和寿命是至关重要的,研究表明将POD和CAT酶基因沉默后,对麦长管蚜的生长发育均呈现抑制作用(Deng and Zhao, 2014; Dengetal., 2016)。然而,大量研究也表明抗氧化酶基因能被许多环境胁迫因子诱导,例如紫外线辐射、重金属、农药、高温等(Yongetal., 2012; 郑玉涛, 2015; Alietal., 2017),因此抗氧化酶的过量表达印证了昆虫此时正受到不利因素的胁迫。本研究中,经短期高压静电胁迫后,在第4代4种抗氧化酶基因均呈现上调模式;第5代对中麦长管蚜MRGR相对也较低,这两种指标均说明麦长管蚜在第4~5代中受到高压静电胁迫比较严重。Luoetal.(2019)研究表明,4 kv/cm-20 min处理剂量下SOD和POD酶活性在第2~6代间均呈升高趋势,也印证了这一观点。推测可能是由于高压静电场作用初期,生长环境条件的突然改变使蚜虫体内产生了大量O-2,SOD作为保护酶,受诱导后大量表达以消除体内的超氧自由基,POD也相应的发挥作用,一方面清除蚜虫受静电胁迫直接产生的大量H2O2,另一方面清除来自SOD作用后产生的H2O2(Cross and Jones, 1991; 李毅平和龚和, 1998; Mates, 2000)。
随着世代的延长,CuZnSOD基因及CAT基因的表达开始下调。姚立虎等(2009)在研究紫外线辐射胁迫时发现,短时间紫外线辐射下,柞蚕Antheraeapernyi体内CuZnSOD基因表达上调;而随辐射时间的延长,CuZnSOD基因的表达呈下调模式,这与本研究结果相类似。说明前期麦长管蚜通过抗氧化酶基因表达及酶活性的升高,清除了高压静电激发氧化胁迫的毒害作用。除此之外,昆虫还具有复杂的生理代谢机制,包括与各类代谢途径、线粒体内能量传递链、细胞结构等其相关的酶(解毒酶、保护酶等)、基因变异等的变化(Nguyen, 2009)。面对环境胁迫,生物体也会激发其他途径进行调节,极端情况下基因也会发生异位、突变等不断进化来适应新环境。因此麦长管蚜经过一定阶段的适应,在第10代之后,其抗氧化酶基因表达水平恢复正常,相对日均体重增长率也有所升高。
高压静电场的生物效应具有累积性的特点。当麦长管蚜经高压静电持续处理至40代时,静电场累积胁迫超过麦长管蚜的承受范围,因此导致麦长管蚜在此阶段生长发育受到严重影响,相对日均体重增长率显著降低,激发抗氧化酶基因的表达来应对环境胁迫。本研究中通过不同世代与不同剂量高压静电对麦长管蚜基因表达水平的双因素分析结果表明,世代变化是抗氧化酶基因的表达的主要影响因素,证明麦长管蚜随世代变化对高压静电具有抵御和适应的生理机制,其中抗氧化酶在其中发挥一定作用。
本研究进一步表明高压静电场具有剂量性等生物学效应的特点,不同强度高压静电处理下对麦长管蚜产生的胁迫作用不同(张俐等, 2000; 那日和冯璐, 2003; 陈建中等, 2015)。本研究对麦长管蚜在应对静电胁迫时4种抗氧化酶基因表达规律研究发现,5 kv/cm-40 min处理下,麦长管蚜在短世代内呈现频繁的上调和下调模式,可能是由于该剂量强度胁迫下蚜虫对于5 kv/cm-40 min剂量的高压静电处理防御及应对能力更强。而在4 kv/cm-20 min处理剂量下,麦长管蚜相对日均体重增长率在40代达到最低,且该剂量下,SOD和POD基因的表达水平仅在39代显著增高,说明4 kv/cm-20 min处理剂量有较强的世代累积毒性。曾有研究表明高压静电处理麦种使幼苗中氨基酸、糖类等营养物质成分含量增高(王淑慧等, 1990),推测5 kv/cm-40 min剂量下寄主植物中营养成分的变化也是导致该强度下麦长管蚜防御及应对能力更强的原因之一,将通过麦长管蚜取食行为研究进一步验证。
高压静电胁迫下,随世代延长麦长管蚜抗氧化酶基因表达存在差异,证明麦长管蚜对高压静电场胁迫有一定的调整适应和再防御的规律。本实验初步从抗氧化酶基因转录水平来探究高压静电长期辐射下麦长管蚜随世代的变化规律及应对表现,那么胁迫条件下麦长管蚜势必有更多的生理途径相互作用参与应对环境胁迫,以及蚜虫是否通过遗传变异来适应新环境将在以后的研究中进一步验证。
