基于临床试验信息分析冠心病心绞痛中药新药研发特点和趋势
2021-05-13李国政
肖 扬,李国政,刘 莹
(天津中医药大学第二附属医院药学部1,中医经典病房2,天津 300000)
冠心病心绞痛(angina pectoris of CHD)是由于冠状动脉粥样硬化和冠状动脉功能性改变(痉挛)导致心肌暂时性缺血、缺氧而引起的发作性胸痛或胸部不适为主要表现的临床综合征,属于中医学“胸痹”“心痛”范畴。中药作用具有多靶点、多环节特点,在整体观念与辨证论治的指导下,能够改善冠心病患者的症状,延缓和阻止病变发展,提高临床疗效[1-3]。心脑血管疾病是中医药治疗的优势领域,因此也产生了大量的治疗心脑血管疾病的中成药,《中药大品种科技竞争力报告》(2019 版)中纳入的579 个产品中有117 个品种是心脑血管疾病用药[4]。目前治疗冠心病心绞痛的中成药品种较为丰富[5]。有研究[6]曾对1988 年~2003 年批准的113 个治疗冠心病的中药新药进行分析,指出有些新药不新,作用不显著,特点不突出,特别是用于危急重症的强效、速效急救药尚不理想,理想的首选药还不多见。为了规范冠心病心绞痛中药新药的研发,2011 年7 月20 日由国家食品药品监督管理局颁布了《中药、天然药物治疗冠心病心绞痛临床研究指导原则》,指出中成药治疗冠心病心绞痛的主要目的有迅速缓解心绞痛急性发作,减少心绞痛的发作频率、减轻疼痛程度,改善相关症状和中医证候,预防心肌梗死等心血管事件发生。其根本目的是提高患者生存质量、延长生存期、提高生存率[7]。本文主要CDE 平台登记的中药治疗冠心病心绞痛的临床试验分析,以期为今后治疗冠心病心绞痛中成药的研发与临床试验设计提供新的思路。
1 资料与方法
1.1 数据来源 2020 年10 月1 日,登录国家药品监督管理局药品审评中心的“药物临床试验登记与信息公示平台”(http://www.chinadrugtrials.org.cn/eap/main),在高级检索模式下,适应症一栏输入“心绞痛”,药物类型一栏选择“中药/天然药物”,试验状态选择“所有状态”。收集有关冠心病心绞痛中药研发的相关临床试验。
1.2 方法 由2 位研究者提取登记号、药品名称、研究分期、样本量、纳入受试者特点(年龄、CCS 分级、心绞痛发作次数、心绞痛类型、中医辩证等)、对照设计、疗程、疗效评价指标等数据,对其基本信息、人群特征、试验设计和疗效评价进行分析,总结该领域中药新药研发特点和趋势。
1.3 统计学方法 本次研究数据纳入Excel 中建立数据库,对所有数据进行描述性分析。
2 结果
2.1 登记项目基本信息 登记的54 项临床试验中有1 项临床试验申请主动终止后又重新启动另1 项试验,因此剔除该项试验,最终纳入53 项临床试验。从2013 年起至2019 年,每年都有冠心病心绞痛中药新药临床试验登记,每年登记数目见图1。53 项临床试验共有40 个试验药物,其中Ⅰ期临床试验有15项,26 项Ⅱ期试验,包括Ⅱa 期的有3 项,Ⅱb 期的有4 项,Ⅱc 期的有1 项;Ⅲ期临床试验有10 项,Ⅳ期临床试验有2 项。40 个试验药物中,有10 个品种处于Ⅰ期临床试验阶段,18 个品种处于Ⅱ期临床试验阶段,10 个品种处于Ⅲ期临床试验阶段,其中心达康胶囊为已上市药品开展增大剂量的研究,2 个项目为上市后Ⅳ期临床试验。药物剂型包括注射剂、胶囊、片剂、滴丸剂和颗粒剂,见表1。

图1 历年登记临床试验项目数量

表1 试验药物剂型与数量
2.2 研究人群特征
2.2.1 年龄分布 对除Ⅰ期外的38 个临床试验的研究人群特征进行分析:受试者入组年龄在18~80岁,大多数研究的年龄在30~40 岁,年龄上限为65岁的试验有9 项,上限为70 岁的试验有24 项,上限为75 岁的试验有3 项,上限为80 岁的试验有2 项。
2.2.2 中医证型分布 38 个临床试验共涉及30 个试验药物,对受试者纳入标准中的中医辨证分析,共涉及10 个证型,试验药物最多的2 个证型分别是心血瘀阻证和气虚血瘀证,有1 个品种(菊花舒心片)在Ⅱb 期临床试验中进行证候探索,纳入人群包括心血瘀阻证和气虚血瘀证,有1 个品种(人参总次苷口腔崩解片)在Ⅱ期临床试验登记信息中没有对中医证型进行规定,中医证型分布情况见表2。
2.2.3 心绞痛严重程度 38 项试验中,除1 项Ⅲ期临床试验在登记信息的纳入排除标准中没有规定加拿大心血管学会(CCS)外,22 项试验CCS 分级为Ⅰ~Ⅲ级,5 项临床试验CCS 分级为Ⅱ~Ⅲ级,10 项研究的CCS 分级为Ⅰ~Ⅱ级;试验中对受试者心绞痛发作严重程度的入组标准见表3。38 项试验中2 项对心绞痛发作情况没有具体描述,按照心绞痛症状积分入组1 项,1 项仅要求近1 个月内有心绞痛发作史,1 项要求每次发作停止活动或舌下含服硝酸甘油片后5~10 min 内缓解。每周心绞痛发作次数≥2次的临床试验中,1 项进一步要求舌下含服硝酸甘油片(或喷雾吸入)后能在3~5 min 内缓解。
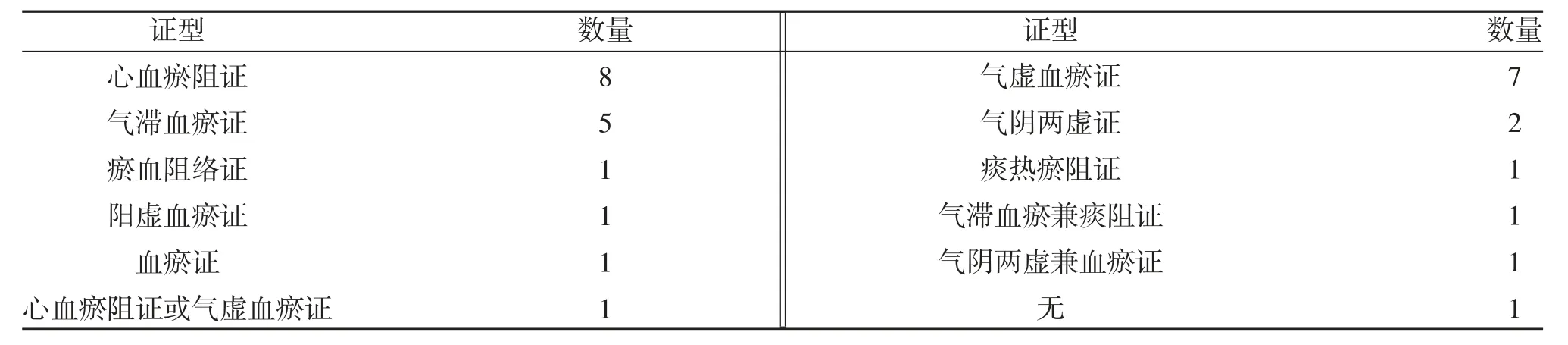
表2 不同中医证型试验药物分布

表3 不同心绞痛发作入组标准试验分布
2.3 试验设计特征 38 项临床试验中,21 项试验为安慰剂对照,14 项研究为阳性药对照,2 项研究为安慰剂与阳性药对照的三臂设计,1 项Ⅳ期临床试验为单臂设计。14 项临床研究进行了剂量探索,试验药物有3 个剂量组的试验有4 项,试验药物有2 个剂量组的试验有10 项,进行剂量探索的研究有2 项分期为Ⅱa 期,有2 项为Ⅱb 期,其余10 项试验分期为Ⅱ期。
2.4 疗效评价 ①设计分析:38 个Ⅱ期、Ⅲ期和Ⅳ期临床试验中,疗程最短1 周,最长12 周,疗程8 周的试验最多,4 周次之,疗程1 周和2 周的均为注射液,各疗程试验项目数和品种数分布见表4。②疗效评价指标:38 项试验中,对疗效评价指标根据观测指标进行分类后,各类评价指标项目数见表5。其中心绞痛症状相关评价指标包括心绞痛疗效(发作次数、严重程度、持续时间)、每周心绞痛发作次数、心绞痛等;硝酸甘油使用相关指标包括每周硝酸甘油使用量、硝酸甘油停减率等;运动平板试验相关指标包括包括总运动时间、代谢当量(METs)、出现ST 段压低1.0 mm 的时间(心前区导联ST 段压低1.0 mm)、心绞痛出现时间、ST 段压低的最大幅度、血压心率乘积(SBP×HR)以及Duke 活动平板评分等;中医症状相关评价指标包括中医证候疗效、中医单项症状疗效等;其他评价指标及项目数为凝血指标2 项、疲乏症状、空腹血糖、单项症状、超声心动图、超敏C反应蛋白各1 项。

表4 不同疗程临床试验分布[n(%)]

表5 38 项临床试验中疗效评价指标分布[n(%)]
3 讨论
从登记项目基本信息分析,2013 年登记的临床试验项目数量较多,原因之一是2013 年国家食品药品监督管理局发布第28 号公告,要求2013 年9 月6 日前尚未完成的临床试验,必须在3 个月内完成登记公示,对于尚未启动开展的试验,则需进行预登记操作,在第1 例受试者入组前完成后续信息登记,并首次提交公示。因此,在2013 年有较多临床试验突击进行登记注册。从2014 年开始,每年登记的冠心病心绞痛中药新药临床试验数量明显下降。
进入Ⅱ期探索性临床试验阶段的18 个品种的26 项研究中,2013 年、2014 年和2016 年分别登记14 项、6 项和3 项,2015 年、2017 年和2019年各登记1 项。进入Ⅲ期确证性临床试验阶段的10 个品种的10 项研究,登记时间分别为2013 年(5 项)、2014 年(4 项)和2015 年(1 项)。可见从2016 年至今,没有新的品种进入Ⅲ期确证性临床试验阶段。
2017 年仅有的1 项临床试验是复方参芎滴丸的Ⅱa 期探索性研究,2018 年仅的1 项临床试验是注射用丹酚酸A 钠的Ⅰ期临床试验,2019 年的3项试验中有2 项为注射用丹酚酸B 和注射用牡荆素的Ⅰ期临床试验,1 项为艾心酮片的Ⅱc 期探索性临床试验。从以上数据可见,2017 年至今新登记开展的中药新药品种只有5 个,且均处于早期研究阶段。
良好的药物剂型能最大限度地发挥药物的疗效和减少不良反应的发生,目前正式生产的中成药剂型约有40 余种。本研究的40 个试验药物中,有注射剂10 种、胶囊9 种、片剂11 种、滴丸剂8 种和颗粒剂2 种。10 种注射剂中,仅有3 种注射液分别在2013 年、2014 年和2016 年登记开展了Ⅱ期临床试验,无品种进入Ⅲ期临床试验,其余均为Ⅰ期临床试验,但在2018 年和2019 年有3 个品种开展Ⅰ期临床试验,说明中药新药治疗冠心病心绞痛的注射剂研究仍是一个热点,但也是难点。对《中国药典》(2010 年)中68 种治疗冠心病心绞痛的中成药分析,片剂有19 种,胶囊剂有17 种,口服液12 种,颗粒剂有9 种,丸剂6 剂,注射液有3 种,滴丸剂2种[8],可见滴丸剂的研发是热点,但对颗粒剂的研发不足。
进入Ⅱ期和Ⅲ期的30 个试验药物以心血瘀阻证(8 个,26.67%)、气虚血瘀证(7 个,23.33%)和气滞血瘀证(5 个,16.67%)为主。《中国药典》(2010年)中68 种治疗冠心病心绞痛的中成药分析,心血瘀阻证的有13 种,气滞血瘀证的有18 种,气虚血瘀证的有15 种,气阴不足血瘀证的有13 种,其他证型的有9 种[8]。柳正植等[9]收集自2000 年~2014 年60项中药临床试验方案分析,以气虚兼其他证候为主的临床试验项目共计22 项(36.7%),心血瘀阻证20项(33.3%),气滞血瘀证7 项(11.67%)。说明近十几年治疗冠心病心绞痛中药新药研究在证型分布上与已经上市的中成药相似。对冠心病患者的证候要素、证候类型的大样本流行病学调查研究发现,5310 例冠心病心绞痛患者中,常见度≥1%的证候类型共有18 个,其中最常见证候类型包括气虚血瘀(14.75%)、气虚痰瘀(11.15%)、气阴两虚血瘀(9.74%)、痰瘀互结(9.17%)等[10],与证型分布相比,占比小的证型的中药新药研究相对较少。
对研究对象的冠心病心绞痛严重程度分析,CCS 分级在Ⅰ~Ⅲ级,大多数试验纳入Ⅰ~Ⅲ级患者(22 项,57.89%),其次是纳入Ⅰ~Ⅱ级较轻的患者(10 项,26.32%),纳入Ⅱ~Ⅲ级较重患者的试验最少(5 项,13.16%)。有研究建议在新药研究中只纳入CCS 分级为Ⅱ级的心绞痛患者,认为CCS 分级为Ⅰ级的慢性稳定型心绞痛病情较轻,不能更好的体现出研究药物的疗效,而CCS 分级Ⅲ级的受试者和其他入选标准存在冲突,也极易发生不良事件,不建议纳入。只纳入CCS 分级为Ⅱ级的心绞痛患者使受试人群的基线更趋向统一,更具有可比性,更有利于得出可靠、可信的临床试验结果[11]。
柳正植等[9]对2000 年~2014 年的60 个试验分析,受试者年龄上限从早期的65 岁或70 岁为主逐渐放宽到75 岁和80 岁。疗程方面,注射液以2 周为主,口服剂型则以4 周为主,从2010 年起疗程为8周的项目开始增加,疗效评价指标中涉及心绞痛疗效的有54 项(90.00%)、心电图和中医证候疗效100.00%,硝酸甘油减停率43 项(71.7%),运动平板试验36 项(60.00%)、西雅图心绞痛量表13 项(21.7%)。在本研究中,患者年纳入龄与上述研究描述相似,疗程以4 周(8 个,21.05%)和8 周(18 个,54.55%)为主,疗效评价指标相似,但运动平板试验和西雅图心绞痛量表的采用率明显上升,这可能与2011 年发布《中药、天然药物治疗冠心病心绞痛临床研究指导原则》中鼓励采用西雅图心绞痛量表和要求进行一定比例的运动平板试验有关,但是关于平板运动试验的安全性、可操作性性、研究者和患者的依从性等是困扰新药研究的难点[12]。临床定位与急性发作的中成药较少[13],但在本研究分析的开展Ⅱ期和Ⅲ期的33 个试验药物中无一定位于迅速缓解心绞痛急性发作。
中医药治疗冠心病具有一定优势,已经上市的治疗冠心病心绞痛的中成药种类繁多。但治疗冠心病心绞痛中成药的研究存在诸多问题,其一是不同中成药的临床定位不清,药物特点不突出,魏鹏路等[14]对中成药价值评估信息数据库中的170 种治疗冠心病心绞痛的中成药分析,共有197 味中药,说明组方各不相同,作用应该各有特点,但根据说明书内容可分为11 个中医证型,同类证型药物的功能主治类似;其二是已开展的中成药临床研究多采用与西药研究相同的疗效评价标准,疗效价指标缺少中医药特色相关指标、长期结局指标等,未能彰显中医药在改善功能状态、提高生活质量、改善远后效应等方面的独特优势[15-18],这两个方面在既往中药新药临床试验和本研究分析的试验中都有集中体现[19,20]。
综上所述,对CDE 登记的中药新药临床试验分析,治疗冠心病心绞痛仍然是中药新药研究的热点之一,但是从纳入排除标准、疗程、有效性评价指标等方面分析,研究设计的相似性很高,既难易差异化的评价不同药物的作用特点,也可能无法彰显中医药治疗冠心病心绞痛的独特优势。期望在以临床价值为导向的研发理念下,无论是中药新药研发还是中成药上市后再评价,都能从研究的顶层设计出发,通过合理的临床设计与疗效评价,体现中药的临床价值与临床优势。
