黄连素通过基因调控对骨肉瘤细胞增殖、凋亡和侵袭的影响
2021-05-12王峰刘国强潘浩季文辉
王峰 刘国强 潘浩 季文辉△
骨肉瘤(OS)是一种起源于间充质细胞的恶性肿瘤[1]。近些年患者的发病率明显降低,然而病人会出现不同程度的远处转移和复发,因此深入探讨骨肉瘤的发病机制至关重要。微小RNA是一类非编码RNA,可以诱导信使RNA的降解和翻译、抑制、调节促癌基因或者抑癌基因的表达,研究表明miRNA-363具有抑制骨肉瘤的作用[2],有文献报道HNF1A-AS1可以通过激活Wnt/β-catenin通路促进骨肉瘤的增殖和转移[3],HNF1A-AS1可以通过靶向调控miRNA实现其促癌作用[4]。黄连素为一种异喹啉类生物碱,能够调节炎性反应和淋巴免疫等,具有抗肿瘤作用,如黄连素可以在体外抑制肝癌的增殖和转移[5]。然而有关黄连素与骨肉瘤之间的关系尚不明了,因此本研究主要分析黄连素通过LncRNA HNF1A-AS1调控miRNA-363对骨肉瘤细胞增殖、凋亡和侵袭的影响。
1 材料与方法
1.1 细胞培养、分组和干预方法
将培养在DMEM中(37 ℃,5% CO2)的处于生长期的U2OS细胞分为对照组、黄连素组、黄连素+HNF1A-AS1组和HNF1A-AS1组。黄连素+HNF1A-AS1组和HNF1A-AS1组转染HNF1A-AS1 pcDNA 3.1质粒,根据制造商的说明转染细胞,以感染复数(MOI)为10的比例加入细胞和质粒载体,在24 h后收集细胞用于后续实验。根据文献[5],黄连素组、黄连素+HNF1A-AS1组在培养基中加入终浓度为100 μmol/L的黄连素,培养48 h。
1.2 主要材料和仪器
人OS细胞系U2OS(ATCC公司,美国);DMEM培养基(Invitrogen公司,美国);HNF1A-AS1过表达质粒以及相应的阴性对照(Negative Control,NC)(Thermo Fisher公司,美国);Lipofectamine 2000(Invitrogen公司,美国);PCR引物由Genewiz公司(中国)设计和合成;Trizol试剂(Invitrogen公司,美国);逆转录cDNA试剂盒和SYBR Green PCR Master Mix qPCR试剂盒(Roche公司,瑞士);MiScript试剂盒和MiScript SYBR-Green PCR试剂盒(QIAGEN公司,德国);细胞计数试剂盒-8(Cell Counting Kit-8,CCK-8)试剂盒和结晶紫染色试剂盒(Beyotime生物技术研究所,中国);凋亡检测试剂盒和FACSCaliburTM流式细胞仪(BD Biosciencesg公司,美国);Transwell小室(Becton Dickinson公司,美国);光学显微镜(奥林巴斯公司,日本);pMIR-REPORT荧光素酶载体(Thermo Fisher Scientific,美国)和分析系统(Promega,美国);双荧光霉素报告基因分析系统(Promega公司,美国)。
1.3 检测指标和方法
1.3.1qPCR检测HNF1A-AS1水平 通过Trizol获得细胞中总RNA并检测浓度和纯度。使用cDNA试剂盒将1 μg RNA逆转录合成cDNA(42 ℃下60 min,70 ℃下5 min,然后4 ℃保存)。使用SYBR Green PCR Master Mix进行qPCR实验(在95 ℃下10 min,40个循环,94 ℃下15 s,60 ℃/1 min,60 ℃下1 min,4 ℃保存)。以GAPDH为内参,通过比较循环阈值分析HNF1A-AS1的表达。
1.3.2CCK-8检测增殖 将100 μL含有1×104个细胞的细胞溶液接种于96孔板,在培养第48 h加入10 μL CCK-8试剂并在37 ℃下孵育10 min,检测通过酶标仪450 nm处的吸光度(OD)值。
1.3.3流式细胞术检测凋亡 将1×106个细胞使用不含EDTA的0.25%胰酶消化,然后分别用预冷的PBS和5%牛血清白蛋白洗涤3次,离心收集细胞(2 000 r/min),加入100 μL结合缓冲液和5 μL的Annexin-V-FITC(20 μg/mL)静置15 min在黑暗中孵化,然后加入150 μL结合缓冲液和10 μL的PI(50 μg/mL)静置15 min在黑暗中孵化,通过FACSCanto Ⅱ流式细胞仪测量凋亡率。
1.3.4Transwell检测侵袭 在Transwell小室的上部腔室和下部腔室中分别添加基质胶和完全培养基,将1×104个细胞在上室中培养48 h,培养过程中有侵袭能力的细胞会进入下室,将侵入的细胞用20%甲醇固定并用0.1%结晶紫染色。统计5个视野中侵入底部室的细胞数目的平均值。
1.3.5qPCR检测miRNA-363b表达 根据1.3.1节的方法获得总RNA,通过MiScript试剂盒合成互补DNA,并将MiScript SYBR-Green PCR试剂盒用于qPCR,使用U6作为内参。
1.3.6双荧光素酶报告验证HNF1A-AS1靶向miRNA-363 将野生型(Wt)/突变(Mut)HNF1A-AS1和miRNA-363模拟物分别克隆到pMIR-REPORT中,然后分别将miRNA-363 NC/mimic以及Wt/Mut-HNF1A-AS1转染进入细胞中,然后使用双荧光霉素报告基因分析系统评估荧光霉素活性。
1.4 统计学方法

2 结果
2.1 黄连素对OS细胞中HNF1A-AS1的影响
由表1可知,黄连素组的HNF1A-AS1水平显著低于对照组,表明黄连素能够抑制OS细胞中HNF1A-AS1表达,差异有统计学意义(t=9.436,P=0.011 0,P<0.05);HNF1A-AS1组HNF1A-AS1水平高于对照组,表明HNF1A-AS1质粒转染成功,差异有统计学意义(t=7.203,P=0.018 7,P<0.05);和黄连素+HNF1A-AS1组比较,黄连素组HNF1A-AS1水平明显降低,HNF1A-AS1组HNF1A-AS1水平明显升高,差异有统计学意义(t=5.085,P=0.036 6,P<0.05),结果表明黄连素能够降低OS细胞内HNF1A-AS1表达。
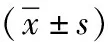
表1 各转染组HNF1A-AS1水平比较
2.2 黄连素通过HNF1A-AS1对OS细胞增殖的影响
由表2可知,与对照组比较,黄连素组的OD值降低,HNF1A-AS1组的OD值升高,差异有统计学意义(t=7.800,P=0.016 0,P<0.05);和黄连素+HNF1A-AS1组相比,黄连素组细胞OD值明显降低,HNF1A-AS1组OD值明显升高,差异有统计学意义(t=7.304,P=0.018 2,P<0.05),结果表明黄连素可以通过抑制HNF1A-AS1表达来抑制OS细胞的增殖。
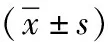
表2 各转染组细胞OD值比较
2.3 黄连素通过HNF1A-AS1对OS细胞凋亡的影响
由表3可知,与对照组比较,黄连素组细胞凋亡率升高,HNF1A-AS1组的凋亡率降低,差异有统计学意义(t=6.656,P=0.021 8,P<0.05);与黄连素+HNF1A-AS1组相比,黄连素组细胞凋亡率明显升高,HNF1A-AS1组细胞凋亡率明显降低,差异有统计学意义(t=6.037,P=0.0264,P<0.05),结果表明黄连素可以通过抑制HNF1A-AS1表达来促进OS细胞的凋亡。
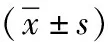
表3 各组细胞凋亡率比较
2.4 黄连素通过HNF1A-AS1对OS细胞侵袭的影响
由图1和表4可知,与对照组比较,黄连素组细胞侵袭数目降低,HNF1A-AS1组细胞侵袭数目升高,差异有统计学意义(t=4.882,P=0.039 5,P<0.05);与黄连素+HNF1A-AS1组相比,黄连素组细胞侵袭数目明显减少,HNF1A-AS1组细胞侵袭数目明显增加,差异有统计学意义(t=6.045,P=0.026 3,P<0.05),结果表明黄连素可以通过抑制HNF1A-AS1表达来抑制OS细胞的侵袭。
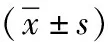
表4 各转染组细胞侵袭数目比较

(紫色为被染色的具有侵袭能力的细胞,细胞侵袭数目排序:HNF1A-AS1组>黄连素+HNF1A-AS1组>对照组>黄连素组)
2.5 黄连素通过HNF1A-AS1对OS细胞中miRNA-363表达的影响
由表5可知,与对照组比较,黄连素组细胞内miRNA-363表达水平升高,HNF1A-AS1组的miRNA-363表达水平降低,差异有统计学意义(t=7.207,P=0.018 7,P<0.05);与黄连素+HNF1A-AS1组相比,黄连素组细胞miRNA-363表达水平明显升高,HNF1A-AS1组细胞miRNA-363表达水平明显降低,差异有统计学意义(t=7.475,P=0.017 4,P<0.05),结果表明黄连素可以通过抑制HNF1A-AS1表达来上调miRNA-363表达。
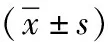
表5 各转染组细胞miRNA-363表达水平比较
2.6 双荧光素酶报告验证HNF1A-AS1与miRNA-363之间的靶向关系
预测结果显示HNF1A-AS1可以靶向调控miRNA-363,结合位点见图2。双荧光素酶报告结果显示同时转染野生型HNF1A-AS1和miRNA-363 模拟物后,相对荧光强度显著降低,差异有统计学意义(t=18.13,P=0.003 0,P<0.01),说明HNF1A-AS1和miRNA-363之间具有靶向调控作用,见表6。
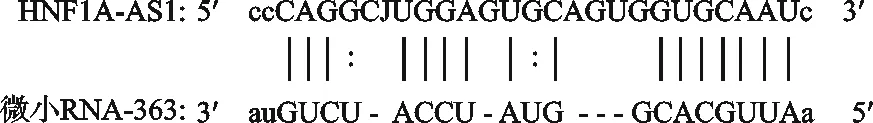
图2 HNF1A-AS1与miRNA-363的结合位点
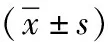
表6 双荧光素酶报告结果
3 讨论
现阶段骨肉瘤的主要治疗方法包括手术、化疗、免疫疗法和基因疗法等,然而骨肉瘤的高转移能力和耐药性仍是预后不良的主要原因[6],因此从分子机制研究骨肉瘤的致病机制能为患者的早期诊断和晚期预后提供理论依据。
近些年研究表明中药在OS的治疗中取得了重大进展,如研究发现柴胡垂盆汤在恢复食欲、保护骨肉瘤患者肝功能方面确有良效。另外发现矮地茶具有保护OS患者肝细胞的作用,垂盆草有减轻肝细胞损伤、降低谷丙转氨酶水平的作用。八珍汤可以明显降低骨肉瘤患者骨髓抑制的发生率[7]。黄连素是中草药黄连的主要活性单体,其分子式是C20H19NO5,分子量为353.36,研究显示黄连素具有神经保护、抗炎和抗氧化作用,最近研究显示黄连素可以通过调节caspase-1/IL-1β通路促进OS细胞凋亡[8]。也有研究显示黄连素可以通过调节Rad51提高OS细胞对放射线的敏感性,进一步抑制OS细胞上皮-间充质转化[9]。此外,Chen等[10]的研究结果也显示黄连素可以通过抑制PI3K/Akt途径发挥抑制OS的作用。但是关于黄连素抑制OS的机制尚不明确。临床研究显示HNF1A-AS1在OS中过表达,并且高水平的HNF1A-AS1与患者预后不良有关[11]。本次研究结果显示黄连素可以抑制OS细胞中HNF1A-AS1的水平,可以通过抑制HNF1A-AS1表达来抑制OS细胞的增殖和侵袭,并促进细胞凋亡,而重新提高HNF1A-AS1的表达可以逆转黄连素对OS的抑制作用。这提示黄连素抑制OS的作用可能与抑制HNF1A-AS1的水平有关。
为进一步分析黄连素可能通过抑制HNF1A-AS1调控OS的机制,本研究检测了细胞中miRNA-363的变化。研究表明miRNA-363可以通过与NOB1结合抑制OS细胞的迁移、侵袭和上皮间质转化[12]。临床研究结果也显示miRNA-363具有抑制OS的作用[13]。更重要的是,miRNA-363的抗癌功能受到LncRNA的调控,LncRNA可以像海绵一样吸附miRNA-363,从而抑制miRNA-363的功能,如LncRNA MALAT1可以通过靶向抑制miRNA-363促进直肠癌的增殖[14]。本研究结果显示黄连素可以显著促进miRNA-363的表达,而提高HNF1A-AS1的水平可以抑制miRNA-363且可以逆转黄连素对miRNA-363的促进作用。此外,双荧光素酶报告实验也证实了HNF1A-AS1可以直接靶向miRNA-363。过往研究显示HNF1A-AS1可以通过抑制miRNA发挥促进肿瘤的增殖和转移的作用[15-16]。也有研究显示黄连素可以通过抑制LncRNA CASC2促进大肠癌的凋亡[17]。此外,黄连素可以通过调节LncRNA MIAT调控心肌细胞的自噬。这提示在OS中,黄连素可以通过抑制HNF1A-AS1提高miRNA-363的表达,从而发挥抑制OS的作用。
综上所述,黄连素可以通过抑制HNF1A-AS1提高miRNA-363的表达,并发挥抑制OS细胞增殖、侵袭和促进凋亡的作用。关于黄连素对OS的抑制作用还需要进一步的体内实验证实,并且其调控HNF1A-AS1的机制也值得深入研究。
