光照胁迫对珠子参生长和皂苷类活性成分积累及同工酶影响
2021-05-12邹晨鑫颜永刚宋小妹杨新杰
李 慧,邹晨鑫,李 铂,姜 祎,高 静,颜永刚,张 岗,宋小妹,杨新杰
(陕西中医药大学 药学院/陕西省秦岭中草药应用开发工程技术研究中心,陕西 咸阳 712046)
珠子参PanacisMajorisRhizoma(PMR)系五加科植物珠子参[PanaxjaponicusC. A. Mey. var. major (Burk.) C. Y. Wu et Feng ex C. C how]的干燥根茎,主要分布于我国陕西、四川、云南、甘肃、贵州等地。味苦、甘,性微寒,具有补肺养阴,祛瘀止痛,止血的功效,主治气阴两虚、烦热口渴、虚劳咳嗽、跌扑损伤、关节痹痛、咳血、吐血、崩漏、外伤出血等[1]。药用历史悠久,为太白七药之一。现代化学研究表明珠子参主要含有皂苷、多糖、挥发油和多种微量元素等成分,其特征性成分主要包括竹节参皂苷Ⅳa、人参皂苷Ro、Rc、Re、Rf、三七皂苷R2、珠子参皂苷R1等三萜皂苷类化合物[2]。药理研究表明珠子参有镇痛镇静[3]、抗肿瘤[4]、抗炎[5]、增强免疫功能[6]以及促进骨髓造血功能[6]等药理活性。
光是植物生存和生长发育不可或缺的条件之一,它调控着植物次生代谢产物的合成和积累。众多相关研究报道表明,光对药材的生长及其有效成分的积累有显著影响,可以通过调控光照条件的手段来提高药材产量及有效成分含量。同工酶为催化反应相同而结构及理化性质不同的酶的分子类型,是生物机体中的天然标记,可反映出机体里的各种变化,在植物生长发育过程中普遍存在同工酶的阶段特异性,其酶谱表现与生长发育阶段密切相关,且不同同工酶种类其特异性不同[7],可作为研究生理和代谢产物变化的指标。珠子参生长缓慢,成药周期较长,多生于荫蔽湿润的环境[8],可见其对光照温度有一定的要求,关于不同光照条件对珠子参皂苷类次生代谢产物积累及同工酶表达笔者还未见研究,因此用光照调控试验,以揭示珠子参中不同同工酶与次生代谢产物积累的相关性,掌握珠子参的生长发育规律,探讨不同光照对珠子参生长以及皂苷类次生代谢产物积累的影响。
1 材料与仪器
1.1 材料
珠子参材料来自陕西太白山珠子参种植基地,由陕西中医药大学王继涛高级实验师鉴定为五加科植物珠子参[PanaxjaponicusC. A. Meg var. major (Burk.) C. Y. Wu et Feng]的幼苗。对照品人参皂苷Ro(批号 111903-201805)和人参皂苷Rg1(批号110703-201933)均购于中国食品药品检定研究院,竹节参皂苷Ⅳa(批号B21676)购于上海源叶公司。丙烯酰胺(天津天力化学试剂有限公司)、甲叉双丙烯酰胺、甘氨酸、过硫酸铵均为(天津科密欧化学试剂有限公司)、Tris(北京博奥拓达科技有限公司)、溴酚蓝(上海季蓝生物有限公司),TEMED(德国sigma公司),水为去离子水。有机质购买德国大汉植物营养泥炭土栽培介质,内含全氮4.4%、有机质94.3%、PH值5.6、水分38.1%、电导度值0.2 dS/m。
1.2 仪器
MGC-300H 人工气候箱(上海一恒科学有限公司),Waters 2695 高效液相色谱仪,BIO-RAD 电泳仪及BIO-RAD mini 垂直电泳槽(美国伯乐公司),GB204 型电子分析天平 (北京赛多利斯仪器系统有限公司);KQ-200KED 超声波清洗机 (江苏昆山超声波仪器有限公司);GZX- 9140MBE电热鼓风干燥箱 (上海博迅医疗设备有限公司)。
2 方 法
2.1 珠子参幼苗培养与处理
将珠子参幼苗移栽于花盆内,内置栽培基质,用自来水充分浸润后置于温室大棚同等条件下培养14 d后选取长势一致的健康幼苗300株供试验所用,供试材料放置人工气候培养箱内适应一周后开始光照处理。在温度25℃,湿度为70%,光周期12 h/12 h下,设置3个试验组(气候箱光照范围0~20 000 lx),分别为强光组16 000 lx、对照组8 000 lx(饱和光)、弱光组4 000 lx,每组100株珠子参幼苗,连续处理27 d。分别于第1、3、5、8、13、21、27 d上午9时随机取样10株作为待测样品,共取7次,去除泥沙洗净滤纸吸干水分,一部分存放于-80℃冰箱保存用于同工酶测定,另一部分于50℃烘干,用于有效成分含量的测定,每组处理三次重复。
2.2 生长指标的测定
分别于第1、3、5、8、13、21、27 d随机选取10株珠子参,测定珠子参生物量(干重)。
2.3 皂苷类成分HPLC分析
HPLC测定分析参考文[9]的方法优化。珠子参根茎烘干,称重,粉碎,取0.1 g,精密称定,置于50 mL锥形瓶中,精密加入70%乙醇25 mL,称重。超声处理40 min(功率500 W,频率40 kHz),放至室温,补足失量,取上清液,过0.22 μm微孔滤膜,待测。精密称取各对照品适量,分别置于10 mL棕色容量瓶中,用适量色谱甲醇溶解并稀释至刻度,分别制成含人参皂苷Rg1 0.04 mg·mL-1、人参皂苷Ro 0.2 mg·mL-1、竹节参皂苷Ⅳa 0.25 mg·mL-1的对照品储备液,进0.22 μm微孔滤膜滤过即。得色谱条件为:色谱柱为Thermo C18(5 μm,4.6 mm × 250 mm)色谱柱;流动相为乙腈(A)-0.02%磷酸水(B),梯度洗脱:0~10 min(5%~40% A);10~22 min(40%~75% A);22~34 min(75%~90% A),检测波长203 nm,柱温30℃,体积流量1.0 mL·min-1,进样量为10 μL。
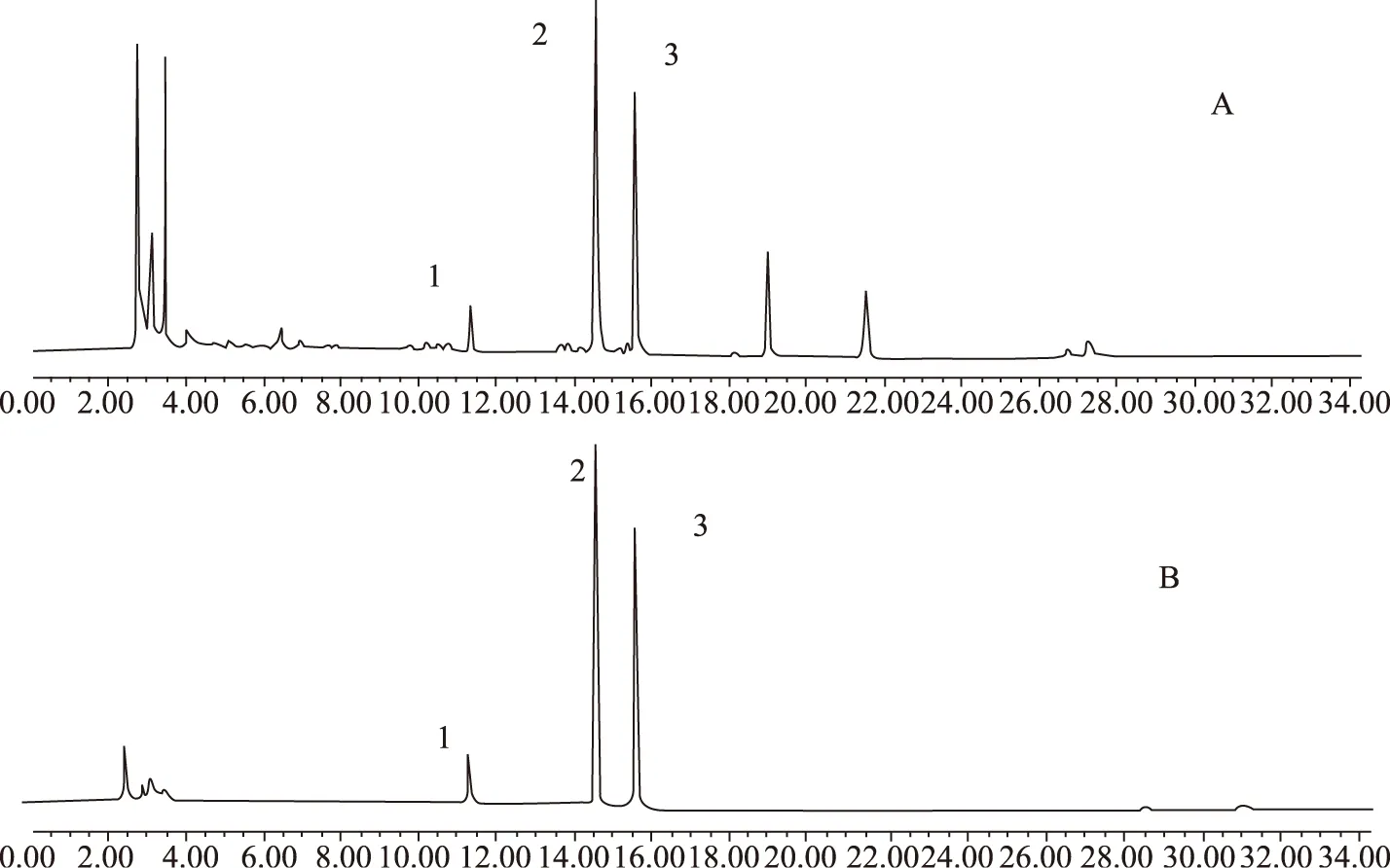
图1 供试品溶液(A)和混合对照品(B)的HPLC色谱图Fig. 1 Sample (A) and HPLC of mixed reference substances(B)注: 1-人参皂苷Rg1;2-人参皂苷Ro;3-竹节参皂苷Ⅳa
2.4 CAT、SOD、POD同工酶谱分析
同工酶主要测量CAT、SOD、POD抗氧化酶活性。方法参考文献[10-12]加以改进。CAT同工酶用铁染色法,SOD同工酶用氮蓝四唑法,POD同工酶用联苯胺法。取0.1 g根茎,液氮研磨,加入10 mmol/L Tris-HCl PH 7.4缓冲液,料液比1∶10,浸提24 h,10000 rpm离心10 min,取上清液,加入等量40%蔗糖溶液于-20℃冰箱保存备用,采用聚丙烯酰胺凝胶垂直版电泳系统分析。SOD和POD采用浓度为10%分离胶,CAT为7.5%分离胶,浓缩胶均为3%的分离度,Tris-Gly(PH 8.3)作为电泳缓冲液,上样量为20 μl,电泳在冰上进行,浓缩胶电流15 mA,溴酚蓝指示剂通过分离胶改为20 mA,电泳至含40%蔗糖溶液的溴酚蓝指示剂迁移至距胶板1 cm时停止电泳。采用Quantity One软件(版本4.6.9)计算凝胶中谱带,根据CAT、SOD、POD同工酶谱带推断出相应的凝胶背景强度,对图像定量分析得到的特定的同工酶谱带进行了简单的数值表示。
2.5 数据分析
数据处理采用Excel 2010,SPSS 19.0数据统计软件进行数据分析,用单因素方差分析(One-way ANOVA)和最小显著差异法(Least significant difference,LSD法)进行数据显著性分析。
3 结果与分析
3.1 不同光照条件对珠子参生物量(干重)的影响
不同光照条件对珠子参干重的影响见表1,弱光(4 000 lx)下珠子参干重最大,对照组和两个处理组都在前21 d缓慢增加,在第21 d干重达到最大,第21 d又开始减少,对照组干重均值与弱光组相差无几,强光组在前期生长速度低于对照组与弱光组,均值也低于强光组,可见强光抑制珠子参生长。
3.2 不同光照处理对珠子参幼苗皂苷类成分积累的影响
不同光照处理对珠子参幼苗中皂苷类成分积累的影响如图2所示。弱光照处理对人参皂苷Rg1、人参皂苷Ro、竹节参皂苷Ⅳa的积累起促进作用,而强光照处理抑制其含量增加。不同光照强度处理后,强光组处理第5 d三种皂苷成分含量达到最高值,弱光组、对照组第3 d三种皂苷成分含量达到最高值,后续20多天处于下降模式,含量值有上下波动。不同光照处理的影响依次为4 000 lx>8 000 lx>16 000 lx,3种有效成分含量都呈“M”型或“N”型波动。方差分析表明,珠子参皂苷类成分在各处理下均达到显著差异水平(P<0.05)。

表1 不同光照条件对珠子参干重的影响Table 1 Effects of different light conditions on the dry weight of PMR(g,n=10)

图2 不同光照条件下珠子参3种有效成分含量的影响Fig. 2 Effects of different light conditions on the content of three active constituents of PMR
3.3 不同光照处理对珠子参CAT、SOD、POD同工酶的影响
由图3、4可知在不同光照条件下珠子参CAT、SOD、POD分别有1,2,3条谱带表达;CAT谱带都集中在上部,相对迁移率(Relative migration,Rf)约为0.18,酶带频率为100%,SOD酶带都集中在中下部,Rf约为0.6的酶带出现的频率最高,Rf 0.53的次之,POD酶谱显示3条酶带都集中在上部与下部,Rf值分别为0.01、0.18、0.85。与对照组相比,弱光组珠子参根茎中的CAT活性显著降低(P<0.05),SOD活性变化不明显,POD的活性增强,随着时间增长,CAT活性变化呈现出先升高后降低的趋势,SOD活性变化呈现出先降低后升高的趋势,POD活性变化呈现出逐渐降低的趋势;强光组珠子参根茎中的CAT活性变化不明显,SOD活性和POD活性显著增强(P<0.05),且随着时间的增长,CAT活性变化呈现出先升高后降低的趋势,SOD活性变化呈现出先降低后升高的趋势,POD活性变化呈现出逐渐上升的趋势。
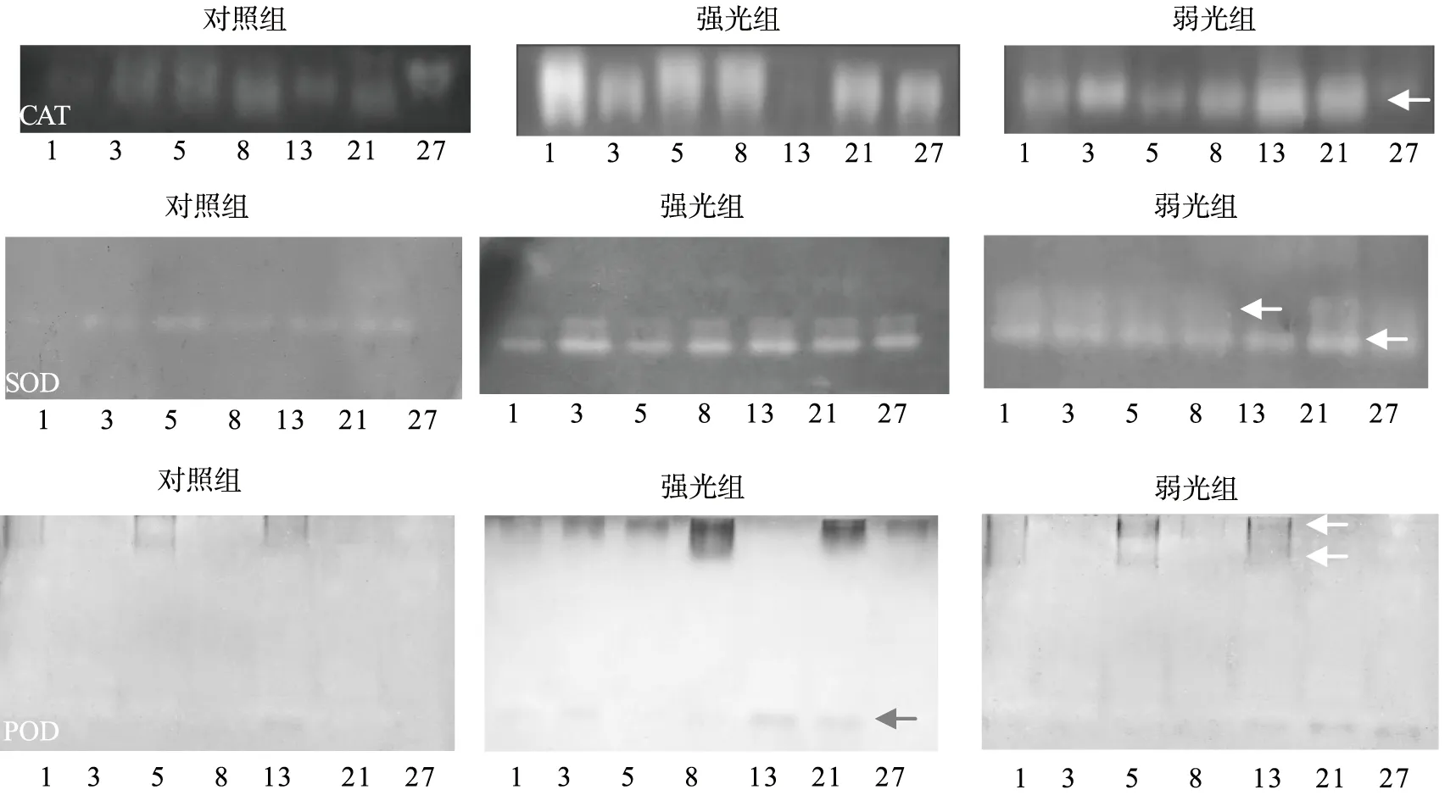
图3 不同光照条件下珠子参同工酶谱图Fig. 3 Three isozyme profiles of PMR under different light conditions注:1、3、5、8、13、21、27分别代表不同样品处理时间。
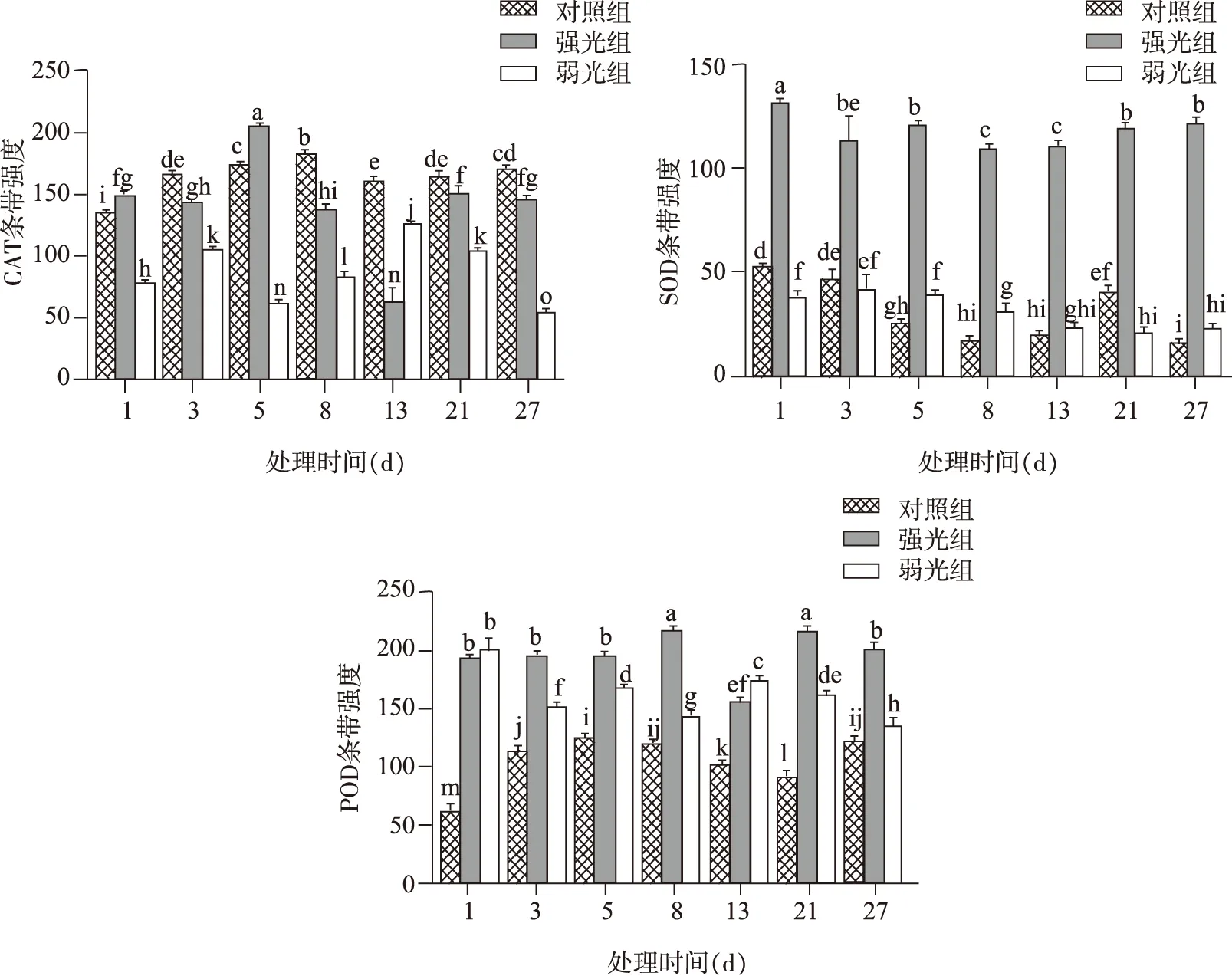
图4 不同光照处理对珠子参CAT、SOD、POD同工酶的影响Fig. 4 Effects of different light treatments on CAT, SOD and POD isoenzymes of PMR
3.4 珠子参活性成分积累与CAT、SOD、POD同工酶相关性分析
珠子参活性成分积累与生态因子和同工酶表达之间关系密切,存在一定相关性,但许多因素之间的相关性并不明确。为了明确因素之间的相关性以及为了进一步探讨不同光照条件下珠子参的调控机制研究,对3种皂苷类有效成分含量与CAT、SOD、POD同工酶进行简单相关性分析,结果见表2,3,4。
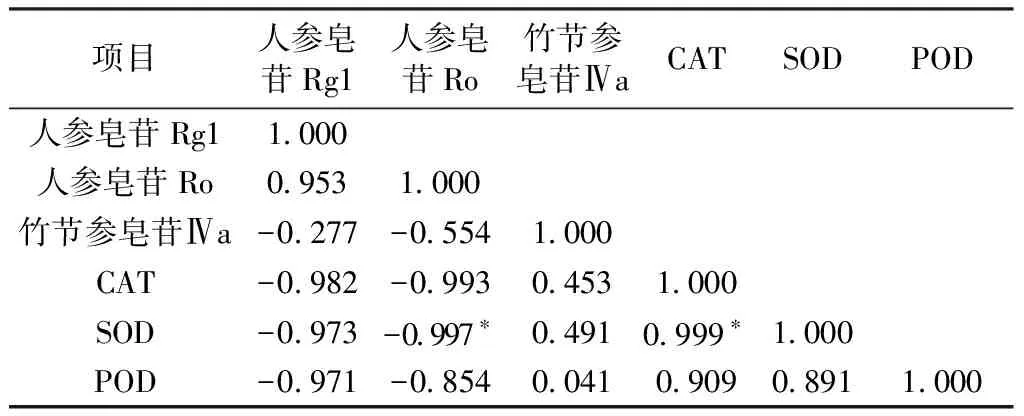
表2 对照组珠子参有效成分含量与CAT、SOD、POD同工酶相关性分析Table 2 Correlation analysis of the content of active ingredientsof PMR with CAT、SOD and POD isoenzymes in the control group
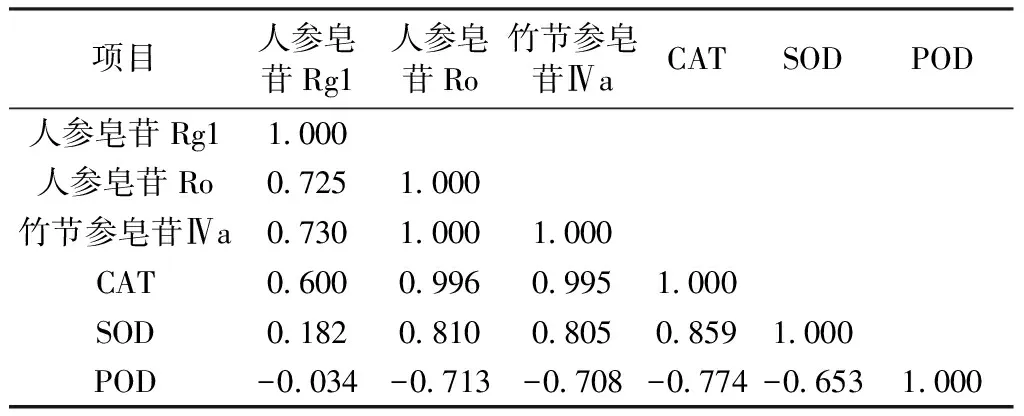
表3 强光组珠子参有效成分含量与CAT、SOD、POD同工酶相关性分析Table 3 Correlation analysis of the content of active ingredients ofPMR with CAT、SOD and POD isoenzymes in the strong light group
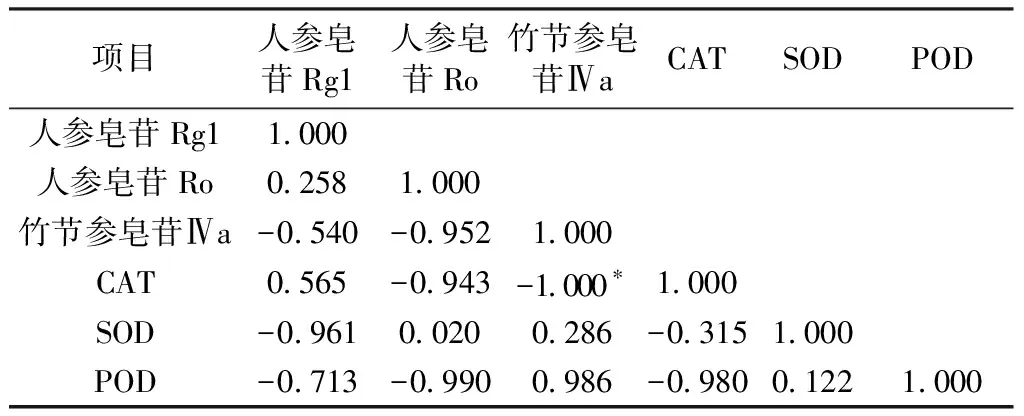
表4 弱光组珠子参有效成分含量与CAT、SOD、POD同工酶相关性分析Table 4 Correlation analysis of the content of active ingredientsof PMR with CAT、SOD and POD isoenzymes in the low light group
对照组中SOD与人参皂苷Ro和CAT呈显著负相关(P<0.05),强光下有效成分含量与同工酶无显著性相关,弱光下竹节参皂苷Ⅳa与CAT呈显著负相关(P<0.05),从以上结果可知化学成分含量越高与SOD、CAT活性相关性越显著,其中CAT与有效成分含量较高的人参皂苷Ro、竹节参皂苷Ⅳa最为显著,这表明在植物受到胁迫时CAT比SOD、POD在促进含量较高的有效成分合成时参与度高。
4 讨 论
植物在长期的进化过程中因生长于不同的光照强度下,会形成喜阴或喜阳的特性,对光照强度的响应也会因植物的不同而产生不同结果。珠子参作为秦巴山区特色秦药之一,随着市场需求的不断增加,解决珠子参人工栽培过程中的关键技术问题迫在眉睫。人工气候箱是目前药用植物受控试验的常用技术手段之一,能够最大化确定一个既能促进次生代谢又不影响生物量积累的胁迫阈值、最佳胁迫周期,从而为之后中药材规范化种植过程中提供参考[13]。通过设置不同的光照强度来阐明不同光照条件对珠子参生长,有效成分以及同工酶的影响。结果表明16 000 lx,4 000 lx,8 000 lx的光照强度对珠子参干重具有不同程度的影响,其中弱光的光照强度下珠子参干重积累最大,强光积累最小,强光组干重均值低于弱光组与对照组,三组前期都缓慢增长在第21 d达到最大后便开始下降,强光组生长最为缓慢,说明过度光强对珠子参产生严重迫害,强光抑制珠子参生长。
植物的次生代谢物是长期进化以及由于环境影响而得到产物,它有着提高植物自身保护能力,增强生存竞争能力以及协调与环境关系等方面的重要作用[14],与初生代谢产物相比在产生和变化方面更易受外界影响。试验结果表明不同光照条件对珠子参3种有效成分含量积累的影响都具有显著性影响,其中人参皂苷Rg1、人参皂苷Ro、竹节参皂苷Ⅳa,3种有效成分在弱光下含量积累最高且差异显著,强光下有效成分含量积累最低。有学者也发现在温室中随着透光率的增加,使人参根中的人参皂苷含量不断增加,而且人参叶总皂苷中的原人参三醇系皂苷含量高于原人参二醇系人参皂苷含量[15];植物体内存在不同的同工酶,不同处理过后会产生酶系统的差异。当植物在光饱和点以下时它所需的光能未达到饱和不会对植物造成伤害,当光照过强时会激发活性氧的增加进而破坏植物的抗氧化系统。在本实验中CAT、SOD、POD均在强光组下条带表达最强,而珠子参有效成分含量最低,这说明光照强度过大,使得珠子参吸收光能过剩,产生氧自由基,使CAT、SOD、POD活性增高去分解细胞产生的氧自由基,保护细胞防止受到活性氧的伤害。同工酶等的表达调控了珠子参皂苷类活性成分体内合成,而光照条件作为外部因素对皂苷类成分的合成也有着重要的影响,但目前尚未明确皂苷类活性成分代谢途径究竟如何进行,同工酶的表达相互影响,协同增减,在珠子参根组织中表现出了一定的相关性。通过对珠子参有效成分与同工酶相关性分析发现,强光下有效成分含量与同工酶无显著性相关,弱光下竹节参皂苷Ⅳa与CAT呈显著负相关,说明竹节参皂苷Ⅳa与过氧化氢酶存在某种关联。这可能是不同光照强度使珠子参CAT酶与竹节参皂苷Ⅳa发生反应,推测可能与化合物羟基有关[16],说明在不同光照条件下CAT同工酶参与调控了皂苷类活性成分的积累。
通过对珠子参不同光照条件胁迫,高效液相色谱法分析其成分变化,同工酶分析酶带活性,为珠子参后续的质量控制,资源合理利用提供了科学依据。为了进一步阐明珠子参皂苷类次生代谢产物积累的过程,接下来可进一步探讨不同光照条件对珠子参根茎中关键酶基因表达的影响。
