棉铃虫APN基因家族系统进化与功能分析
2021-05-11牛琳琳ZAWLinNaing张彩虹EIThinzarSoe梁革梅
牛琳琳,ZAW Lin Naing,张彩虹,EI Thinzar Soe,梁革梅
(中国农业科学院植物保护研究所/植物病虫害生物学国家重点实验室,北京 100193)
APNs(氨肽酶家族)属于肽链端解酶,可使氨基酸从多肽链的N末端顺序逐个地游离出来[1],参与生物体内蛋白翻译水平调控、肽激素水平调控、应激反应以及与健康和疾病相关的细胞反应等过程[2]。在昆虫中,存在于消化道和肠腔中的APN,主要功能是与肽链内切酶和羧肽酶共同起作用,分解来自食物的蛋白[3]。研究者根据APNs的基因序列系统进化分析结果将鳞翅目昆虫APNs分为8类,分别命名为APN1到APN8,每类分支中通常有多于一种的APN,同一物种的不同分支间氨基酸同源性为23%~40%,同一分支不同物种间的同源性为50%~95%[4,5]。目前,有143条APN的cDNA已经从27种鳞翅目昆虫中被克隆、分析(http://www.ncbi.nlm.nih.gov/)。
昆虫中肠上的受体蛋白与Bt结合是Bt发挥杀虫作用的关键,而且受体蛋白的变异与昆虫对Bt的抗性密切相关。氨肽酶N是最早被鉴定出来的Bt受体蛋白[6],烟草天蛾Manduca sexta的APN通过分离纯化后可与Bt蛋白进行体外结合,是最早被确定的Cry1Ac受体[7]。2002年Gill等[8]采用显微注射法获得了含烟草天蛾APN基因的黑腹果蝇Drosophila melanogaster,APN在非敏感宿主果蝇中肠和中胚层获得了表达,这种转基因果蝇对Cry1Ac毒素变得很敏感,该研究首次从虫体水平证实APN是Cry1Ac的功能性受体。Lin等[9]在Sf9昆虫细胞中成功表达家蚕APN6,细胞生测结果显示BmAPN6参与Cry1Ac诱导的细胞形态异常和裂解死亡过程。以往的研究结果表明,不同APN所结合的Cry蛋白种类不尽相同,而且昆虫对Bt产生抗性后 APN基因的表达量变化也有差异,有的在抗性昆虫中显著降低,有的却显著升高。Pigott和Ellar[10]认为,APN在对Bt敏感性不同昆虫中的表达量不同可能与APNs在不同种类昆虫中作为Bt受体的相对重要性不同相关。因此,昆虫APNs可能在不同Bt的杀虫机制及抗性机制中发挥着不同的作用。
自1997年Bt棉花在我国种植以来,棉铃虫的为害得到了有效控制,但随着种植年限的延长,棉铃虫对Cry1Ac的敏感性逐渐降低,抗性风险不容忽视[11]。Angelucci等[12]通过分析棉铃虫中肠的cDNA文库发现了7种APN,其中有4种可以和Cry1Ac结合;我们实验室也对棉铃虫APN进行了一系列研究,包括基因克隆、分离纯化,并证实 HaAPN1是 Cry1Ac的受体、在幼虫不同龄期中的表达量不同等[13-16]。对HaAPNs参与杀虫机制、抗性机制中的功能也进行了探讨,如HaAPN4可以与Cry1Ac、Cry2Aa都结合,沉默 APN4基因使棉铃虫对 Cry2Aa的敏感性降低;通过抗体封闭试验证实 HaAPN1和 HaAPN4参与Cry1Ac、Cry2Aa棉铃虫的杀虫过程[17-19];HaAPN1片段缺失导致棉铃虫对Cry1Ac的抗性[20];HaAPN1的表达量在不同水平的Cry1Ac抗性品系棉铃虫中都显著降低,而HaAPN5在不同抗性品系中表现不同,有的升高有的降低[21]。但总体来说,对棉铃虫APN家族所有的基因缺乏系统的比较、分析,因此,无法全面评价不同APNs的作用。本研究我们克隆得到7个棉铃虫APN基因全长序列后,对HaAPNs进行了系统进化分析,并比较了HaAPN1−7基因在Cry1Ac敏感和抗性棉铃虫中的表达量,还分析了棉铃虫取食不同种类的Bt蛋白后APN活性的变化,以期系统地分析这7种APNs的功能,为进一步明确棉铃虫APNs在Bt杀虫、抗性机制中的作用奠定基础。
1 材料与方法
1.1 供试虫源
96S敏感品系棉铃虫1996年采集自河南省新乡县棉田,在实验室用人工饲料饲养至今,在此期间未接触过任何杀虫剂[22]。BtR品系是由96S敏感品系棉铃虫持续饲喂Cry1Ac蛋白筛选得到的,对Cry1Ac的抗性倍数超过1800倍。96S-Cry2Ab品系是由 96S敏感品系棉铃虫持续饲喂 Cry2Ab蛋白筛选得到的,对Cry2Ab的抗性倍数为28倍。96S-Vip3Aa品系是由96S敏感品系棉铃虫持续饲喂Vip3Aa蛋白筛选得到的,对Vip3Aa已具有一定耐受性。
各品系棉铃虫均在温度(26±1)℃,光周期16L:8D,相对湿度(75±10)%的条件下饲养。
1.2 供试蛋白
Cry1Ac、Cry2Ab、Vip3Aa蛋白购自北京美延农业科技有限责任公司。
1.3 棉铃虫中肠总RNA提取和cDNA第一链的合成
取棉铃虫5龄初幼虫30头,于冰上解剖截取中肠,在0.7% NaCl溶液中清洗掉中肠内含物,用滤纸吸干中肠的水分,液氮速冻后在-80 ℃冰箱内保存备用。棉铃虫中肠总RNA采用Trizol法进行提取[23],用1.5%琼脂糖凝胶电泳检测总RNA的完整性并用NanoDrop1000紫外分光光度计检测其浓度和纯度。
按照FastQuant cDNA第一链合成试剂盒(天根公司)说明书,取2 μg总RNA进行反转录。
1.4 棉铃虫APNs全长基因克隆
分析GenBank上传的棉铃虫APNs序列信息,对无APN全长的基因(APN4~7)先设计中间引物,然后进行3′ RACE PCR。按照Reverse Transcriptase M-MLV(RNase H-)(Takara公司)说明书以QT(表1)引物反转录得到的3′ cDNA为模板进行PCR。

表1 反转录和PCR所用引物Table 1 Primers used for reverse transcription and PCR
设计特异性引物以棉铃虫中肠cDNA为模板进行PCR扩增。PCR反应体系为50 μL:cDNA模板2 μL,上游引物(10 μmol/L)1 μL,下游引物(10 μmol/L)1 μL,5×TransStart®FastPfu Buffer 10 μL,2.5 mmol/L dNTPs 4μL,TransStart® FastPfu DNA Polymerase 1 μL,ddH2O 31 μL。PCR 反应程序为:预变性 95 ℃ 1 min,1个循环;变性95 ℃ 20 s,退火55 ℃ 20 s,延伸72 ℃ 2 kb/min,40个循环;终延伸72 ℃ 5 min,1个循环。PCR产物经1.5%琼脂糖凝胶电泳分离和胶回收纯化后连接到pEASY-Blunt Simple克隆载体上,转化至Trans1-T1感受态细胞,37 ℃培养箱培养后挑选阳性单克隆菌斑送至中美泰和有限公司进行测序。测序结果用NCBI-Blast进行同源序列检索比对后用DNAMAN进行拼接得到全长序列。
1.5 棉铃虫APNs基因序列分析和系统进化树构建
利用ExPaSy-PROSITE(http://web.expasy.org/compute_pi)预测APNs蛋白的分子量和等电点;利用NetNGLyc 1.0 Server(http://www.cbs.dtu.dk/services/NetNGLyc/)预测APNs蛋白的N-糖基化位点;利用NetOGLyc 4.0 Server(http://www.cbs.dtu.dk/services/NetNOLyc/)预测APNs蛋白的O-糖基化位点;利用GPI-SOM(http://gpi.unibe.ch/)预测APNs蛋白的GPI(Glycosyl-phosphatidylinositol)锚定位点;在NCBI上搜索鳞翅目其他昆虫的APN氨基酸序列,利用Mega 7软件采用邻接法构建已知鳞翅目昆虫的APN系统发育进化树。
1.6 不同抗性品系棉铃虫APNs表达量差异分析
取各品系5龄初棉铃虫幼虫90头,30头为一个生物学重复,共3次重复。棉铃虫中肠提取、中肠总RNA提取及cDNA第一链的合成同1.3。
根据扩增得到的棉铃虫APN1~7基因全长序列设计实时荧光定量PCR引物(表2),内参引物选用核糖体蛋白S15基因(RPS15)。所有引物均进行荧光定量PCR验证扩增效率。荧光定量PCR采用SYBR Green染料法。不同抗性品系APNs表达量差异分析利用本步骤中合成的cDNA,PCR反应体系为20 μL,组分为 2×SuperReal PreMix Plus 10 μL,正向和反向引物各 0.6 μL,cDNA 模板 1 μL,50×ROX Reference Dye△0.4 μL,ddH2O 7.4 μL,PCR 程序按照 SuperReal PreMix Plus(SYBR Green)(天根公司)试剂盒说明书进行。

表2 荧光定量PCR所用引物Table 2 Primers used in qPCR
APNs表达量差异以内参基因(RPS15)表达量为标准参照,用2-△△Ct相对定量法计算APNs的表达量差异[24]。用GraphPad Prism 8.0软件对数据进行处理分析,采用Tukey检验进行处理间差异显著性分析。
1.7 中肠酶液和BBMV中的APN活性的测定
将配制好的棉铃虫人工饲料切成边长约为0.5 cm的正方体小块,加到24孔昆虫饲养板中。用25 mmol/L Na2CO3/NaHCO3缓冲液(pH 10.5)将Bt蛋白稀释成需要浓度,按照0~6.25 μg/larva剂量添加Bt蛋白到饲料表面,待Bt蛋白完全渗入饲料后,将预先饥饿4 h后的5龄初棉铃虫幼虫接到饲料上。每处理接虫24头,重复3次。待棉铃虫将各处理饲料取食殆尽(8 h),收集幼虫。
于冰上解剖各处理棉铃虫,将中肠及内含物取出置于2 mL离心管中,加入预冷的1 mL 150 mmol/L NaCl,微量组织研磨器研磨约10 s,4 ℃、12000 r/min离心15 min,吸取上清液于新的离心管中,再重复离心一次,上清液即为中肠酶液。棉铃虫中肠BBMV提取参照Wolfersberger等[25]的方法进行。利用Bradford法测定中肠酶液和BBMV中总蛋白浓度。
参照Watanabe等[26]和Takesue等[27]的方法,以1 mg/L LpNA的甲醇储备液作为反应底物,在96孔酶标板中每孔加入5 μL样品和195 μL底物溶液,37 ℃反应60 min后,405 nm波长下测量吸光值。
APN活性计算方法:U=(△A/△t)×(V总反应体积/v样品体积)×(1000/ɛ)μmol/min(消光系数ɛ=9.9/mmol/cm);APN 特异活性=U/mg protein=(△A×264.0787)/蛋白浓度,APN 活力单位为μmol/min/mg protein。
数据分析同1.6。
2 结果与分析
2.1 棉铃虫APNs基因序列分析
通过 PCR克隆得到的 7条棉铃虫APN基因全长序列HaAPN 1~7,已上传至 GenBank,登录号为MT002819~MT002825。经 ExPaSy-PROSITE、GPI-SOM 等生物信息学网站分析,HaAPN 1~7全长为2592~3099 bp,编码863~1032个氨基酸,分子量为110~115 kDa,等电点为4.7~6.4,N端信号肽为15~20 aa。除HaAPN7以外,HaAPN1~6都有GAMENWG和HEX2HX18E基序;HaAPN1、HaAPN2,HaAPN3的C末端都有一段多聚苏氨酸序列;HaAPN1~7蛋白C末端都有一个GPI锚定位点;HaAPN1、HaAPN2,HaAPN3的O-糖基化位点有16~39个;除了HaAPN2无N-糖基化位点,其余HaAPNs均有1~8个N-糖基化位点。具体序列信息分析见表3。
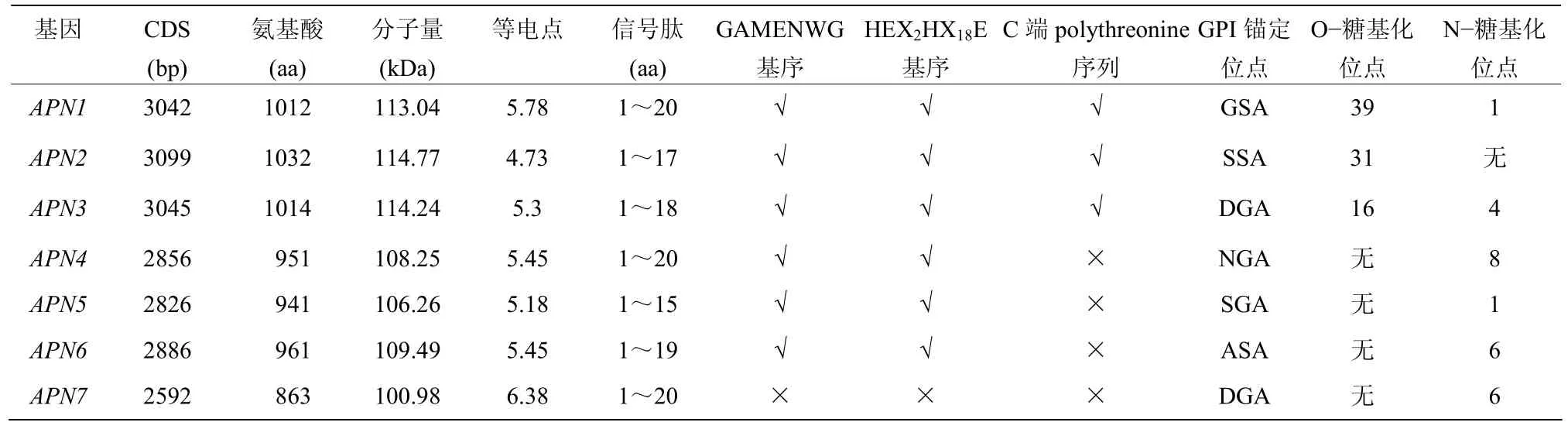
表3 棉铃虫APN1~7生物信息学分析Table 3 Bioinformatics analysis of HaAPN1—7
2.2 棉铃虫APNs系统发育分析
从NCBI下载了22种鳞翅目昆虫APN氨基酸序列共86条(包括本研究所克隆的7条HaAPNs序列),利用Clustal W进行多序列比对,采用Neighbor-Joining构建鳞翅目APN系统发育进化树(bootstrap=1000),结果显示鳞翅目在进化上分为9个分支,其中棉铃虫APN1~7基因分别在其中的7个分支Class 1~7上。Class 1中包括16个物种;Class 2中包括11个物种;Class 3共有17个物种,Class 3在进化关系上与Class 1的亲缘关系最近,但与Class 1相比O-糖基化位点更少;Class 4与Class 2一样C末端无苏氨酸富集区,此类别包含11个物种;Class 5中包含8个物种,Class 6中包含6个物种;Class 7~9中仅包含2~3个物种。从棉铃虫APN进化上的亲缘关系上来看,棉铃虫APN1与澳洲棉铃虫Helicoverpa punctigera、烟芽夜蛾Heliothis virescens、甜菜夜蛾Spodoptera exigua的APN1亲缘关系较近;棉铃虫APN2与甜菜夜蛾APN5、粉纹夜蛾Trichoplusia ni APN5亲缘关系较近;棉铃虫APN3与澳洲棉铃虫APN3亲缘关系最近;棉铃虫APN4与澳洲棉铃虫APN2亲缘关系最近;棉铃虫APN5与粉纹夜蛾APN2亲缘关系最近;棉铃虫APN6与甜菜夜蛾APN6亲缘关系最近;棉铃虫APN7与欧洲玉米螟Ostrinia nubilalis APN7亲缘关系最近(图1)。

图1 鳞翅目昆虫APNs进化树Fig. 1 Phylogenetic tree of Lepidoptera insects APNs
2.3 Cry1Ac敏感和抗性品系棉铃虫中HaAPN1~7表达量
在96S敏感棉铃虫中HaAPNs表达量差异显著(F6,21=343,P<0.0001),表达量由高到低依次为HaAPN2,HaAPN1,HaAPN4,HaAPN3,HaAPN5,HaAPN6,HaAPN7,其中HaAPN2的表达量比HaAPN1高约1倍且达到显著水平(P=0.002);HaAPN4的表达量显著低于HaAPN1(P<0.0001),HaAPN3的表达量显著低于HaAPN4(P=0.001);HaAPN5与HaAPN3表达量差异不显著(P=0.38);HaAPN5~7表达量差异不显著(P>0.57)(图2A)。
在 BtR抗性棉铃虫中 HaAPNs表达量差异显著(F6,21=184,P<0.0001),表达量由高到低依次为HaAPN2、HaAPN1、HaAPN4、HaAPN3、HaAPN5、HaAPN6和 HaAPN7,其中 HaAPN2的表达量比 HaAPN1高约2倍且达到显著水平(P<0.0001);HaAPN3~6表达量均显著低于HaAPN1(P<0.0001);HaAPN3~7表达量无显著差异(P>0.07)(图2B)。

图2 Cry1Ac敏感(A)和抗性(B)品系棉铃虫中HaAPN1~7表达量Fig. 2 Expression level of HaAPN1—7 in Cry1Ac-susceptible (A) and -resistant (B) strain
2.4 敏感品系棉铃虫取食不同Bt蛋白后中肠APN活性的变化
取食Cry1Ac蛋白后,96S棉铃虫中肠APN活性变化明显(中肠酶液: F6,14=7.33,P=0.001;BBMV:F6,14=457,P<0.0001),与取食正常饲料的棉铃虫相比,2 ng/larva(P=0.0009)、50 ng/larva(P=0.018)和0.25 μg/larva(P=0.003)剂量处理的棉铃虫中肠酶液中APN活性显著下降;所有不同Cry1Ac剂量处理的棉铃虫中肠BBMV中APN活性与对照相比显著下降(P<0.0001)。取食Cry2Ab蛋白后(F6,14=2.11,P=0.117),中肠酶液中APN活性无显著变化(P>0.18);但与对照相比,所有剂量处理中肠BBMV中APN活性都显著降低(F5,12=181,P<0.0001;1.25 μg/larva:P=0.029;其余剂量:P<0.0001)。取食Vip3Aa蛋白后,与对照相比,各个处理中肠酶液中APN活性显著降低(F5,12=144,P<0.0001;所有剂量:P<0.0001);除了10 ng/larva剂量处理外,中肠BBMV中APN活性也都显著降低(F5,12=117,P<0.0001;10 ng/larva:P=0.965;其余剂量:P<0.0001)(图3)。
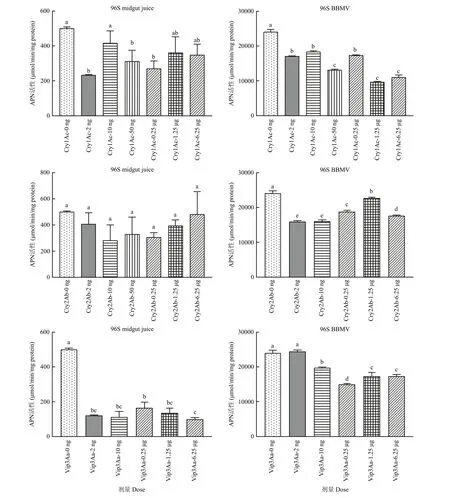
图3 取食不同Bt蛋白后敏感品系棉铃虫中肠APN活性Fig. 3 APN activity in the midgut of Helicoverpa armigera susceptible larvae after fed different Bt proteins
2.5 不同Bt抗性品系棉铃虫中肠APN活性的比较
与96S敏感品系棉铃虫相比,各Bt抗性品系棉铃虫中肠APN活性显著降低(中肠酶液:F3,8=32.9,P<0.0001;BBMV:F3,8=21.3,P=0.0004),其中BtR品系(P=0.0004)和96S-Vip3Aa品系(P=0.004)棉铃虫中肠酶液中APN活性显著降低,96S-Cry2Ab品系与96S无显著差异(P=0.564);而在BBMV中,与96S棉铃虫相比,96S-Vip3Aa品系(P=0.0004)APN活性显著降低,96S-Cry2Ab品系(P=0.056)和BtR品系与敏感品系差异不显著(P=0.841)(图4)。

图4 不同Bt抗性品系棉铃虫中肠APN活性的差异Fig. 4 Differences of APN activity in the midgut of Helicoverpa armigera from different Bt resistant strains
3 讨论
鳞翅目昆虫中肠APNs的分子量从100到180 kDa不等,具有多个保守区域,从蛋白的N端到C端依次为信号肽、蛋白前体区、GAMENWG基序、HEX2HX18E锌指结构基序、苏氨酸富集区、糖基磷脂酰肌醇(Glycosyl-phosphalidylinositol,GPI)锚定信号位点[28]。本研究克隆得到的HaAPN1~7都具有这些APN家族的共同特征。HaAPN1~7中,只有APN7没有保守的GAMENWG基序和HEX2HX18E锌指结构基序,证明APN7不是一个有活性的氨肽酶N基因[12]。棉铃虫APN4~7基因C末端没有苏氨酸富集区,此区域也是APN的O-糖基化位点;具有苏氨酸富集区的APN1~3含有的O-糖基化位点的个数也不相同,HaAPN1和HaAPN2分别有39和31个O-糖基化位点,HaAPN3有16个(表3)。相比于O-糖基化位点,每个棉铃虫的APN基因只有少数几个N-糖基化位点,其中HaAPN2无N-糖基化位点。APN的糖基化位点通常被认为可能是Cry1Ac的结合区域[10,12],不同APN糖基化位点的差异可能是APNs与不同Bt蛋白结合存在差异的主要原因。例如,Cry1Ca蛋白与烟草天蛾106 kDa 的APN 结合、但不能和115 kDa大小的APN结合[29];欧洲玉米螟中APN1结合Cry1Ab和Cry1Fa,APN3a、APN8只结合Cry1Fa,APN2、APN3b,与Cry1Ab和Cry1Fa都不结合[30];棉铃虫APN1~4均可以和Cry1Ac结合[12],其中APN1除了能与Cry1Ac结合外还能与Cry1Aa和Cry1Ab结合,APN2则只能与Cry1Ac结合[20,21,31]。因此,我们推测棉铃虫APN1~6与不同的Bt可能存在不同的结合谱。
Pigott and Ellar[10]进行系统发育分析后将鳞翅目序列划分为5个类群,随着基因组测序技术的发展,越来越多昆虫的APN同工酶序列被克隆出来,鳞翅目APNs又进一步被细致地分为8个类群[4],在此基础上Hughes[5]基于鳞翅目APNs的保守衍生基序,去掉Class7分支后加上双翅目APNs,然后重新分析了鳞翅目APNs的系统发育情况[5]。本研究整合目前在NCBI上的鳞翅目APNs全长序列,除去无信号肽和GPI锚定位点的PSA(puromycin-sensitive amino)类APN[4],进行系统发育分析将其分为9个类群,Class 1~9。目前,不同类群APN均有作为Bt受体的报道,其中Class1~4类群APNs与Cry蛋白的相互作用研究较为广泛,Class 1中烟草天蛾APN1[32]、小菜蛾PxAPN-A[33]、棉铃虫APN1[20,31]、粉纹夜蛾APN1[34]已报道为Cry1Ac的受体;Class 2中烟草天蛾APN2可以与Cry1Ab5结合[7];Class 3中家蚕和小菜蛾APN3[35]、棉铃虫APN3[3]、烟芽夜蛾120 kDa APN[37]、舞毒蛾APN1[38]可作为Cry1A的结合蛋白也有相关报道;Class 4中家蚕和小菜蛾的APN4可以与Cry1Aa、Cry1Ab结合[35]。Class 5~9类群作为Cry蛋白的受体报道还很少。
为了明确APN在Bt杀虫或抗性机制中的作用,人们常用RNAi技术干扰APN的表达来明确其功能,如通过降低棉铃虫、美国白蛾、甜菜夜蛾、二点委夜蛾Athetis lepigone等的APN基因表达量,证实了APN是Cry类蛋白的受体[39-42]。APN突变或表达量的改变与棉铃虫[20]、甜菜夜蛾[43]、粉纹夜蛾[34]等对Cry1类蛋白的抗性相关。我们的研究结果显示棉铃虫中肠APN1~7的表达量存在显著差异,其中APN2的表达量最高,APN7的表达量最低;而且Cry1Ac抗性品系棉铃虫中各类APN的表达趋势与敏感品系一致。我们推测,HaAPN1~7可能在分解蛋白、作为结合受体等方面有不同的重要性。
Chougule等[44]曾报道,取食不同的饲料会造成棉铃虫APNs表达量的差异;Cry1Ab抗性品系小蔗螟APN蛋白酶活性和表达量较敏感品系都显著降低,敏感幼虫APN被RNAi后,APN活性降低、对Cry1Ab敏感性降低[45]。我们的研究结果显示敏感品系棉铃虫取食Cry1Ac、Cry2Ab和Vip3Aa蛋白后中肠APN活性显著降低,其中取食Cry1Ac和Vip3Aa蛋白后中肠酶液中APN活性显著降低,取食Cry1Ac、Cry2Ab和Vip3Aa蛋白后中肠BBMV上APN活性都显著降低(图3)。棉铃虫对Cry1Ac、Cry2Ab和Vip3Aa产生耐受性后,中肠酶液和 BBMV中APN活性也发生了显著变化,而且与96S棉铃虫相比,BtR品系和96S-Vip3Aa品系棉铃虫中肠酶液中APN活性显著降低,96S-Vip3Aa品系棉铃虫BBMV中APN活性显著降低(图4)。说明棉铃虫取食不同的Bt或对不同Bt有耐受性后,在中肠酶液中和BBMV上APN的活性变化不同。由此,我们推测棉铃虫APN活性的变化与Bt蛋白的降解及抗性演化相关,但具体的功能有待以后进一步验证。
