光谱法与计算机模拟法研究六溴环十二烷与牛血清白蛋白的相互作用
2021-05-11宋继敏吕小兰
庹 浔,宋继敏,付 豪,吕小兰*
1.南昌大学化学学院,江西 南昌 330000 2.南昌大学药学院,江西 南昌 330000
引 言
六溴环十二烷(Hexabromocyclododecane,HBCD)是一类添加型的含溴阻燃剂,是继多溴联苯醚、四溴双酚A后被广泛使用的第三大溴系阻燃剂。2001年至2011年全球HBCD产量由16 700 t增至31 000 t,我国年生产量从500 t增至18 000 t,已成为HBCD的主要生产国[1]。2013年5月经缔约方大会第六次会议审议,联合国环境规划署理事会将HBCD纳入持久性有机污染物目录,引发国际社会广泛关注。
近年来的研究表明HBCD能够进入大气、土壤、水体等自然环境并且能够在生物体内蓄积[1]。据文献报道,中国各大城市的空气中均检出HBCD,土壤中HBCD含量检出量高达11 700 ng·g-1,远远超过世界标准[2]。特别值得注意的是,在人迹罕至的北极地区的空气及生物体内都检测到HBCD的存在[3]。毒理学相关研究表明,HBCD对生物体具有生殖毒性、发育毒性、神经毒性等多种毒性[4]且具有生物放大效应,能够通过食物链的传递最终严重威胁人类健康。例如:经HBCD染毒7天后,雌性大鼠肝脏中大量蛋白的表达发生改变[5],食物链高端的鱼类体内HBCD含量高于食物链低端鱼类[6],体外研究表明HBCD对人肝细胞和人肝癌细胞具有细胞毒性[7]。因此,研究HBCD对哺乳动物毒性作用机制,可为降低HBCD对人类健康的威胁提供理论支持。
血清白蛋白作为一种重要的生物分子,在过去的几百年里一直为人们所关注。血清白蛋白是血液中重要的蛋白质成分,负责维持血液的渗透压以及pH值。血清白蛋白在许多内源性物质(氨基酸、脂肪酸等)和外源化合物(药物、环境污染物等)的转运过程中发挥着关键作用[8]。持久性有机污染物同样能够与白蛋白结合[9],继而被转运至各个器官,由此可以推测血清白蛋白在HBCD的致毒机制中发挥着关键作用。目前,尚未见HBCD与血清白蛋白结合机制的研究。本文通过实验研究和理论计算相结合的方式,探究HBCD与BSA的作用机制,以期为从分子水平揭示HBCD对人类毒性作用机制提供重要基础信息。
1 实验部分
1.1 仪器与试剂
带温控系统的F-4500荧光分光光度计(日本日立公司);紫外-分光光度计(UV-5500PC上海元析仪器有限公司);Cary eclipse荧光光谱仪(美国安捷伦公司);PHS-3C精密PH计(上海雷磁仪器厂);溶液:牛血清白蛋白(进口分装)溶于超纯水中配制成1×10-3mol·L-1的储备液,六溴环十二烷(上海源叶生物,97%)溶于二甲基亚砜(国药集团化学试剂有限公司,A.R.)中配成1×10-2mol·L-1的HBCD储备液;Tris-HCl缓冲液:2.42 g三羟甲基氨基甲烷(Tris,上海源叶生物科技有限公司,纯度为99.9%)和3.51 g NaCl溶于400 mL超纯水中配制成pH 7.40的缓冲液;实验用水均为超纯水。
1.2 方法
1.2.1 荧光光谱、同步荧光的测定
固定研究体系中BSA浓度为3.33×10-6mol·L-1,改变HBCD的浓度(0,3.33,6.66,9.99,13.33,16.67,19.98)×10-6mol·L-1,以280 nm为激发波长,测定300~450 nm下的荧光发射光谱。
改变BSA-HBCD体系的温度(288,293和298 K),以280 nm为激发波长,测定300~450 nm的荧光发射光谱。
固定λem-λex=15 nm,λem-λex=60 nm,分别测定260~320 nm下的同步荧光发射光谱。
改变体系中BSA和HBCD的比例,分别以280和295 nm为激发波长,测定发射波长345 nm下的荧光强度。
1.2.2 紫外光谱
固定研究体系中BSA的浓度为3.33×10-6mol·L-1,改变HBCD的浓度(0,3.33,6.66,9.99)×10-6mol·L-1,以相应的HBCD溶液作为参比,测定200~300 nm下BSA-HBCD体系的紫外光谱。
1.2.3 分子对接
通过ChemBio3D Ultra 14.0得到HBCD的结构,并通过MMFF94分子力场优化得到最佳的结构。从RSCB数据库(http://www.rcsb.org/)中得到编号为1H9Z的白蛋白构象。通过Autodock4.2 程序进行分子对接并使用Ligplus+软件对ΔG最低的构象进行分析。
1.2.4 分子动力学
利用分子动力学软件GROMACS 2016.1程序模拟游离态和结合态的BSA结构的稳定性以及HBCD对BSA二级结构的影响,每个体系重复模拟3次。
2 结果与讨论
2.1 HBCD与BSA体系荧光光谱、紫外光谱分析
BSA中含有酪氨酸(Tyr)、色氨酸(Trp)和苯丙氨酸(Phe)三种能够产生荧光的氨基酸残基,使得BSA具有一定的内源性荧光。由图1(a)所示,随着HBCD浓度的增加,BSA的荧光强度依次降低,表明HBCD与BSA间存在着相互作用且结合能力较强,易在体内被蛋白质储存和转运。
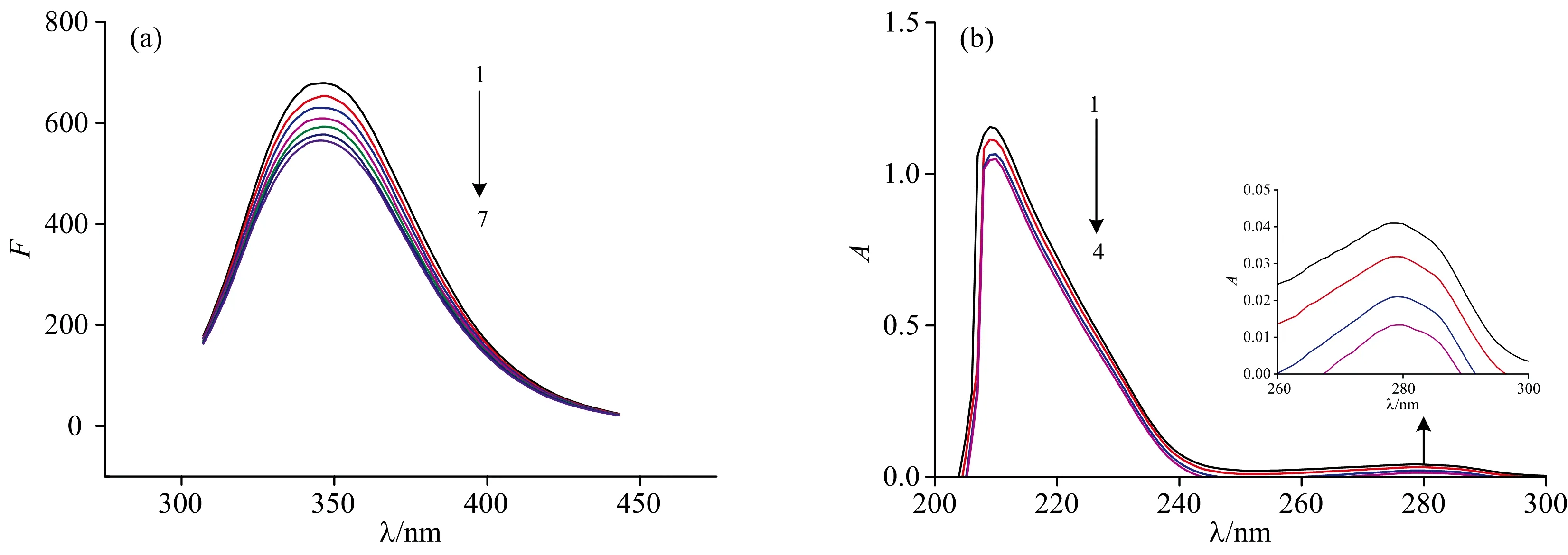
图1 HBCD对BSA荧光光谱(a)和紫外光谱(b)的影响Fig.1 Effect of HBCD on the fluorescence (a) and UV absorption spectra (b) of BSA(a):[BSA]=3.33×10-6 mol·L-1;[HBCD]=(0,3.33,6.66,9.99,13.33,16.67,19.98)×10-6 mol·L-1;(b):[BSA]=3.33×10-6 mol·L-1;[HBCD]=(0,3.33,6.66,9.99)×10-6 mol·L-1
2.2 HBCD与BSA的结合位置
BSA具有两个与外源性物质结合的结合位点,分别是结合位点Ⅰ和结合位点Ⅱ。运用Autodock4.2程序分别对HBCD与BSA在结合位点Ⅰ和Ⅱ处结合进行理论模拟研究。结果表明,当HBCD进入BSA结合位点Ⅰ处与其结合时吉布斯自由能(ΔG)为-6.5 kcal·mol-1,而进入结合位点Ⅱ处的ΔG为+4.3 kcal·mol-1。可见HBCD与BSA会更倾向于在结合位点Ⅰ进行自发结合。最佳模拟结果如图2(a)和(b)所示。

图2 HBCD与BSA在结合位点Ⅰ的相互作用图(a):BSA与六溴环十二烷结合图;(b):结合位点Ⅰ放大图;(c):Ligplus+软件分析2D图;(d):Ligplus+软件分析3D图Fig.2 The interaction between HBCD and BSA at site Ⅰ(a):BSA and HBCD interaction model;(b):Enlarged view of binding site Ⅰ;(c):Analysis of figure using Ligpius+;(d):Analysis of 3D figure using Ligpius+
由于BSA的结合位点Ⅰ中有能够产生荧光的氨基酸残基有Tyr和Trp,而结合位点Ⅱ中仅有Tyr。因此,利用结合位点Ⅰ和结合位点Ⅱ结构的差异以及Tyr/Trp性质的差异,通过同步荧光和改变激发波长实验可进一步确认HBCD与BSA的结合位点。
2.2.1 同步荧光实验
固定λem-λex=15 nm时,测得蛋白质中Tyr的光谱;固定λem-λex=60 nm时,测得Trp的光谱。由图3可见,随着HBCD浓度的增加,Tyr的荧光强度下降幅度很小,几乎不变[图3(a)],而Trp的荧光强度呈现规律性下降[图3(b)]。该结果表明HBCD与BSA的结合位点在Trp附近,即两者在结合位点Ⅰ结合。

图3 HBCD对BSA同步荧光光谱的影响Fig.3 Effect of HBCD on the synchronous fluorescence spectra of BSA[BSA]=3.33×10-6 mol·L-1,[HBCD]=(0,3.33,6.66,9.99,13.33)×10-6 mol·L-1(a):Δλ=15 nm;(b):Δλ=60 nm
2.2.2 不同激发波长下的荧光光谱实验
当激发波长为280 nm时,Trp和Tyr的荧光同时被激发;激发波长为295 nm时,只有Trp的荧光被激发。因此,比较两个不同激发波长处,荧光强度下降的程度,可以判断出HBCD与BSA的结合位点。荧光实验表明在HBCD浓度由3.33×10-6mol·L-1增至3.33×10-4mol·L-1的过程中,280 nm处荧光强度下降程度始终大于295 nm。当HBCD浓度达到3.33×10-4mol·L-1时,280 nm处荧光强度下降了64%,明显大于295 nm处荧光下降强度47%,表明Trp和Tyr的荧光强度在HBCD与BSA作用过程中均被抑制,此实验再次证明HBCD与BSA在结合位点Ⅰ进行结合。这一结果与分子对接结果、同步荧光光谱实验结果一致。
2.3 HBCD与BSA体系结合位点数与结合常数的确定
小分子与蛋白大分子相互作用的结合位点数n与结合常数Ka可以由式(1)[10]得到
log[(F0-F)/F]=logKa+nlog[Q]
(1)
式(1)中,F0及F分别为BSA单独存在以及加入HBCD形成复合体系后的荧光强度,Ka为结合常数,n为结合位点数,[Q]为HBCD的浓度。以log[(F0-F)/F]对log[Q]作图,通过直线的斜率与截距得到n值与Ka值,结果列于表1中。不同温度条件下,HBCD与BSA的结合位点数n均约为1,说明两者发生结合作用时只有1个结合位点;随着体系温度的上升,结合常数Ka逐渐下降,表明HBCD对BSA的荧光的猝灭机制为静态猝灭。

表1 六溴环十二烷与牛血清白蛋白结合作用的结合常数与热力学参数Table 1 The binding constant and the thermodynamic parameters of BSA-HBCD at different temperatures
2.4 HBCD与BSA的热力学参数及作用力类型
从本质上分析,有四种主要类型的非共价相互作用力存在于配体与蛋白质的结合过程中,分别是:静电作用力,氢键,范德华力以及疏水作用力[11]。通过分子对接得到HBCD与BSA结合的最佳构象后,利用LigPlus+软件分析HBCD与BSA之间的相互作用。如图2(c)所示,HBCD与5种氨基酸之间具有疏水作用力,其中3种是疏水性氨基酸(Trp,Phe,Leu),2种是亲水性氨基酸(Lys,His),由此可以初步推测HBCD与BSA结合的主要作用力是范德华力。
热力学参数是确定分子间作用力的主要依据,为进一步确认HBCD与BSA的作用力类型,可通过不同温度条件下的荧光光谱实验得到三个不同温度下的结合常数,结合式(2)和式(3),计算得到三个热力学参数大小,进而判断作用力类型。若ΔH>0和ΔS>0,表明两物质间的作用力类型为疏水作用;若ΔH<0和ΔS>0,表明两物质间的作用力类型为静电作用力;若ΔH<0和ΔS<0,表明两物质间的作用力类型为氢键或范德华作用力[12]。当温度变化不大时,系统的焓变与熵变可视为常数。焓变与熵变通过式(2)计算得到,系统的吉布斯自由能变化通过式(3)计算得到。
lnKa=-ΔH/RT+ΔS/R
(2)
ΔG=ΔH-TΔS=-RTlnKa
(3)
式(2)和式(3)中,Ka为HBCD与BSA结合的结合常数,R是气体常数,以lnKa对-1/T作图,由直线的斜率和截距分别得到ΔH和ΔS,计算结果见表1。由表1可知,ΔG<0,说明HBCD与BSA的结合反应是自发进行的,ΔH<0和ΔS<0,说明HBCD与BSA之间主要作用力类型为范德华力或氢键。
2.5 HBCD与BSA间能量转移
根据Forster能量转移理论,两种化合物分子间满足供能体发出荧光,供能体的荧光发射光谱和受体的吸收光谱有重叠或者供能体和受体足够的接近,且最大距离在7 nm范围内时,将会有非辐射能量转移。按照相关方程处理HBCD的紫外吸收光谱与BSA荧光光谱的重叠谱图(图4)。得到J=3.413×10-15cm3·mol·L-1,R=2.04 nm,r=3.45 nm。计算机模拟的结果表明BSA与HBCD间的结合距离为3.40 nm[图2(d)],该值与实验结果接近,进一步说明实验的可靠性。r<7 nm表明HBCD与BSA间存在非辐射能量转移,从而导致BSA荧光猝灭。
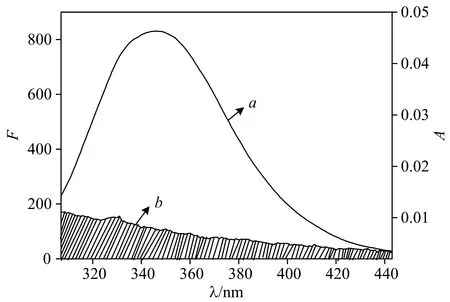
图4 BSA的荧光发射光谱(a)和HBCD的紫外吸收光谱(b)Fig.4 Fluorescence emission spectra of BSA (a) and UV absorption spectra of HBCD (b)[BSA]=[HBCD]=3.33×10-6 mol·L-1
2.6 HBCD对BSA二级结构的影响
2.6.1 分子动力学模拟
通过分子动力学模拟(MD)可以研究HBCD与BSA复合物在水溶液中的动力学情况。根据均方根偏差(RMSD)及蛋白质二级结构变化可以判断HBCD对BSA二级结构的影响。BSA与HBCD形成的复合体系的均方根偏差如图5(a)。研究体系的RMSD值在2 ns以后变化幅度很小,说明HBCD能够与BSA形成稳定的复合物,并且复合物体系稳定。进一步分析BSA处于游离态与稳定态时的二级结构,如图5(b)所示,其中无规则卷曲(coil)、弯曲(Bend)、β-折叠(Turn)、α-螺旋(α-Helix)、5-螺旋(5-Helix)、3-螺旋(3-Helix)的含量都不发生变化,且具有统计学意义。说明HBCD不会改变BSA的二级结构。
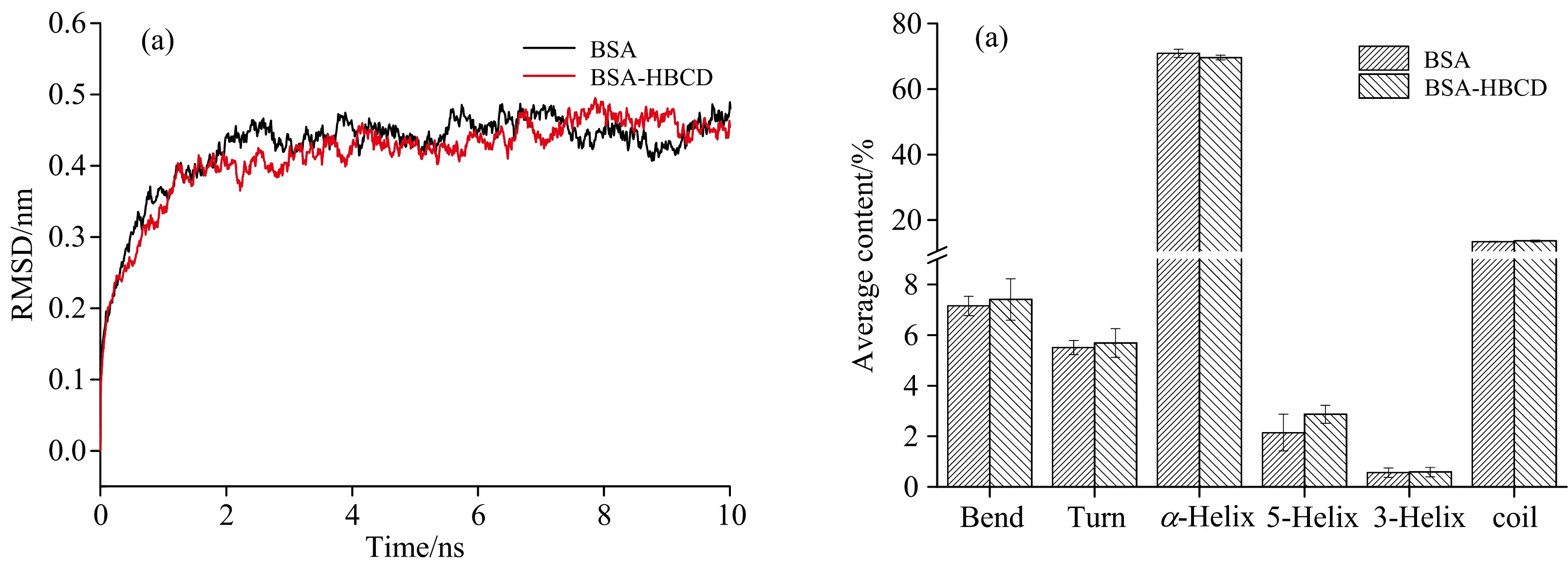
图5 HBCD对BSA的RMSD(a)和二级结构含量(b)的影响Fig.5 RMSD (a) and the average contents of Secondary structure (b) of BSA
2.6.2 HBCD与BSA的三维荧光光谱分析

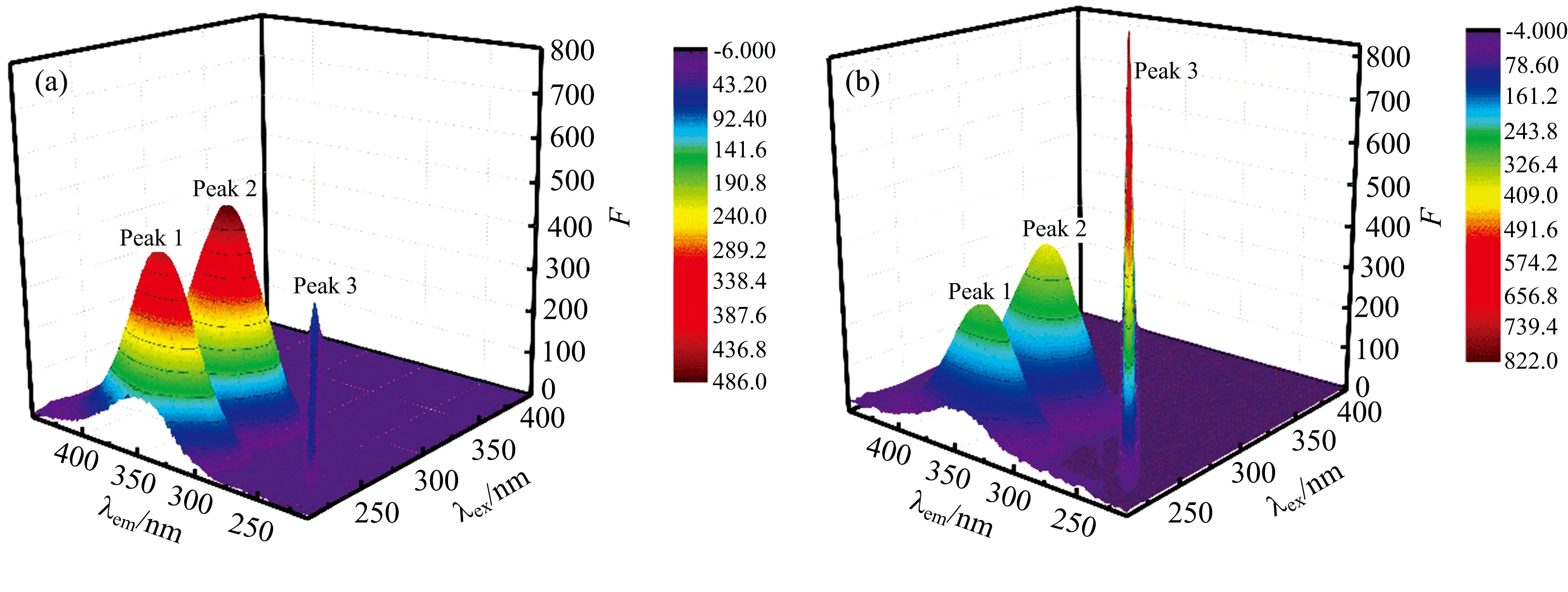
图6 BSA和BSA-HBCD的三维荧光光谱图Fig.6 Three-dimensional fluorescence spectra of BSA and BSA-HBCD[BSA]=[HBCD]=3.33×10-6 mol·L-1
3 结 论
通过整合多种光谱学技术以及计算机模拟技术,本文探究了HBCD与BSA之间相互作用的化学本质。HBCD通过静态猝灭和非辐射能量转移导致BSA内源荧光猝灭;根据计算结果可知HBCD与BSA的结合位点数为1,结合常数为2.796 6×104L·mol-1(288 K),2.194 1×104L·mol-1(293 K),1.174 4×104L·mol-1(298 K);HBCD会自发地与BSA在结合位点Ⅰ进行结合,两者的结合距离为3.45 nm。ΔH<0,ΔS<0,ΔG<0,表明HBCD与BSA之间自发结合过程是熵增加、吉布斯自由能减小的过程,结合作用力主要为范德华力或氢键;HBCD与BSA结合不会使BSA的构象发生改变。本实验的研究结果能够帮助人们在一定程度上理解溴系阻燃剂在生物体内的运输机制,为研究HBCD的毒理机制提供重要的理论基础。
