番茄SlIWS1基因植物表达载体构建与瞬时表达
2021-05-11王莹莹徐焕焕陈丹阳王瑞鹏牛向丽
王莹莹,徐焕焕,陈丹阳,王 洋,王瑞鹏,牛向丽
(合肥工业大学 食品与生物工程学院,安徽 合肥 230601)
0 引 言
番茄(Solanumlycopersicum)是研究植物抗病分子机制中常用的模式植物,也是营养丰富、用途广泛的经济作物[1]。病害发生是导致番茄产量和品质降低的重要原因,因此提高番茄抵御病害的能力十分必要[2]。植物抗病始于识别病原微生物,进而激活体内与抗病相关基因的表达[3]。IWS1(interact withSPT61)基因最先在酵母和哺乳动物中发现,因其与转录延伸因子SPT6 (Suppressor of Ty6)相互作用而被发现和命名。已有研究认为,SPT6可以结合组蛋白H3,作为转录延伸因子促进RNA聚合酶Ⅱ (RNA polymerase Ⅱ, RNAPⅡ)的转录延伸,在多个基因的转录延伸和mRNA加工中发挥调控作用[4]。IWS1通过与SPT6等蛋白质形成复合体,提高RNAPⅡ所转录基因的表达[5-6]。而在DNA损伤等条件下,SPT6和IWS1蛋白会被降解,RNAPⅡ将停止转录,整个转录组都会受到影响[7]。在植物相关研究中,拟南芥AtIWS1基因被发现与抗病基因的转录有关,可以做为特异性激活通路的作用靶点,它的表达增强了植物对病原菌的抵抗力和耐受性。AtIWS1基因的突变则会导致拟南芥植株变得矮小而易染病[8]。
但在番茄中SlIWS1基因的抗病防御功能研究很少。细菌性斑点病(bacterial speck)是番茄种植生产过程中的主要细菌病害,对植株的叶、茎、花和果实都可以产生影响[9],其病原微生物为丁香假单胞菌番茄致病变种(Pseudomonassyringaepv.tomato,Pst),是一种革兰氏阴性细菌[10]。本文通过对丁香假单胞菌接种后番茄中SlIWS1基因的表达检测,以及SlIWS1基因克隆、植物表达载体构建和瞬时表达,探讨SlIWS1与细菌病害的关联,并为其功能分析提供依据。
1 材料与方法
1.1 实验材料
1.1.1 植物材料
番茄(Solanumlycopersicum)、烟草(Nicotianabenthamiana)植株种植于合肥工业大学屯溪路校区人工气候培养室。
1.1.2 载体与菌株
pEASY-Blunt克隆载体、植物表达载体pBTEX-FLAG(带有植物组成型启动子CaMV35S、FLAG蛋白标签),由本实验室保存。大肠杆菌(Escherichiacoli)菌株DH5a、根瘤农杆菌(Agrobacteriumtumefaciens)菌株GV2260、丁香假单胞杆菌菌株P.syringaepv.tomatoDC3000(PstDC3000)、P.syringaepv.tomatohrcC mutant(PsthrcC),由本实验室保存。
1.1.3 试剂药品
Trizol、反转录酶购于Invitrogen公司;TransStart®FastPfu DNA Polymerase、质粒提取试剂盒、DNA纯化试剂盒、琼脂糖胶回收试剂盒购于北京全式金生物技术有限公司;T4 DNA Ligase购于Thermo Scientific;限制性内切酶(KpnⅠ、XholⅠ、SalⅠ)购于大连宝生物公司;FLAG标签小鼠单克隆抗体购于美国Sigma公司;引物设计采用Primmer Premmier 5.0软件,由上海生工生物工程技术服务有限公司合成;其他试剂均为国外原装或国产分析纯。
1.2 实验方法
1.2.1 RNA的提取与反转录
分别取MgCl2、PstDC3000、PsthrcC真空渗透法接种处理的野生型番茄,以及PstDC3000接种处理的感病株系prf3[11]、抗性株系PtoR[12-13]的植株叶片,提取总RNA。取1 μg总RNA反转录合成cDNA。
1.2.2 番茄SlIWS1基因的克隆
根据SlIWS1基因(XM-004233331)编码区序列设计巢式聚合酶链式反应(polymerase chain reaction,PCR)引物,引物序列为:
IWS1F1:TCACAAGTAGAGTAAACAAAGTCC,
IWS1R1:ACATGCGGCACCATTTAATC;
IWS1F2:CTTCCGCGGATGAGTTACAACAACGATCCGTAC,
IWS1R2:CATGGGCCCCTAGAGGTACTTCACCATGCCAC。
引入KpnⅠ、XolⅠ酶切位点,然后以上述番茄叶片cDNA为模板,对SlIWS1基因进行PCR扩增;并以番茄Actin(XM-004233331)做为内参基因,引物序列为:
SlActin-F:CGAGCAGTGTTTCCCAGTATT,
SlActin-R:AGCCTGGATAGCAACATACATAG。
对PCR产物进行琼脂糖凝胶电泳。将SlIWS1基因扩增产物进行纯化,与pEASY-Blunt载体连接、转化DH5a感受态细胞。挑取单克隆培养后进行菌落PCR鉴定,将阳性克隆提取质粒进行KpnⅠ、XholⅠ 酶切,并进行测序,构建pEASY-IWS1-Blunt载体。
1.2.3SlIWS1基因植物表达载体的构建
以KpnⅠ、SalⅠ酶切pBTEX-FLAG载体。DNA片段切胶回收后,进行连接、大肠杆菌转化,经菌落PCR鉴定、测序验证,构建CaMV35S::BTEX-IWS1-FLAG载体(命名为pBTEX-IWS1-FLAG)。将测序正确的载体导入农杆菌GV2260,筛选鉴定阳性克隆,-80 ℃保存备用。
1.2.4 SlIWS1在烟草叶片中的表达
本文采用农杆菌介导瞬时表达方法[14-16],将转入pBTEX-IWS1-FLAG载体的农杆菌进行划线培养。挑取单菌落于3 mL LB 液体培养基(利福平 100 mg/L、卡那霉素 50 mg/L)中,28 ℃下200 r/min 培养 24 h;吸取300 μL菌液于2.7 mL培养液中,28 ℃转接培养7 h;然后将菌液离心,加入3 mL 诱导液(AB盐、IM培养液、200 mmol/L乙酰丁香酮、25 mg/mL卡那霉素),重悬培养11 h。暗处静置10 min,吸取2 mL菌液离心,以2 mL 诱导缓冲液(50 mmol/L 2-吗啉乙磺酸、200 mmol/L乙酰丁香酮)重悬细胞,测定OD600吸收值,调整至OD600=0.8;取一次性注射器,去掉针头吸取农杆菌菌液,注入生长约5周的烟草的上部叶片中,36 h后收取样品,-80 ℃保存备用。
1.2.5 SlIWS1蛋白表达情况的检测
利用Western Blot检测SlIWS1蛋白的表达情况。将上述烟草叶片样品取出,液氮研磨后取约200 mg加入200 μL蛋白提取液(50 mmol/L三羟甲基氨基甲烷、150 mmol/L氯化钠、5 mmol/L乙二胺四乙酸、10%甘油、1%聚乙烯吡咯烷酮、20 μmol/L二硫苏糖醇、1 mmol/L苯甲基磺酰氟),充分涡旋后放置于冰上10 min,12 000 r/min,4 ℃离心10 min。然后吸取上清80 μL,加入上样缓冲液进行聚丙烯酰胺凝胶电泳(100 V 1.5 h)、转膜(250 mA 1 h)、牛奶封闭1 h和抗体结合,检测SlIWS1蛋白的表达情况。
2 结果与分析
2.1 番茄SlIWS1基因克隆
以MgCl2、PstDC3000、PsthrcC真空渗透法接种处理野生型番茄,PstDC3000接种处理的感病株系prf3、抗性株系PtoR植株叶片cDNA为模板,番茄Actin为内参基因,PCR扩增产物如图1所示。图1中,M代表DNA Marker;1~3分别代表接种对照MgCl2溶液、病原菌PstDC3000、PsthrcC于野生型番茄;4~5分别代表接种PstDC3000于感病番茄品系prf3和抗病番茄品系PtoR。从图1可以看出,扩增产物为与预期大小(1 572 bp)基本一致的特异条带。接种丁香假单胞杆菌病原菌株PstDC3000后,野生型番茄中SlIWS1基因表达水平明显升高;接种无type Ⅲ分泌系统的突变菌株PsthrcC也同样可以增加SlIWS1的表达量;在接种PstDC3000的感病番茄品系prf3、抗病番茄品系PtoR中也检测到SlIWS1的表达。
将PCR扩增产物纯化后与pEASY-Blunt载体连接,连接产物转化大肠杆菌DH5a感受态细胞,经阳性克隆鉴定其结果,如图2所示;取阳性克隆进行质粒提取、双酶切鉴定其结果,如图3所示,酶切后获得了预期大小SlIWS1基因片段,并进一步通过测序验证,结果表明所扩增基因确实为番茄SlIWS1基因编码序列。
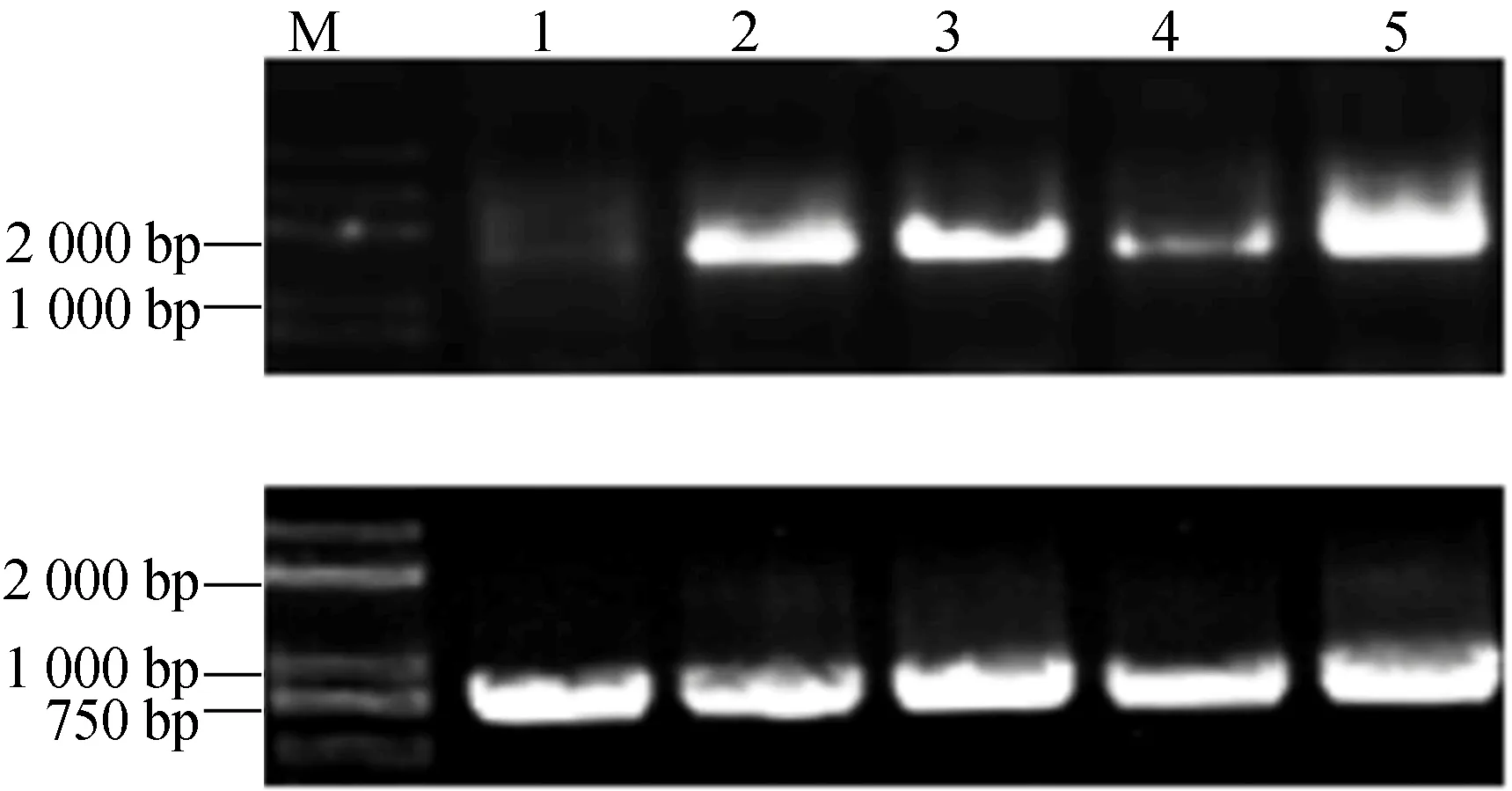
图1 番茄SlIWS1基因PCR扩增产物

M.DNA Marker;1~13.转入SlIWS1基因pEASY-Blunt连接产物

M.DNA Marker 1.pEASY-IWS1-Blunt质粒 2.pEASY-IWS1-Blunt质粒Kpn Ⅰ、Xho Ⅰ酶切图3 pEASY-IWS1-Blunt酶切鉴定
2.2 SlIWS1基因植物表达载体构建
将已测序的pEASY-IWS1-Blunt载体按照1.2节方法所述进行酶切、胶回收,连接于植物表达载体pBTEX-FLAG,并转化大肠杆菌DH5a感受态细胞。通过菌落PCR鉴定,获取阳性单克隆进行测序测定,测序结果表明SlIWS1已连接于植物表达载体pBTEX-FLAG,完成pBTEX-IWS1-FLAG载体构建。
2.3 烟草叶片中表达SlIWS1
将转入pBTEX-IWS1-FLAG载体的农杆菌单克隆,经1.2节方法所述培养、注射于烟草叶片中。通过提取注射叶片总蛋白、聚丙烯酰胺凝胶电泳和免疫印迹,检测到预期大小IWS1蛋白的表达,如图4所示。结果表明所构建番茄SlIWS1基因载体可以在植物体内进行表达,可用于进一步的蛋白质相互作用检测实验。
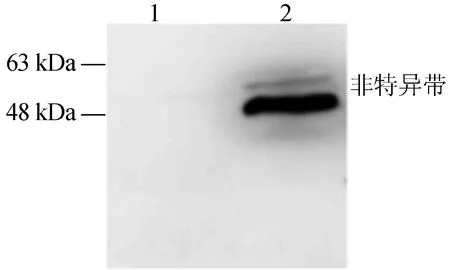
1.pBTEX-FLAG载体 2.pBTEX-IWS1-FLAG载体图4 免疫印迹检测SlIWS1在烟草中的表达产物
3 讨 论
IWS1基因的功能首先在酵母系统中进行了报道[17]。在酵母中,IWS1做为转录调节因子能够与组蛋白甲基化转移酶互作,共同调节下游基因的转录延伸,而组蛋白的甲基化可以调节基因的表达或关闭,决定基因的活性[18]。随后发现,IWS1是在动植物体中均存在并参与重要调控的基因[19]。在拟南芥中,IWS1由植物激素油菜素内酯(Brassinosteroid,BR)转录因子BES1组装到靶基因,调节BR应答基因的表达,从而控制植物体的生物与非生物胁迫响应、细胞伸长、细胞分化和光形态建成等[20]。IWS1通过BR信号通路发挥调控植株发育、提高抗病能力的功能。IWS1功能缺失突变体表现为半矮化,植株抵御病害能力减弱。在罗汉果中,四倍体植株的抗病能力优于普通二倍体植株,也相应发现IWS1基因表达水平高于二倍体[21]。在牡丹花中,IWS1稳定表达可做为内参基因[22];而番茄同源SlIWS1基因在抗病防御系统中功能尚未进行系统研究。在本文中,接种番茄斑点病病原菌可以诱导SlIWS1基因表达水平明显升高,表明SlIWS1基因参与番茄的免疫防御应答。
番茄是研究果实发育、抗病防御反应的模式植物,相应实验体系较为完备。根据已有的研究报道[23-24],在病原微生物-植物相互作用体系中,植物通过识别病原物的鞭毛等保守分子、或注入植物细胞内的特异效应蛋白,启动下游防御基因的转录激活。无论哪一种识别应答均需调控特定基因的转录与延伸,因此SlIWS1基因可能在番茄的防御应答中发挥上游调控作用,而本文对SlIWS1的基因克隆、植物表达载体构建和植物体内蛋白表达检测(体内蛋白表达显示2条带,其中一条带为抗体的非特异带),将为后续进行SlIWS1蛋白质相互作用和基因功能分析提供依据。
