原发性闭角型青光眼脉络膜厚度的变化
2021-05-10迪丽尼格尔艾克拜尔穆塔里甫
迪丽尼格尔·艾克拜尔,穆塔里甫
0引言
原发性闭角型青光眼(primary angle-closure glaucoma,PACG)是普遍存在于亚洲的一种青光眼类型,在我国尤为突出。全球超过四分之三(76.7%)的PACG患者在亚洲[1]。自1990/2015年,在我国PACG患者从322万上升至714万。2015年,我国一半以上的(54.42%)青光眼患者为PACG[2]。房角关闭的最初机制尚未被完全揭示。Sng等[3]证实眼前段解剖结构的变化仅能解释三分之一的原发性急性房角关闭(acute primary angle-closure,APAC)。Quigley等[4-6]提出脉络膜的膨胀在房角关闭中起着重要的作用。他们认为脉络膜膨胀后向前推动晶状体-虹膜隔,从而引起或加重了房角的关闭。然而,脉络膜膨胀机制尚需进一步证实。随着频域光学相干断层扫描增强技术(enhanced depth imaging optical coherence tomography, EDI-OCT)的产生,实现了脉络膜高质量图像的获取,有利于观测脉络膜厚度(choroidal thickness, CT)[7-8]。本研究通过测量CT及眼轴长度(axial length,AL)、前房深度(anterior chamber depth, ACD)探讨它们的相关性,探讨原发性急性闭角型青光眼(acute primary angle-closure glaucoma,APACG)及原发性慢性闭角型青光眼(chronic primary angle-closure glaucoma,CPACG)与CT的相关性,为不同类型PACG患者CT的变化提供参考。
1对象和方法
1.1对象研究对象为本院2019-01/2020-05期间符合纳入标准的PACG患者及正常对照组。纳入标准:(1)患者年龄40~80岁。(2)包含APACG及CPACG。(3)屈光介质清晰。(4)通过EDI-OCT得到黄斑区图像清晰,能够准确测量CT。(5)患者均未接受任何抗青光眼治疗。诊断标准:根据国际区域性流行病学眼科学会(International Society of Geographical and Epidemiological Ophthalmology,ISGEO)的分类系统将PACG分为:(1)可疑原发性房角关闭(primary angle-closure suspect,PACS):Goldmann房角镜静态下≥180°范围内均无法见色素小梁网且眼压低于21mmHg,无周边部虹膜前黏连或视神经及视野的损害;(2)原发性房角关闭(primary angle-closure,PAC):指周边虹膜黏连或眼压升高(房角镜静态下房角关闭范围>180°),但无视神经及视野损害;(3)PACG:原发性房角关闭伴视神经的损害。诊断为PACG的患者根据临床发展规律与其病理发展过程相结合,分为APACG和CPACG。APACG患者有房角突然关闭且范围较大、眼压明显升高等特点,CPACG患者的房角黏连由点到面的逐步发展,眼压逐步上升等特点。APACG组、CPACG组分别与正常组进行比较。排除标准:(1)晶状体脱位、葡萄膜炎、虹膜新生血管、外伤、肿瘤或任何晶状体明显混浊引起晶状体膨胀而继发青光眼;(2)糖尿病及原发性高血压;(3)任何内眼手术;(4)无法行超声生物显微镜及房角镜检查;(5)高度近视及高度远视,等效球镜度数大于-6D或+6D;(6)视网膜脱离或视网膜色素上皮层的脱离;(7)任何引起视网膜异常的疾病,如脉络膜新生血管,无症状的视网膜色素上皮层脱离及近视引起的脉络膜萎缩;(8)屈光介质混浊或低质量图像从而无法准确测量CT。正常对照组纳入标准:年龄40~80岁;Goldmann房角镜静态下房角开放,无视神经损害,除了轻度白内障外无其它眼病,无任何内眼手术病史;随机纳入正常对照组。本研究得到新疆医科大学第一附属医院伦理委员会审核,同意进行临床研究。所有研究对象知情并签署知情同意书。
1.2方法首先,所有受试对象由一位经验丰富的眼科医师进行裂隙灯、眼压、Goldman房角镜、+78D间接眼底镜(Ocular,Bellevue,WA,USA)检查。纳入眼行超声生物显微镜(ultrasoundbiomicroscopy,UBM)、光学生物测量仪(IOL Master)、眼部B超、视野检查。除此之外,使用全自动电脑验光仪完成验光。ACD是由UBM测得,AL由IOL Master获取。ACD:为角膜内表面与晶状体前表面的垂直距离。完成上述步骤后,由一位操作熟练的眼科技师完成EDI-OCT检查。所有测量的数据由两位医师用双盲法单独测量后取平均值。CT:是由视网膜RPE层到外层高反射带的距离,此高反射对应的是巩膜。本研究测量的位点包括黄斑中心凹下、距黄斑中心凹2mm鼻侧、颞侧、上方、下方的CT,分别标记为黄斑中心凹下脉络膜厚度(SFCT),鼻2mm(N 2mm)、颞2mm(T 2mm)、上2mm(S 2mm)、下2mm(I 2mm)。获得的图像在脉络膜和巩膜之间具有最佳可视化效果,称为脉络膜-巩膜界面(choroidal sclera interface,CSI)。如果图像没有可清晰识别的CSI,则将拍摄其他图像以产生最佳CSI。

2结果
2.1三组受检者人口统计学特征的比较三组性别和眼压差异有统计学意义(P<0.05)。APACG组、CPACG组眼压较正常组高且APACG组眼压明显高于CPACG组(P<0.001),见表1。

表1 三组受检者人口统计学特征的比较
2.2三组眼前段生物学参数及黄斑区脉络膜厚度的比较表2显示ACD、AL在三组间均有差异(P<0.001),针对这两个参数进行两两比较后得到:APACG组与CPACG组间在AL上差异无统计学意义(P=0.75),其余均有差异(P<0.001)。然而,三组间每个位点CT差异均无统计学意义(P>0.05)。正如以往的研究结果,PACG患者具有较短的AL,较浅的ACD。其次,APACG相对于CPACG具有ACD更浅等特征。

表2 三组眼前段生物学参数及黄斑区脉络膜厚度的比较
2.3一元线性回归分析各位点CT的相关因素分析性别、年龄、眼压、AL、ACD与各位点CT的关系。所有方位的CT与AL呈负相关,即AL越长,CT越薄。N 2mm、I 2mm还与年龄、ACD呈负相关关系,SFCT与年龄、AL呈负相关关系(所有B<0,P<0.05),即年龄越大、ACD越浅、眼轴越长,N 2mm、I 2mm越薄;年龄越大、眼轴越长,SFCT越薄。性别、眼压与所有位点的CT相关系数无统计学意义(P>0.05),见表3~5。
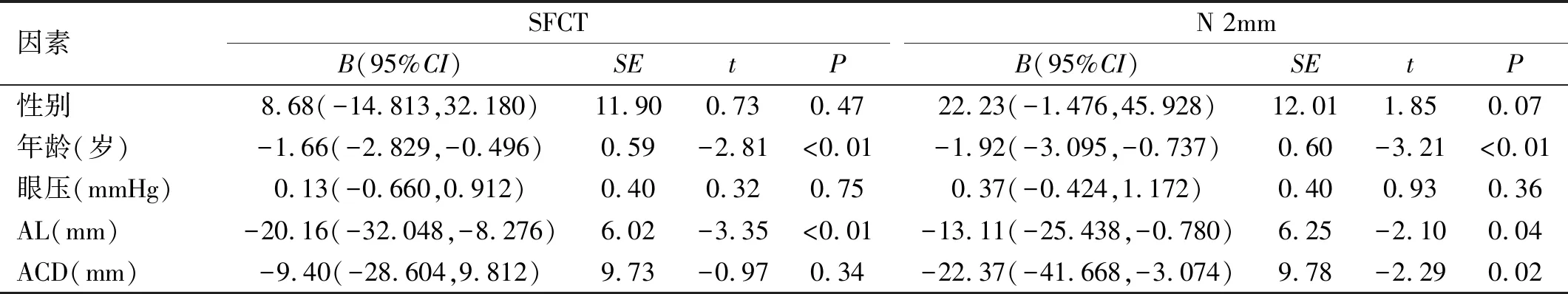
表3 一元线性回归分析SFCT、N 2mm的相关因素
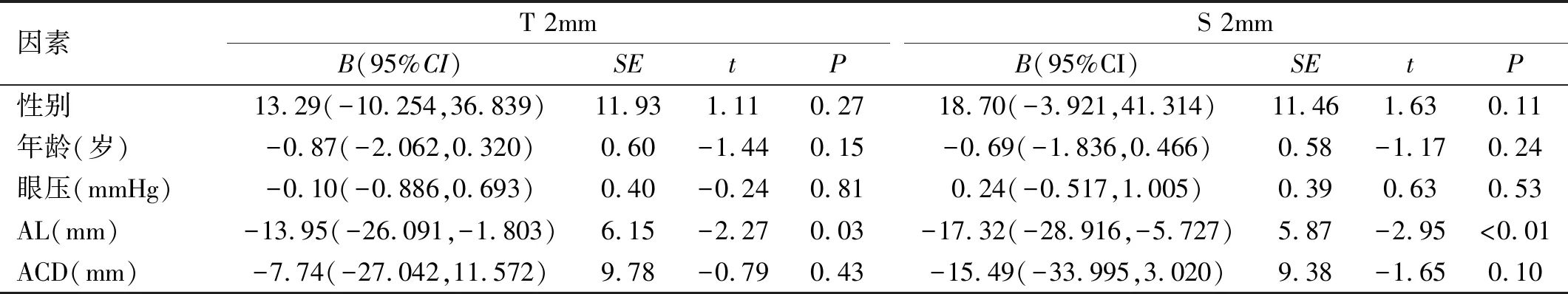
表4 一元线性回归分析T 2mm、S 2mm的相关因素

表5 一元线性回归分析I 2mm的相关因素
2.4多因素Logistic回归分析APACG的影响因素以APACG为因变量(0,正常组;1,APACG组),将单因素分析有统计学意义的变量纳入到多因素Logistic回归模型中分析,自变量包括性别、AL、ACD、各位点CT,结果表明变薄的S 2mm与APACG有相关性,其余位点CT及AL、ACD、性别均不是APACG的影响因素。APACG组与正常组比较时S 2mm的OR值<1,即它每增加1μm发生APACG是之前的0.975倍(95%CI0.953,0.997),见表6。
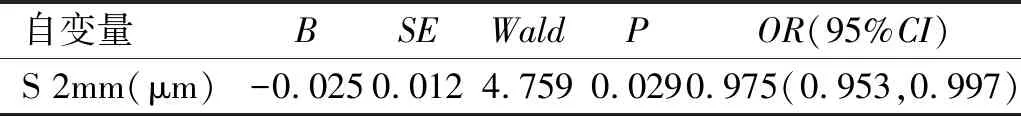
表6 多因素Logistic回归分析APACG的影响因素
2.5多因素Logistic回归分析CPACG的影响因素以CPACG为因变量(0,正常组;1,CPACG组),将单因素分析有统计学意义的变量纳入到Logistic回归模型中分析,单因素Logistic回归分析发现性别不是CPACG的影响因素(P>0.05),故自变量包括AL、ACD、各位点CT,结果表明只有ACD是发生CPACG的影响因素,即ACD是CPACG的保护因素,它每增加1mm发生CPACG是之前的0.005倍(95%CI:0.001,0.033),见表7。

表7 多因素Logistic回归分析CPACG的影响因素
3讨论
房角关闭的主要机制是瞳孔阻滞机制。PACG的发生有较多的危险因素,包括年龄的增长,女性,浅ACD,短AL,小角膜直径以及位置较靠前或(和)较厚的晶状体。此外,PACG在中国人中更普遍[2],由此可以得出不同种族的房角关闭机制可能不同。研究发现,即使在校正年龄、体质量指数、眼压、种族和眼球生物学参数后,仍可得到女性患PACG的风险比男性高[9]。本研究再次证实了PACG具有短AL、浅ACD的解剖学特征。其次,APACG组与性别有相关性并且女性较男性多,而CPACG组与性别无相关性。这结果一定程度上回答了为什么同样具有较拥挤的眼前段结构的PACG患者一部分发展为APACG,而另一部分发展为CPACG。
此研究分别探讨了APACG急性发作期及CPACG患眼与CT的相关性。与之前的研究相比,本研究的不同之处是APACG患者急性发作期眼压异常高,平均为46.40±11.05mmHg。在评估PACG患者的CT时,国内外学者热衷于比较SFCT,有些学者会另加几个距中心凹鼻侧、颞侧、上方、下方1mm及3mm处CT[10-12]。然而,本研究除测量SFCT外,还测量了距黄斑中心凹鼻侧、颞侧、上方、下方2mm处CT。不难看出,变薄的S 2mm与APACG有相关性,APACG组与正常组比较时S 2mm的OR值<1,即它每增加1μm发生APACG是之前的0.975倍(95%CI:0.953,0.997)。然而,CT与CPACG不存在相关性,可能是长期的高眼压刺激和短暂急剧的眼压升高引起的脉络膜血流的变化不同。
尽管我们仅仅测量了黄斑区4mm范围的区域,但是我们发现各位点CT的分布存在较大的变化。我们得到三组CT按大小顺序排列如下,APACG:SFCT>T 2mm>S 2mm>I 2mm>N 2mm,CPACG:T 2mm>SFCT>S 2mm>I 2mm>N 2mm,正常人:SFCT>T 2mm>S 2mm>I 2mm>N 2mm。其中,CPACG组黄斑区CT分布情况比较新颖,现有文献中尚未报道。除CPACG组外,其余两组SFCT最厚,这可能与黄斑区更高的代谢需要有关。N 2mm处CT最薄,这可能与眼球发育有关。但是,确切的机制需要进一步研究。
CT与诸多因素有关,例如:脉络膜变薄与年龄的增长[13-14],高眼压[15]及长AL[13-14]有关。本研究测得每一位点CT与眼压无相关性。所有位点CT与AL呈负相关,即AL越长,CT越薄。N 2mm、I 2mm还与年龄、ACD呈负相关关系,即年龄越大、ACD越浅、眼轴越长,N 2mm、I 2mm越薄。同时,本研究得到S 2mm的变薄与APACG相关,这可能是眼球扩张使得中心凹上方脉络膜受到较大的牵拉,从而导致S 2mm变薄。因此,临床实践中应对AL较长的PACG患者给予重点关注。一些学者通过校正与CT相关因素后,提出PACG患眼CT会增厚[11-12,16],他们认为CT的增厚使晶状体、虹膜等结构向前推导致房角的关闭。Zhou等[17]在研究PACG与CT的相关性时,发现PACG组的CT比正常对照组厚并且经过多因素分析后得到CT是PACG的危险因素。还有学者比较同一APAC患者急性发作眼与对侧眼的CT后得出急性发作眼CT明显比对侧眼厚[18]。这与Quigley等[4-6]脉络膜膨胀机制相符。Aung等发现,APACG急性发作眼及对侧眼行虹膜切开术术前2wk及术后2wk眼球生物学相关参数未发生显著的变化[19]。上述研究及本研究结果均不支持脉络膜膨胀引起的晶状体-虹膜隔前移假说,瞳孔阻滞机制,高皱褶虹膜机制等机制可能单独或一起引起房角关闭,脉络膜膨胀机制需进行大量研究证实。
APACG急性发作期CT变薄机制尚未被诠释,可能有以下几个原因:CT部分取决于经葡萄膜巩膜房水流出途径从睫状肌束间进入脉络膜上腔的房水[20]。研究表明局部使用抗胆碱药物使睫状肌松弛,导致SFCT明显增加[21]。因此,在APACG急性发作期前房角的突然关闭引起通过葡萄膜巩膜途径的房水流出量下降,可能会导致CT变薄。
脉络膜是一个富含血管的组织,它在维持外层视网膜高代谢中起着重要的作用[22]。眼球长期处于高眼压状态下会压迫脉络膜血管,引起脉络膜血流的减少。在Akahori等[23]的研究中,人为压迫眼球使眼压升高后,引起脉络膜血流的减少从而导致CT变薄。有学者报道,在怀疑患有APACG眼睛中,眼压的升高会伴随CT的变薄。通过有效地治疗使眼压下降并恢复到正常范围后,引起CT显著的增加,考虑眼压恢复正常后脉络膜突然肿胀[15,24]。
CT变薄又一可能机制是眼球处于高眼压状态下使脉络膜血管直径减小或(和)脉络膜毛细血管塌陷[25-26]。虽然有些学者报道CT与眼压存在相关性,但是本研究以及其他一些研究[12-13]表明两者之间无关联性。但是,AL与眼压正相关这一论点广泛被接受。随着眼压的升高,巩膜-角膜由于眼球的膨胀而伸展,这好比气球,随着气压的增加,容积变大。Chen等[10]及Saeedi等[27]发现PACG及原发性开角型青光眼患者行青光眼滤过手术后,随着眼压的下降脉络膜扩张和AL变短。Song等[28]得到APACG急性发作期随着眼压的升高,CT变薄同时AL变长。因此,我们推测眼压虽然不是引起CT变化的直接原因,但是它可能通过影响AL间接改变CT。
Hata等[24]观察到,PACS患者在进行暗室试验时,眼压急剧增加7mmHg的同时CT变薄30μm,并且AL变长。脉络膜体积的增加是发生APACG或者PACG的触发因素还是疾病导致的眼球生物学参数的变化尚无定论。为证实CT与PACG的因果关系,未来的研究应增大样本量,测不同种族PACG患者发作之前,期间及之后的CT并做前瞻性研究观察CT的动态变化。
本研究同时存在下列几个不足之处:(1)我们仅测量了APACG急性发作时的CT,发作之前及之后一段时间CT怎么变化不得而知。(2)CT的测量是手动进行的,故随机误差无法避免。然而,测量是由同一位经验丰富的医师进行,并测两次后取平均值作为最终结果尽可能减少误差。(3)样本数量有限,样本只从一个医疗中心抽取。未来患者来自多中心的研究可能会提供更准确的结果。但是,我们没有理由认为本研究样本量不具有代表性。(4)本研究及国内外的研究仅测量几个位点的CT。但是,脉络膜是富含血管且部分为不规则的组织,因此某个位点的数值不能代表完整的脉络膜组织。
综上所述,对于PACG的发病机制的解剖危险因素如角膜较小、前房较浅、眼轴长度较短、晶状体相对较厚已经被我们所熟知,虽然已有研究认为脉络膜厚度在房角关闭机制中起到一定作用,但其具体病理生理过程仍需进一步探索。今后我们需要通过大量临床试验研究葡萄膜组织及脉络膜静脉系统,确定脉络膜厚度在PACG中的变化。同时,得知脉络膜厚度相关因素要对高危人群进行筛查,还应对参与发病的各因素进行深入研究,并界定其参数范围。这正是未来原发性房角关闭的主要研究方向之一。本研究的结果为未来研究APACG发作时眼球解剖结构的变化机制以及这种变化在APACG进展中的病理生理作用开辟了新的方向。
