Survivin和VEGF反义寡核苷酸联合转染对舌癌的作用*
2021-05-08于肖鹏李晓光万光勇李腾宇王延秀
于肖鹏 李晓光 万光勇 李腾宇 王延秀 高 静 姚 瑶
1.泰安市中心医院口腔科,2.疼痛科,山东 泰安 271000
舌癌的发病率占口腔癌首位[1], 恶性程度比较高,且转移的发生较早,对患者的生命安全造成严重威胁。前期研究表明血管内皮生长因子(VEGF) 在舌癌组织中表达较高,与舌癌等多种肿瘤的增殖、发生、发展密切相关[2-5]。生存素(Survivin)是现今所知最强的凋亡抑制因子,研究表明其在舌癌组织中亦表达较高[6-9]。与舌癌疾病的预后和发生、发展关系密切。本实验用脂质体(Lip)为载体,转染生存素反义寡核苷酸(Survivin-ASODN)与血管内皮细胞生长因子反义寡核苷酸(VEGF-ASODN)到 Tca8113舌癌细胞,观测对癌细胞凋亡增殖的影响。
1 实验材料和方法
1.1 实验材料
Tca8113舌癌细胞株由泰安市中心医院中心实验室保存。Gibco公司提供RPMI 1640培养液。委托大连宝生物公司合成ASODN,Survivin-ASODN的核苷酸序列为 5’-CCACGGCCTCCCAAAGTGCTG-3’,VEGF-ASODN的核苷酸序列为:5'-TGGCTTGAAGATGTACTCGAT- 3',核苷酸均行硫代磷酸化修饰。优级新生胎牛血清(民海生物公司)。免疫组织化学试剂盒(武汉博士德生物公司)。Invitrogen公司提供阳离子脂质体Lipofectamine TM 2000(LIP)。美国BD公司产流式细胞仪。
1.2 实验方法
1.2.1细胞的培养与转染 Tca8113舌癌细胞培养在含100 ml/L胎牛血清(FBS)的RPMI 1640液中,条件为37 ℃、5%CO2。实验分组为:①空白实验对照组(实验时只加入细胞培养液),②脂质体实验组(只加入脂质体),③VEGF-ASODN组(VEGF-ASODN+LipofectamineTM 2000转染),④Survivin-ASODN组(Survivin-ASODN+LipofectamineTM 2000转染),⑤联合ASODN组(VEGF-ASODN+Survivin-ASODN+LipofectamineTM 2000转染),总共5组,每组分别设5个平行孔,将已净化处理的玻片预置孔内。将对数生长期Tca8113舌癌细胞接种于6孔板,每孔5×105个癌细胞,放入孵箱(37 ℃、5%CO2)培养,24 h后舌癌细胞融合约80%左右进行实验。转染体积为2 ml,ASODN最终浓度为500 ng/ml,转染后24 h收集舌癌细胞进行后续实验检测。
1.2.2免疫组化检测Survivin、VEGF蛋白表达 按照试剂说明以SABC免疫组织化学法常规操作。转染24 h后,细胞爬片由培养孔中取出,PBS冲洗爬片3次,每次5 min。爬片用4%多聚甲醛液浸泡固定。3%过氧化氢去除内源酶,分别用Survivin兔抗人单克隆抗体、兔抗人VEGF单克隆抗体加入癌细胞爬片。阳性对照分别用已知Survivin及VEGF阳性的乳腺癌切片作对照,阴性对照采取第一抗体用PBS替代作对照,用DAB显色,再用苏木精复染,用光镜观察癌细胞爬片免疫组化染色结果。Survivin、VEGF阳性染色判断标准为癌细胞核或者细胞质内含有棕褐色颗粒。
1.2.3流式细胞仪实验方法测定细胞凋亡 细胞常规转染培养24 h,用胰酶消化孔中癌细胞,再加入PBS(无Mg2+、Ca2+)3~4 ml,混匀成为单细胞悬液,然后离心以去除上清液,癌细胞注入70%、4 ℃冷乙醇中,置入冰箱4 ℃固定癌细胞18 h,调整癌细胞为106个/ml,再加入1.5 ml碘化丙啶染液,内含RNA酶A,进行DNA染色,冰浴暗处保存30 min,尼龙网过滤,上机检测各项指标。
1.2.4四唑盐法检测癌细胞生长的抑制率及测定生长曲线 取呈对数生长期舌癌细胞,以细胞密度1×104/(100 μl·孔)接种于96孔板,细胞培养24 h后转染ASODN,分组为5组,与上述实验相同。每组设置平行孔8个,另外设置空白调零孔,孔内加入细胞培养液100 μl,不加入癌细胞和转染液,各组分别转染24、48、72 h,然后终止培养,进行下一步实验,加四唑盐(MTT)溶液(5 mg/ml)20 μl/孔,溶液混匀继续孵育4 h(5%CO2、37 ℃条件下),然后吸弃培养液,加入二甲基亚砜(DMSO,100 μl/孔),摇振10min。根据空白对照孔对酶标仪进行调零,然后在490 nm波长处检测各个细胞培养孔的吸光度(absorbance,A)值。每个组取各个复孔平均值,A值为纵轴,时间为横轴,绘制Tca8113舌癌细胞的生长曲线。细胞抑制率=(空白对照组所测A值-实验组所测A值)÷对照组所测A值×100%。
1.3 免疫组化实验结果及其判断方法
应用光学显微镜检测癌细胞爬片染色结果,细胞质或细胞核有棕黄色颗粒为Survivin、VEGF蛋白表达阳性(图1、2)。染色结果定量分析,使用HPIAS-1000彩色病理高清晰图文计算机分析系统。每张癌细胞爬片选取无非特异性染色、细胞棕黄色阳性颗粒清晰、能反映该片染色强度部位,选取4个视野,200倍镜头下检测爬片的光密度(OD)值,取其均值作为结果。
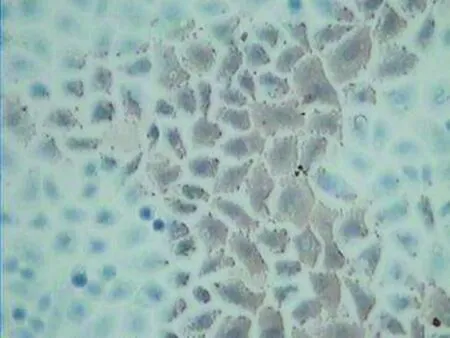
图1 VEGF阳性Tca8113舌癌细胞浆内含棕褐色颗粒(免疫组化DAB染色×400)
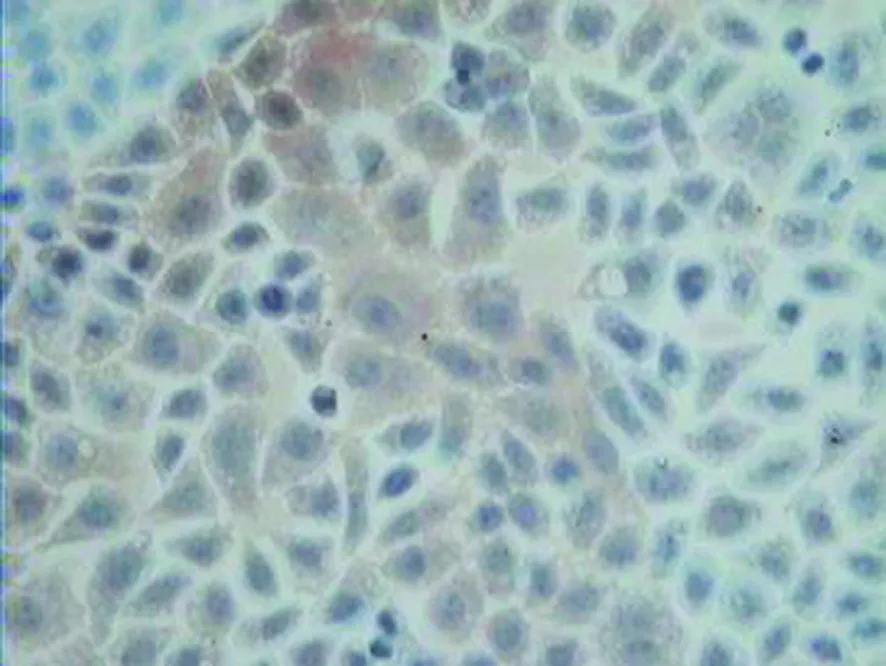
图2 Survivin阳性Tca8113舌癌细胞浆内含棕褐色颗粒(免疫组化DAB染色×400)
1.4 统计学方法
2 结 果
2.1 细胞中Survivin、VEGF蛋白表达检测结果
取Survivin、VEGF免疫组织化学染色细胞爬片,在光学显微镜下观察,转染组与脂质体组、对照组相比,其细胞染色比较浅,阳性细胞的计数减少。而空白实验对照组癌细胞的Survivin、VEGF蛋白表达水平与脂质体组比较差异无统计学意义(P>0.05) ,Survivin-ASODN及VEGF-ASODN转染组与空白对照组、脂质体组间差异均有统计学意义(P<0.01,P<0.05),联合转染组Survivin、VEGF蛋白表达较单独转染组差异有统计学意义(P<0.01),说明单独转染Survivin-ASODN和VEGF-ASODN均可分别降低Survivin、VEGF的表达,联合转染效果更加明显。见表1。

表1 细胞中VEGF和Survivin蛋白含量检测结果
2.2 Tca8113舌癌细胞的凋亡测定结果
检测转染后各组癌细胞的细胞周期分布和凋亡情况,并与对照组的癌细胞情况比较,发现联合转染组和单独转染组癌细胞凋亡率均较脂质体组、空白对照组明显增加(P<0.01),而且联合转染组凋亡率与单独转染组凋亡率比较亦有差异(P<0.01),说明单独转染Survivin-ASODN和VEGF-ASODN均可分别增强细胞凋亡率,联合转染效果更加明显。见表2。

表2 各组舌癌细胞周期、细胞凋亡的测定结果(%,n=5)
2.3 四唑盐方法测定各组癌细胞抑制率和生长曲线
癌细胞的生长曲线图显示,脂质体组和对照组基本上平行,两组之间差异无统计学意义(P>0.05)。联合转染组和单独转染组的细胞生长曲线与脂质体组、对照组的生长曲线比较差异则有统计学意义(P<0.01), 其生长曲线明显变得平缓,提示联合转染组和单独转染组的舌癌细胞受到明显抑制(表3、图3)。

表3 不同转染时间各组舌癌细胞生长抑制率

图3 转染不同时间各组Tca8113细胞生长曲线图(与对照组、脂质体组、VEGF-ASODN组、Survivin-ASODN组之间的比较,P<0.01)。
3 讨 论
在大于1~2 mm的肿瘤转移灶内部及周围,需要新生血管形成,以供应营养,否则难以继续生长,VEGF是至今所发现的最强的促进新生血管形成因子。现发现口腔癌中VEGF呈现高度表达,并且与其转移和患者预后明显正相关[2-5],实验证实,通过抑制VEGF与受体的结合,降低肿瘤的血管形成就可以抑制肿瘤的增殖和转移[10]。我们的前期研究表明,VEGF-ASODN对癌细胞增殖抑制明显[11-12]。 Survivin具有选择性表达的特性[13],它是凋亡抑制蛋白 (inhibition of apoptosis,IAP) 家族的重要成员之一,在多种恶性肿瘤中呈现高度表达,同时和患者的预后不良正相关[6-9],而成年人的正常组织不表达Survivin。同时Survivin选择性表达在细胞增殖G2/M 期,又具有细胞周期特异性,有丝分裂纺锤轴的微管能够与Survivin结合,而微管的运动又可以调节Survivin基因的表达水平,但当其出现过度表达时,则难以与微管相分离,这时候就会发生持续抗凋亡作用。Survivin在人类几乎所有肿瘤组织中都有表达,具有对抗抗癌药物以及Fas、caspase-3、Bax、caspase-7等基因所诱导的细胞凋亡作用[14-15],由此降低抗癌药物的效果和促进肿瘤细胞的增殖。由此我们考虑将抗血管生成方法和促进癌细胞凋亡方法结合起来,进行双靶点基因治疗,希望能够取得更好的抑制肿瘤生长效果,并探讨Survivin与VEGF反义寡核苷酸联合治疗对舌癌的影响。
“反义核酸技术”在1984年首次提出[16],通过碱基互补原理,抑制或封闭基因表达。反义寡核苷酸(antisense oligodeoxynucleotides,ASODN)可以介导靶mRNA 的降解、抑制DNA复制、转录和转录后加工翻译[17],起到抑制靶基因功能的作用。有以 Survivin、VEGF、c-myc、bcl-2等为靶基因的ASODN研究表明,其能够促进肿瘤细胞凋亡同时抑制增殖[18-19]。但是不能完全抑制肿瘤生长,例如单独应用VEGF-ASODN可以减缓肿瘤细胞的增殖,但不能达到根除癌细胞的效果[19]。现发现VEGF 和Survivin表达有正相关性,互相促进表达进而促进肿瘤生长[20]。在非小细胞肺癌和膀胱癌[21-23]等的研究中均发现了VEGF和Survivin基因表达的相关性,Survivin可以上调 VEGF基因表达,增加血管生成而促进肿瘤生长。研究表明,细胞凋亡与肿瘤血管的生成及转移以及肿瘤的发生、发展均密切相关联,而这一切同时与VEGF和Survivin的表达亦密切相关。有学者[24]用VEGF诱导静止期内皮细胞分裂的实验中发现,细胞中Survivin基因表达升高了近16倍,说明Survivin可能是VEGF的保护基因,协同促进VEGF维持细胞的正常增殖。Mesri等[25]将Survivin-ASODN导入内皮细胞,发现VEGF的抗凋亡活性明显受到了抑制,血管网发生了明显的退化,提示在促进肿瘤组织血管生成中,VEGF可能通过上调Survivin基因的表达而发挥其抗内皮细胞凋亡作用。这些研究提示二者的联合检测和联合应用可能成为肿瘤诊断和靶向治疗新途径。
本研究采用Survivin-ASODN和VEGF-ASODN联合转染的方法,从蛋白、细胞水平研究其对Tca8113舌癌细胞的影响。本实验表明,Survivin-ASODN及VEGF-ASODN明显抑制其相应基因的表达水平(P<0.01),联合转染效果更加明显(P<0.01)。在本组流式细胞仪测定中,ASODN转染组细胞凋亡明显增高(P<0.01),说明VEGF-ASODN及Survivin-ASODN可诱使肿瘤细胞发生凋亡,联合转染效果也是更加明显(P<0.01)。细胞生长活性的实验表明,联合转染组与单独转染组均显著降低了癌细胞的生长能力。癌细胞生长曲线提示,转染反义寡核苷酸后,其相应的生长曲线明显平缓,生长活性减低,同时降低了生长速度,与单独应用相比,联合转染组表现出了比单ASODN更强的抑制肿瘤生长的作用效果,差异非常明显(P<0.01)。分析通过联合转染,既可以抑制其相应的基因和蛋白表达,又可以两者作用叠加,效果亦更加明显。本实验结果表明,VEGF 和Survivin双靶点ASODN联合应用治疗舌癌,效果优于单靶点。Survivin-ASODN和VEGF-ASODN对体内Tca8113舌癌细胞的效果,尚需动物以及临床实验证实。本实验为舌癌的多基因联合治疗提供了可靠的理论依据。
