远端肢体缺血预处理对氯胺酮致发育期大鼠大脑皮层H M GB1和COX-2表达的影响
2021-05-08贾雲雲李安琪邓立琴孟尽海
贾雲雲,李安琪,马 万,邓立琴,孟尽海,张 春
(1.宁夏医科大学临床医学院,银川 750004;2.宁夏医科大学总医院麻醉科,银川 750004;3.宁夏医科大学颅脑疾病重点实验室,银川 750004)
氯胺酮作为N-甲基-D-天冬氨酸(NMDA)离子通道阻滞剂,被广泛应用于危重患者和小儿麻醉手术。有研究[1]表明,在大脑发育早期暴露于氯胺酮可导致神经损伤,但氯胺酮导致神经损伤的机制尚不清楚[2]。也有研究表明,远端肢体缺血预处理(remote limb ischemic preconditioning,RIPC)可通过再灌注早期激活自噬来减轻动物的大脑损伤,下调炎性因子,减少大脑梗死面积,降低脑水肿程度,改善神经功能紊乱[3-4]。但RIPC对氯胺酮所造成的神经毒性是否有保护作用,尚未见报道。高迁移率族蛋白B1(HMGB1)和环氧合酶-2(COX-2)是与神经炎性和神经变性相关的两种常见炎性因子,可驱动包括认知能力下降在内的神经退行性疾病的发病因素,参与疾病的发生发展[5-6]。已有研究表明,大剂量氯胺酮暴露可致炎性因子表达失衡[7]。因此,本研究通过观察RIPC对氯胺酮致发育期大鼠大脑皮质神经因子HMGB1和COX-2表达的影响,探讨RIPC对氯胺酮损伤的发育期大鼠神经是否具有保护作用。
1 资料与方法
1.1 实验动物
5日龄健康新生SD大鼠48只(雌雄各24只),体质量7~13 g。新生SD大鼠和母鼠共同饲养在温度(24±2)℃和湿度(50±5)%可控的室内,昼夜交替,母鼠自由喂养乳鼠。实验动物购自宁夏医科大学实验动物中心,实验动物许可证号为SCXK(宁)2020-0001。
1.2 药品与试剂
氯胺酮(福建古田制药厂);Rabbit anti-COX-2、Rabbit anti-HMGB1(美国abcam公司,型号:ab15191,ab79823);细胞色素C氧化酶亚基Ⅱ(COX-2)检测试剂盒、HMGB1检测试剂盒(武汉云克隆公司,型号:SED284Ra 96T,SEA399Ra 96T);免疫组化兔二步法检测试剂盒(中杉金桥公司)。
1.3 实验分组及方法
将5日龄大鼠随机分为4组,每组12只(雌雄各6只),对照组(C组):出生第7天时经腹腔注射生理盐水,剂量为8 mL·kg-1,每2 h注射1次,共连续注射6次,持续1 d;RIPC组:出生第5天时用纱布绳绑住右后肢根部,用拉力器拉伸2.5N后观察肢体颜色变化,颜色发绀即为缺血,持续5 min后解开纱布绳,皮肤由发绀转为潮红,即为再灌注,持续5 min,共连续进行4个周期(缺血5 min,再灌注5 min为1个周期),48 h后经腹腔注射生理盐水,剂量为8 mL·kg-1,每2 h注射1次,共6次;氯胺酮组(KTM组):出生第7天时经腹腔注射氯胺酮,剂量为20 mg·kg-1(用生理盐水将氯胺酮溶液稀释至2.5 mg·mL-1,注射容量为8 mL·kg-1),药物注射后立即将大鼠放置于37℃恒温保温箱中,给予4 L·min-1低流量氧气吸入,仔细观察大鼠呼吸频率及皮肤颜色的变化,氯胺酮共注射6次,每次间隔2 h;氯胺酮组+RIPC(K+R组):出生第5天时行RIPC,方法同RIPC组,48 h后给予氯胺酮注射,方法同KTM组。最后一次药物注射完毕后,观察动物变化,直至大鼠生命体征正常,条件反射完全恢复后,返回母鼠身边喂养。
1.4 观测指标
1.4.1 酶联免疫吸附(ELISA)法检测大鼠血清中COX-2、HMGB1水平 每组随机选取6只大鼠,末次药物注射完成后12 h,采用水合氯醛麻醉,经心脏采血,室温静置后离心提取血清,采用ELISA试剂盒(武汉云克隆公司)进行检测,实验流程根据说明书进行,对比标准曲线分析各组大鼠血清中HMGB1、COX-2的浓度。
1.4.2 qRT-PCR法检测大鼠大脑皮质中COX-2和HMGB1的mRNA表达 经1.4.1心脏采血后的大鼠,采用生理盐水灌注心脏,于冰上断头取脑,分离大脑皮质组织于-80℃冰箱保存备用。制备大脑皮质匀浆液,提取总RNA,测定其浓度,然后将mRNA反转录为cDNA,-80℃保存备用。大鼠COX-2、HMGB1、GAPDH的基因引物序列均由上海生工设计和合成,见表1。于PCR仪上进行扩增,总反应体系是25μL,实验过程严格依据说明书进行。各组大脑皮质HMGB1、COX-2的mRNA表达水平根据2-ΔΔCt法计算。

表1 qRT-PCR引物序列
1.4.3 Western blot法检测大鼠大脑皮质中COX-2和HMGB1的蛋白表达 取1.4.2获得的脑组织,采用全蛋白提取试剂盒提取蛋白,将提取后的蛋白离心,取上清液保存备用。采用标准BCA法测定蛋白浓度,取等量已定量的蛋白经10%SDS-PAGE电泳分离,湿转膜法转膜,牛奶封闭,加入兔抗COX-2抗体(1∶1000)、兔抗HMGB1抗体(1∶5000),4℃孵育过夜。经TBST洗膜后,分别加入相对应的二抗稀释液,室温下孵育75 min,TBST洗膜后使用ECL检测试剂盒进行发光显影,以GAPDH为内参,Image J软件计算COX-2、HMGB1的表达水平。
1.4.4 免疫组化法检测大鼠大脑皮质COX-2、HMGB1的表达水平 末次药物注射完成12 h后,将每组剩余的6只大鼠用4%多聚甲醛经心脏灌注固定后,断头处死,于冰上取大脑组织石蜡包埋、切片,采用免疫组化兔二步法检测试剂盒进行实验,具体操作步骤参考说明书。通过分析软件IPP6.0分析统计额叶大脑皮质HMGB1和COX-2阳性细胞占比,比较不同处理组间HMGB1、COX-2的阳性细胞占比。
1.5 统计学方法
采用SPSS 22.0统计软件进行数据分析,符合正态分布的计量资料以均数±标准差(±s)表示,组间比较采用单因素方差分析,进一步两两比较采用LSD-t法。P≤0.05为差异有统计学意义。
2 结果
2.1 各组大鼠血清中COX-2和HMGB1蛋白含量
ELISA检测结果显示,C组和RIPC组大鼠血清中COX-2、HMGB1蛋白含量差异均无统计学意义(P均>0.05),KTM组和K+R组血清中COX-2、HMGB1蛋白含量均较C组升高(P均<0.05);与KTM组相比,K+R组血清中COX-2、HMGB1含量均减少(P均<0.05),见表2。
表2各组大鼠血清中COX-2、HMGB1水平比较(±s,ng·mL-1)

表2各组大鼠血清中COX-2、HMGB1水平比较(±s,ng·mL-1)
与C组比较*P<0.05;与KTM组比较#P<0.05。
?
2.2 各组大鼠大脑皮质中HMGB1、COX-2的mRNA水平比较

图1各组大鼠大脑皮质中HMGB1的mRNA表达情况比较
qRT-PCR检测结果显示:与C组相比,RIPC组HMGB1、COX-2的mRNA表达差异无统计学意义(P>0.05),KTM组和K+R组HMGB1、COX-2的mRNA表达均较C组及RIPC组升高(P均<0.05);与KTM组相比,K+R组HMGB1、COX-2的mRNA表达降低(P<0.05),见图1、图2。
2.3 各组大鼠大脑皮质HMGB1、COX-2的蛋白表达水平
Western blot检测结果显示,C组和RIPC组大脑皮质HMGB1、COX-2蛋白表达差异无统计学意义(P>0.05)。与C组及RIPC组比较,KTM组和K+R组HMGB1、COX-2蛋白表达均升高(P均<0.05)。与KTM组比较,K+R组HMGB1、COX-2的蛋白表达均降低(P均<0.05),见图3、图4。

图2 各组大鼠大脑皮质中COX-2的mRNA表达情况比较
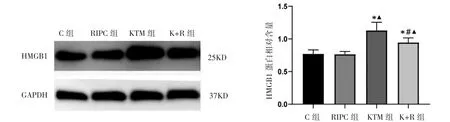
图3 各组大鼠大脑皮质HMGB1蛋白的表达情况比较
2.4 各组大鼠大脑皮质HMGB1和COX-2的阳性表达细胞
免疫组化检测结果显示,HMGB1表达在细胞核上,阳性细胞表现为细胞核内黄褐色颗粒沉积。COX-2表达在细胞质上,阳性细胞可见核周围细胞质出现棕黄色颗粒沉淀;通过免疫组化染色可以观察到各组大鼠大脑皮质中HMGB1和COX-2的表达和定位,C组和RIPC组大鼠大脑皮质HMGB1、COX-2免疫组化染色阳性细胞占比差异无统计学意义(P>0.05)。与C组及RIPC组比较,KTM组和K+R组HMGB1、COX-2阳性细胞占比均增高(P均<0.05)。与KTM组比较,K+R组HMGB1、COX-2阳性细胞占比均降低(P均<0.05),见图5、图6。
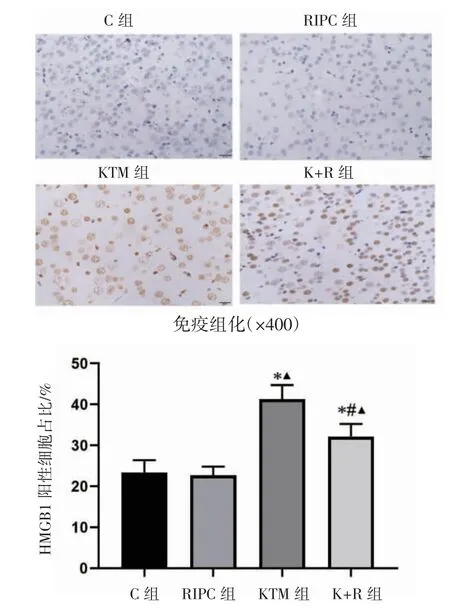
图5 各组大鼠大脑皮质HMGB1阳性细胞表达
3 讨论

图6 各组大鼠大脑皮质COX-2的阳性细胞表达
有研究[8]表明,常用的全身麻醉药可能导致发育中的啮齿类动物大脑功能的缺失,发生广泛的神经细胞凋亡,从而降低神经传导效率,引起持续性的学习和记忆能力下降等认知功能障碍[9]。已知NMDA受体在调节神经元的生存、迁移、突触的形成中起着关键的作用[10-11]。NMDA受体激活是学习和记忆获取并巩固的重要步骤[12],NMDA表达减少在额叶皮层中观察到受体和细胞凋亡,NMDA受体的阻断会导致记忆障碍,并与一系列记忆性神经障碍密切相关。氯胺酮作为常见的全身麻醉药品之一,被广泛地应用于危重症患者及婴幼儿的手术麻醉,氯胺酮作为NMDA阻滞剂,可通过拮抗NMDA受体发挥其麻醉作用[13-14]。近年来,有研究报道大剂量、反复注射氯胺酮会降低哺乳类动物大脑皮质、海马CA1区的神经密度和树突棘密度,导致发育敏感期动物大脑皮质和海马CA1区神经元的退行性变和神经细胞的凋亡[15],故本实验选用新生大鼠大脑皮质作为研究标本。大脑发育敏感期反复暴露于大剂量氯胺酮会引起大量的神经细胞损伤和长期的认知功能障碍,其中出生后第7天对于啮齿类动物而言为致麻醉神经毒性最为敏感的时期[16],故本实验将新生第7天的大鼠作为研究对象。氯胺酮神经毒性的作用取决于暴露的时间和剂量,仅在高剂量重复注射和延长暴露时间的情况下观察到了神经退行性病变[8],故本实验采用氯胺酮20 mg·kg-1多次经腹腔注射观察其促炎因子的变化。COX-2和HMGB1是常见的促炎因子,可驱动神经退行性疾病的发病因素,参与降低神经认知能力,被认为是与神经认知障碍相关的神经炎症的常见生物标记物[17-18]。COX-2抑制剂对大脑皮质中促炎因子水平的增加有不同程度的衰减作用[19],抑制神经因子HMGB1的表达在神经退行性疾病中也具有神经保护作用[20]。有研究表明[7],大剂量、反复多次氯胺酮暴露于发育期啮齿动物,可导致其炎性因子表达升高,加剧其炎性反应,故本实验选用神经因子COX-2、HMGB1作为研究指标。该实验选取出生第7天的大鼠作为研究对象,参照文献[16]的实验方法,经腹腔行氯胺酮20 mg·kg-1反复多次注射,观察额叶大脑皮质和血清中神经炎性因子COX-2和HMGB1的表达情况。结果显示,新生大鼠多次注射大剂量的氯胺酮可致神经因子COX-2、HMGB1表达增加。RIPC是一种依赖于机体对缺血/再灌注损伤内源性保护模式的现象,它是指预先给予一个组织或器官非致死性的局部缺血来诱导机体产生缺血耐受状态,以保护远隔的组织或器官对后期的致死性缺血产生抵抗力,从而发挥其保护作用,改善预后的操作。文献[21]证实RIPC可通过诱导缺血耐受来刺激内源性保护机制,增加糖代谢,抑制细胞凋亡,降低脑缺血体积,改善紊乱的神经功能,从而减轻缺血脑卒中后缺血再灌注损伤。同时,RIPC可通过再灌注早期激活自噬来减轻大脑损伤,下调炎性因子,改善神经功能[3]。但RIPC是否对氯胺酮诱导的发育期大脑的神经毒性具有保护作用,目前尚未报道。本课题组推测RIPC可下调大剂量、反复多次氯胺酮暴露所致的神经炎性因子COX-2、HMGB1的表达,设计RIPC作为一种氯胺酮暴露的保护措施,于大鼠出生第5天行右后肢根部RIPC,48 h后暴露于氯胺酮,观察RIPC对氯胺酮所致神经因子COX-2、HMGB1的增高是否具有下调作用。结合本研究结果显示,大剂量、反复多次氯胺酮暴露可增高大脑皮质中神经因子COX-2和HMGB1的阳性占比、mRNA和蛋白表达水平及血清中的含量,但RIPC可减轻氯胺酮暴露所致的COX-2和HMGB1的变化,提示RIPC可通过调节神经因子COX-2和HMGB1的表达从而发挥神经保护作用,这一结果与RIPC诱导内源性神经保护机制的结论相吻合。
综上所述,发育期大鼠多次暴露于大剂量的氯胺酮会引起大脑额叶皮层和血清中神经因子COX-2和HMGB1表达增高,RIPC可下调氯胺酮所致发育期大鼠大脑皮质和血清中神经因子COX-2和HMGB1表达的升高。RIPC对氯胺酮所致的神经损伤具有保护作用,可以为以后氯胺酮临床麻醉提供新的临床治疗方案,从而减少麻醉药对新生儿大脑损伤的影响。
