影像组学在头颈部肿瘤诊疗中的应用进展
2021-05-08谷金铭王安然李泉江罗天友吕发金
谷金铭,王安然,李泉江,彭 娟,罗天友,吕发金
(重庆医科大学附属第一医院放射科,重庆400016)
0 引言
复杂的解剖结构和肿瘤异质性给头颈部肿瘤的精确诊断和个体化治疗带来了一系列挑战。目前的传统医学影像诊断仅限于观察肿瘤的解剖形态学改变,无法提供肿瘤内部异质性方面的信息,因此远远不能满足临床精准诊疗所需。而影像组学作为近年来的研究热点,可深入挖掘图像所包含的庞大的数字化信息,揭示图像的生物学本质,从而对肿瘤的异质性进行探讨,为临床诊疗提供更多可靠的量化信息[1]。影像组学这一概念由荷兰学者Lambin 首次提出[2],指高通量地从医学图像中提取定量特征,并进行数据分析、模型构建,从而为临床提供决策支持,其工作流程如图1 所示[1]。从国内外相关研究可知,影像组学目前在肺癌[3]、神经系统肿瘤[4]及腹部肿瘤[5]的诊疗中取得了较好的成果,但对头颈部肿瘤的研究相对较少。本文将对影像组学在头颈部肿瘤诊疗中的研究进展进行综述。
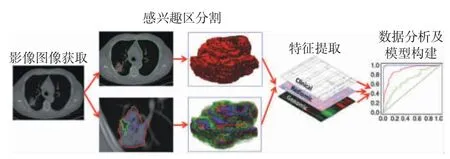
图1 影像组学工作流程图[1]
1 影像组学在头颈部肿瘤诊疗中的应用
目前,影像组学在头颈部肿瘤诊疗中的研究主要集中在头颈部鳞状细胞癌和鼻咽癌[6],这些研究提示影像组学在头颈部肿瘤的诊断与鉴别诊断、风险分层、疗效和副反应预测、基因表型预测等方面具有重要的意义。
1.1 头颈部肿瘤的诊断与鉴别诊断
头颈部肿瘤复杂多样,其诊断和鉴别诊断是临床工作的重点及难点。鳞状细胞癌是最常见的头颈部恶性肿瘤,有研究表明影像组学可有效提高头颈部鳞状细胞癌的诊断及鉴别诊断的准确率。Ramkumar等[7]对鼻腔鼻窦鳞状细胞癌和内翻性乳头状瘤患者的T1WI、T2WI 及增强T1WI 图像进行纹理分析,建立了用于鉴别诊断这2 种疾病的支持向量机模型,诊断准确率达89.1%,明显高于神经影像学专家(56.5%)。Fujima 等[8]探讨了磁共振伪连续式动脉自旋标记所获得的肿瘤血流量(tumor blood flow,TBF)及其直方图,分析在鼻腔鼻窦恶性淋巴瘤与鳞状细胞癌中的鉴别诊断价值,结果显示平均TBF、变异系数(coefficient of variation,CV)和峰度在这2 种疾病间具有显著差异,联合3 种参数鉴别诊断的准确率可达97%。Park 等[9]发现动态对比增强磁共振成像(dynamic contrast-enhanced magnetic resonance imaging,DCE-MRI)参数的直方图分析可用于鉴别诊断口咽鳞状细胞癌和恶性淋巴瘤,且血管外细胞外容积分数Ve的峰度是最有效的识别特征(准确率为86%、敏感度为83%、特异度为90%)。影像组学特征所包含的异质性信息可凸显不同肿瘤间的差异,从而提高肿瘤的鉴别诊断准确率,但现有的研究仅局限于几种常见的头颈部肿瘤。未来的研究应涉及更多的疾病类型,以满足复杂的临床诊断需求。
颈部淋巴结数量多,而淋巴结病变种类复杂,明确颈部淋巴结病变的性质和类型对临床诊疗具有重要意义,尤其是判断头颈部恶性肿瘤淋巴结转移与否,对肿瘤的分期、预后及治疗有重要影响。但临床工作中,颈部淋巴结病变常规影像学表现常常重叠或不典型,难以做出准确诊断,而影像组学具有这方面的优势。Seidler 等[10]结合梯度提升机和随机森林2种机器学习算法对患者颈部淋巴结的双能CT 图像进行纹理分析,用以区分头颈部鳞状细胞癌转移淋巴结、淋巴瘤、炎性淋巴结和正常淋巴结,其将淋巴结分为恶性(即淋巴瘤或头颈部鳞状细胞癌转移)和良性的准确率、特异度和敏感度均超过91%。石颉等[11]从弹性和B 型双模态超声图像中提取影像组学定量特征(包括形态学特征、影像强度特征和灰度共生矩阵特征),采用Adaboost 算法融合支持向量机分类器建立多分类模型(研究方法及流程如图2 所示),以区分良性淋巴结、淋巴瘤和转移性淋巴结,准确率达76.09%。相比以往仅从单模态医学图像中获取特征的研究,该研究挑战利用双模态图像进行影像组学研究,融合2 种检查技术的优势,突破了既往影像组学模型仅能鉴别诊断淋巴结良恶性的局限,建立多分类模型的同时区分3 种淋巴结病变,取得了较好的效果,这对其他部位肿瘤的研究具有一定启发意义。

图2 融合双模态影像组学定量特征的淋巴结多分类诊断流程图[11]
1.2 头颈部肿瘤的风险分层
TNM(tumor node metastasis)临床分期系统是肿瘤风险分层的重要指标,具有重要的临床应用价值。仅仅依靠常规的临床指标及影像学检查难以进行准确的术前分期。近年来,有研究表明纳入影像组学特征可提高临床分期的准确性。Zhang 等[12]从118 例晚期鼻咽癌患者的MRI 图像中提取影像组学特征(包括肿瘤的强度特征、形态学特征、纹理特征及小波特征,分析流程如图3 所示),发现均值、中位数、最大3D 值与鼻咽癌的总体分期呈明显正相关。同时,该研究联合影像组学特征与TNM 临床分期系统共同构建影像组学模型,并用C指数评价模型的判别效能,结果显示影像组学模型的诊断效能(C指数为0.761)明显高于单独TNM 临床分期系统的诊断效能(C指数为0.514)。不仅如此,该研究还融合临床数据、TNM 临床分期和影像组学特征共同建立了诺模图模型,该模型在预测鼻咽癌患者的无进展生存期方面具有优势。Ren 等[13]从127 例头颈部鳞状细胞癌患者的T2WI、增强T1WI 图像中提取970 个影像组学特征对头颈部鳞状细胞癌患者进行术前分期,其中有3 个特征在Ⅰ~Ⅱ期和Ⅲ~Ⅳ期头颈部鳞状细胞癌之间具有显著差异,分期准确率可达85.7%。施淑君等[14]依据病理结果将喉癌患者分为2 组(T1+T2 期设为A 组,T3+T4 期设为B 组),并利用纹理分析从患者的术前增强CT 图像中提取特征,结果发现峰度、逆差距和熵在2 组间具有统计学差异,可作为喉癌术前分期的依据。影像组学特征有效弥补了TNM 临床分期系统在肿瘤内部异质性信息方面的欠缺,对提高临床分期准确性具有重要意义。
病理分级也是肿瘤风险分层的一项重要指标,但目前尚缺乏有效的无创性手段进行术前的病理分级评估。近年来,已有研究探讨影像组学用于预测头颈部鳞状细胞癌病理分级的价值。Wu 等[15]通过核主成分分析法和随机森林方法从头颈部鳞状细胞癌患者的增强CT 图像中提取影像组学特征,用以区分高分化、中分化和低分化的头颈部鳞状细胞癌,准确率达92%。任继亮等[16]从Ⅰ~Ⅲ级舌和口底鳞状细胞癌患者的术前表观扩散系数(apparent diffusion coefficient,ADC)图像中提取纹理参数,其中ADC 值第10百分位数(ADC10)和熵为独立的预测因子,两者联合区分Ⅰ级与Ⅱ、Ⅲ级舌和口底鳞状细胞癌的AUC 为0.81。以上研究表明,从原发肿瘤病灶所提取的影像组学特征可较准确地预测头颈部肿瘤的TNM 临床分期和病理分级,但现有研究仅从原发肿瘤病灶中提取特征,未纳入淋巴结相关的信息,将两者特征联合能否提高影像组学模型的分级、分期准确性是一个值得探讨的问题。
除了TNM 临床分期和病理分级以外,人乳头瘤病毒(human papilloma virus,HPV)感染状态也是影响头颈部恶性肿瘤风险分层的一项重要指标。研究显示,相比HPV 阳性患者,HPV 阴性的头颈部鳞状细胞癌患者往往肿瘤危险程度更高,预后更差[17]。但目前尚缺乏公认、统一的HPV 标准检测方法,而影像组学的发展有望为HPV 感染状态的无创性检测提供新方法。Bagher-Ebadian 等[18]将187 例口咽癌患者分为HPV 阳性组和阴性组,并从患者的肿瘤增强CT图像中提取172 个放射学特征,其中12 个特征在2组间具有显著差异,且HPV 阳性患者的肿瘤影像特征更可能表现为较高的强度、较小的病灶面积、较大的球形度和较高的空间异质性。Buch 等[19]和Fujita等[20]的研究同样发现CT 图像纹理特征在不同HPV状态的头颈部鳞状细胞癌患者中具有显著差异。通过影像组学预测肿瘤的TNM 临床分期、病理分级及HPV 感染状态,可为临床评估肿瘤风险分层提供可靠、准确的量化指标。
肿瘤的风险分层是由临床参数、病理特征和影像学表现等多方面因素综合决定的,但目前的影像组学研究仅考虑到其中一种或少数几种因素,若能在影像组学特征的基础上联合应用更多的参数,如实验室检查指标、病毒感染状态等,将会做到更精准的风险分层评估,这也是未来影像组学的发展方向之一。
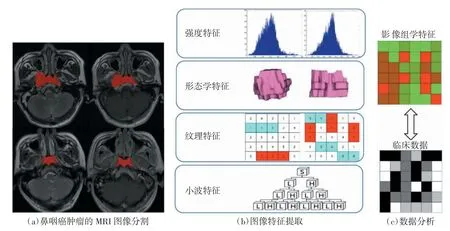
图3 基于鼻咽癌患者MRI 图像提取4 类影像组学特征的分析流程图[12]
1.3 头颈部肿瘤的疗效与副反应预测
放化疗是鼻咽癌、晚期头颈部鳞状细胞癌患者的重要治疗方法,但不同肿瘤及个体对放化疗的反应并不一致,寻找一种准确、可靠的肿瘤治疗反应预测指标,预先选择对放化疗敏感的个体,能够指导临床制订个性化的治疗方案。Wang 等[21]探讨影像组学特征对鼻咽癌患者诱导化疗早期疗效的预测能力,从120 例Ⅱ~Ⅳ期鼻咽癌患者的增强MRI 图像中提取筛选出15 个特征,其中均值、灰度共生矩阵(gray level cooccurrence matrix,GLCM)及高阶Gabor 是最稳定的特征,可有效预测患者的诱导化疗反应(无反应、有反应),AUC 为0.822。Zhai 等[22]从头颈部鳞状细胞癌患者的CT 图像中提取影像组学特征,并与临床常用特征相结合建立治疗前预测模型,该模型可有效识别出头颈部鳞状细胞癌患者放疗后可能治疗失败的病理淋巴结,从而进行强化治疗。Zhao 等[23]从鼻咽癌患者的MRI 图像中提取出19 个量化特征建立影像组学标签,并联合临床资料共同构建影像组学预测模型,该模型可有效区分诱导化疗应答者与非应答者,且影像组学特征的加入可明显改善临床诺模图模型的预测准确性(C指数分别为0.863 和0.549)。未来的影像组学研究不应止步于治疗前预测疗效,还可以应用于治疗后的疗效判断,实现对整个治疗过程的持续疗效监测,充分发挥影像组学在临床精准治疗中的潜能。
虽然放疗技术有效减缓了部分头颈部肿瘤的病情进展,但其导致的并发症仍不容忽视,如口干症、放射性脑损伤和感音神经性听力损失(sensorineural hearing loss,SNHL)等。Abdollahi 等[24]从47 例行三维适形放疗的头颈部肿瘤患者的耳蜗CT 图像中提取490 个图像特征,并采用10 种不同的机器学习算法来预测放化疗引起的SNHL,结果发现10 个特征与SNHL 状态相关,且不同机器学习算法的预测准确率均在70%以上。颞叶的放射性脑损伤是鼻咽癌放射治疗后最容易发生的神经系统并发症。连舟洋[25]采集了200 例鼻咽癌并发放射性脑损伤患者的T2WI、增强T1WI 图像,分别提取颞叶纹理特征以早期预测放疗引起的颞叶放射性损伤,结果显示联合T2WI及增强T1WI 纹理特征可取得最佳AUC(0.76),敏感度、特异度及准确率分别为59%、74%、68%。这些研究表明影像组学可预测放疗引起的副反应,建议临床缩短复查时间或提前干预治疗。但目前基于影像组学的疗效及副反应预测研究仅停留在实验阶段,由于样本量较少、图像数据无法标准化、手动分割图像可重复性差等问题,难以广泛应用于临床,这也是所有影像组学研究所面临的一个共同的难题。
1.4 头颈部肿瘤的基因表型预测
影像基因组学是将影像组学与肿瘤的基因组学相结合,建立肿瘤的基因表型与影像组学特征之间的联系,有助于临床医师了解肿瘤的基因表达情况[26]。近年来,影像基因组学在非小细胞肺癌和脑胶质瘤中的应用较多[27-28],但在头颈部肿瘤方面的应用较少。p53 基因是一种重要的肿瘤抑制基因,其表达状态与肿瘤的发生密切相关,大多数肿瘤存在p53 基因突变[29]。Dang 等[30]使用MRI 图像纹理分析对口咽鳞状细胞癌患者的p53 基因表达状态进行预测,筛选出7 个与p53 基因表达显著相关的纹理特征,其建立的模型预测p53 基因表达状态的准确率为81.3%。Zwirner 等[31]采集头颈部鳞状细胞癌患者的平扫CT图像,分析了用于测量肿瘤内异质性的3 个最佳放射学特征,并探讨其与327 个基因之间的关系,结果发现头颈部鳞状细胞癌患者的FAT1 基因突变与肿瘤内影像组学异质性的减低相关,这可能有助于解释FAT1 基因突变的头颈部鳞状细胞癌患者总体生存率较FAT1 基因无突变的患者增高的原因。肿瘤的基因表型与患者的治疗和预后密切相关,若能通过影像基因组学进行非侵入性预测肿瘤的基因表型,不仅能让患者避免风险较大的有创活组织检查,还能指导临床制订相应的个体化治疗方案。未来的影像基因组学应充分发挥这方面的优势,继续探索更全面的基因检测方法。
2 头颈部肿瘤影像组学面临的挑战及展望
虽然现有的研究展现了影像组学应用于头颈部肿瘤临床诊疗的价值,但其在许多方面仍待研究改进:(1)在研究对象方面,现有的头颈部影像组学研究仅局限于几种常见的头颈部肿瘤(如头颈部鳞状细胞癌、鼻咽癌),缺乏对其他头颈部肿瘤的探讨,未来的研究应涉及更多的肿瘤类型,以满足复杂的临床诊断需求;(2)在研究内容方面,绝大多数针对头颈部肿瘤风险分层、疗效与副反应评估的影像组学研究尚处于初始阶段,未来的研究应多方面地综合临床指标、病理特征,对研究结果的准确性以及临床实用性进行更深入的探讨;(3)在图像分割方面,手动分割感兴趣区广泛应用,但头颈部解剖结构复杂,肿瘤组织往往与邻近结构分界欠清,导致该方法可重复性及准确性差,应该寻找一种精准的自动分割方法大幅度提高头颈部肿瘤影像组学研究的效能[32]。(4)在研究方法方面,影像组学具有多种特征提取算法和机器学习方法,如何针对不同的头颈部肿瘤选择合适的分析方法是影像组学研究的关键和难点,例如有研究[33]提出线性支持向量机算法、随机森林方法和自适应增强法是鼻咽癌影像组学研究的首选分析方法,但目前对该问题并未形成统一标准。
影像组学的发展有效填补了传统影像学诊断在肿瘤异质性信息方面的空缺,并可无创性监测肿瘤异质性在时间、空间上的变化,这是常规临床及影像检查手段所无法实现的。现有的研究成果已充分展示了影像组学在头颈部肿瘤精准诊疗中的巨大发展潜能,尤其在头颈部肿瘤的风险分层、疗效与副反应预测方面有其独特的优势,有望成为临床精准诊疗的重要参考指标。未来的头颈部肿瘤影像组学研究若能与更多的临床参数、肿瘤生物学标志物及基因表型等相结合,并且寻找有效手段阐释影像组学与头颈部肿瘤的病理、临床之间的因果关系,增加图像所提取影像组学特征的可解释性,将大大提高临床诊断准确率,辅助医生制订更加个性化的治疗方案,从而实现临床精准诊疗,这是头颈部肿瘤影像组学研究的最终目的所在,也是今后需要努力的方向。
