脉冲激光对诱发型2 型糖尿病大鼠神经病理性疼痛的影响研究
2021-05-08胡国花
胡国花,兰 娜
(西安市西电集团医院麻醉科,西安710077)
0 引言
糖尿病的发病率近年来呈现逐年递增的趋势。我国是全球糖尿病第一大国,糖尿病患者占我国总人口的接近10%,而这其中有90%以上被确诊为2型糖尿病(type 2 diabetes,T2D)[1-2]。T2D 可引起机体诸多并发症,包括心血管疾病、肾病、视网膜病变、神经病变及溃疡等,这些并发症也是T2D 具有高致残率和致死率的主要原因。神经病理性疼痛分为周围性疼痛和中枢性疼痛2 类,是T2D 最主要的并发症之一,发病率占T2D 总人数的近50%[3]。糖尿病大多累及周围神经,以肢体远端受累为主的对称性周围神经病理性疼痛为其主要的表现形式[4],临床特点为对于疼痛或非疼痛刺激敏感性增加,体现为自发和触发痛、痛觉过敏、痛觉超敏和异常性疼痛[5-6]。目前临床的主要治疗药物包括镇痛类、抗抑郁和焦虑类、抗炎类及神经营养类,但是由于这些药物的毒副作用和部分有效性限制,亟待开发更多有效、经济且安全的治疗方法[7-8]。激光器的成功研发使激光在生物医学领域的研究在近年来受到了越来越广泛的关注,特别是低强度脉冲激光,凭借其温和、安全、经济等优势,在多种疾病的临床治疗(包括软组织损伤和骨创伤修复、抗炎症及抗自由基损伤等[9-10])中得到了广泛的应用。
近年来,低强度脉冲激光的生物学效应受到了科研人员和临床工作者的广泛关注。诸多研究证实,低强度脉冲激光在皮肤损伤修复、骨折愈合、骨关节炎治疗等方面具有积极的疗效[11-12]。同时学者们通过动物和临床研究均揭示,低强度脉冲激光具有缓解慢性疼痛的功效[9,13]。虽然激光所产生的积极的生物学效应的潜在机制尚未明确,但是学者们推测激光对于机体的影响是其诱发的热效应、机械效应、光化学效应、电磁效应等累积叠加的效果[10]。但是,低强度脉冲激光是否能够显著缓解糖尿病诱发的神经病理性疼痛,国内外鲜有研究报道。而研究激光疗法对于发生率更高的T2D 所诱发的神经病理性疼痛的作用效果,则更具广泛的临床应用价值。本研究通过构建诱发型T2D 大鼠模型,系统地探究低强度脉冲激光对于T2D 所诱发的神经病理性疼痛的作用效果。
1 材料与方法
1.1 实验试剂和仪器
清洁级SD 雄性大鼠,由空军军医大学实验动物中心提供;链脲佐菌素(streptozotocin,STZ),购自美国Sigma 公司;便携式血糖分析仪,购自美国Lifescan公司;低强度激光发生系统,购自瑞典Irradia 公司;Von Frey 纤维丝,购自美国Stoelting 公司;热痛敏刺激和测量系统,购自意大利Commat 公司;cDNA 反转录试剂盒,购自北京天根生物技术公司;Maxima SYBR Green qPCR 试剂盒,购自美国Thermo 公司;总RNA 提取试剂Trizol,购自美国Invitrogen 公司。
1.2 实验设计与分组
实验动物饲养于温度(23±1)℃、相对湿度(55±5)%、昼夜明暗周期12 h/12 h 的实验室环境中。将3月龄的SD 大鼠使用完全随机分组法分为空白对照组(Control 组)、T2D 组和T2D 激光治疗组(T2D+laser组)3 组,每组10 只。Control 组大鼠以普通饲料喂养,T2D 组和T2D+laser 组大鼠以高脂高糖饲料(包含10%猪油、10%蔗糖、2%胆固醇、0.5%胆酸钠、5%蛋黄粉)喂养,大鼠全部自由饮水。高脂高糖饲料喂养4 周后,对T2D 组和T2D+laser 组大鼠行腹腔STZ注射(质量浓度35 mg/kg),Control 组大鼠行等剂量的柠檬酸缓冲液注射。STZ 注射后继续高脂高糖喂养4 周。随后,使用血糖仪通过尾静脉取血测量各组大鼠清晨的随机血糖值,血糖值高于16.7 mmol/L 并表现出多饮、多食、多尿的“三高”症状的大鼠,被认定为符合T2D 标准,纳入本实验研究。最终所有大鼠均纳入研究。T2D+laser 组大鼠施加低强度脉冲激光治疗8 周,每天治疗3 次,每次50 s;Control 组和T2D 组的大鼠予以假暴露干预。
1.3 脉冲激光装置
本研究所用的低强度激光装置为脉冲工作模式,采用单极性电极刺激方式。输出的激光波长为830 nm,激光装置的峰值工作功率为20 W,波形的脉冲宽度为200 ns,频率为700 Hz,平均输出功率为60 mW,功率密度为60 mW/0.38 cm2,激光的暴露时间为50 s,产生的激光能量为3 J。
1.4 机械痛阈值测定
对3 组大鼠分别在实验的第0、2、4、6 和8 周实施足底机械痛阈值的测定。具体方法:测量前将实验大鼠放置于金属网中,上方设有透明树脂玻璃罩,令其充分适应30 min。待大鼠安静后,使用Von Frey 纤维丝刺激大鼠后足中央,刺激过程中或移开纤维丝的瞬间,大鼠出现明显的抬足、躲避、舔脚等反应,将此次测量记为阳性,并记录动作发生时间。每一标号的纤维丝对每侧足底刺激5 次(双侧10 次),如出现5 次以上阳性反应,则记录该纤维丝力度为被采集指标。如果发现实验动物出现5 次不抬腿的情况,则更换更高刻度的纤维丝。
1.5 热痛阈值测定
对3 组大鼠分别在实验的第0、2、4、6 和8 周实施足底热痛阈值的测定。具体方法:测量前,将实验大鼠置于独立的有机玻璃笼中,令其充分适应30 min。使用热辐射测痛仪对大鼠足底中部行热光束照射,大鼠因无法耐受热痛出现抬足反应,此时光束会自动切断并自动记录反应时间。每只大鼠的每侧足底共刺激5 次(双侧共10 次),每次间隔10 min,记录10次测量值并取其平均值。
1.6 脊髓细胞因子检测
8 周后,应用过量戊巴比妥钠溶液对各组大鼠进行腹腔注射处死。通过RNA 提取试剂盒提取腰段脊髓L5 背角总RNA,以2 μg RNA 为上样量,按照试剂盒说明书的步骤在20 μL 反应体系中对RNA进行逆转录反应生成cDNA。使用Bio-Rad CFX96荧光定量PCR 仪对所选目标基因进行聚合酶链式反应(polymerase chain reaction,PCR)扩增,引物序列详见表1。PCR 的反应体系:cDNA 模板1.6 μL,上、下引物(浓度为10 μmol/L)各0.8 μL,SYBR 嵌合荧光试剂10 μL,最后使用去离子水将反应体系补充至20 μL。具体反应条件:95 ℃变性处理3 min,95、60 ℃各30 s,循环40 次后,进行55 ℃退火处理15 s。每种基因设置4 个复孔,使用2-ΔΔCT法对白细胞介素-1β(IL-1β)、肿瘤坏死因子-α(TNF-α)、白细胞介素-6(IL-6)和神经生长因子(NGF)的相对表达量进行半定量分析。
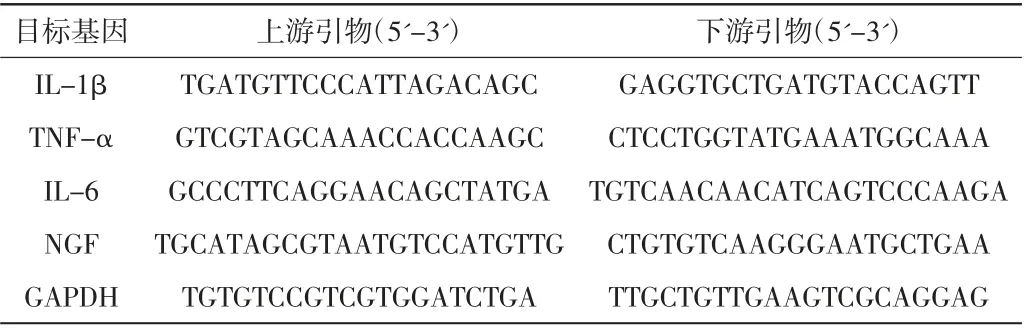
表1 本研究实时PCR 检测中所使用的引物序列
1.7 统计学处理
本实验涉及的全部实验数据均使用均值±标准差(±s)表示,使用SPSS 22.0 软件进行统计学分析。3 组大鼠各实验参数的统计学差异均使用单因素方差分析。如果单因素方差分析发现3 组数据间存在统计差异,使用Benferoni 多重检验法对3 组之间的数据进行两两比较,P<0.05 表示差异具有统计学意义。
2 结果
2.1 低强度脉冲激光治疗未改变T2D 大鼠的血糖值
各组大鼠在实验的第0、2、4、6、8 周的随机血糖值比较结果如图1 所示。T2D 组大鼠的随机血糖值在实验的第0、2、4、6、8 周均显著高于Control 组大鼠(P<0.001),而T2D+laser 组大鼠的随机血糖值也同样在第0、2、4、6、8 周均显著高于Control 组大鼠(P<0.001),但是T2D 组与T2D+laser 组大鼠之间的血糖值在实验的各时间点均无统计学差异(P>0.05)。
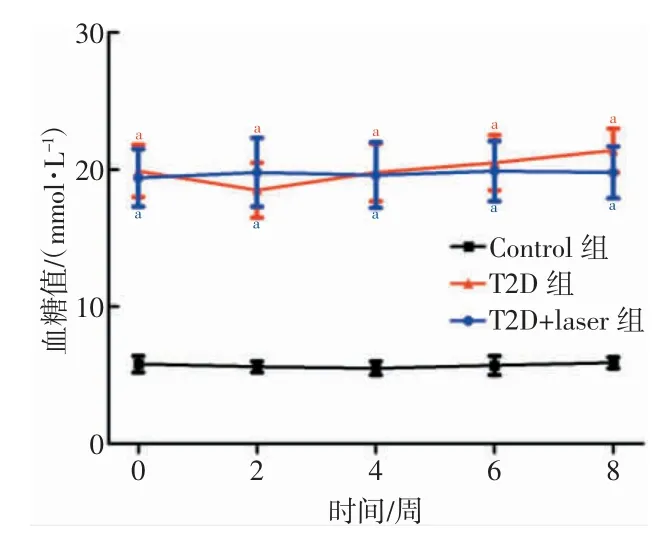
图1 各组大鼠在不同时间的随机血糖值比较结果
2.2 低强度脉冲激光治疗显著提升T2D 大鼠的足底机械痛阈值
各组大鼠在实验的第0、2、4、6、8 周的足底机械痛阈值比较结果如图2 所示。T2D 组大鼠的足底机械痛阈值在实验的第0、2、4、6、8 周均显著低于Control组大鼠(P<0.001),T2D+laser 组大鼠的足底机械痛阈值在第0 周显著低于Control 组大鼠(P<0.001),但与T2D 组大鼠比较无统计学差异(P>0.05)。T2D+laser组大鼠的足底机械痛阈值在第2、4、6、8 周均显著高于T2D 组大鼠(P<0.01),在第2、4、6 周显著低于Control 组大鼠(P<0.05),但在第8 周与Control 组大鼠比较无统计学差异(P>0.05)。
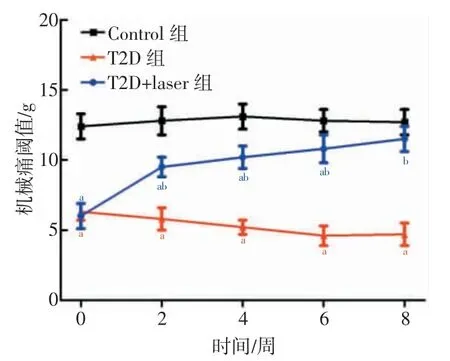
图2 各组大鼠在不同时间的足底机械痛阈值比较结果
2.3 低强度脉冲激光治疗显著提升T2D 大鼠的足底热痛阈值
各组大鼠在实验的第0、2、4、6、8 周的足底热痛阈值比较结果如图3 所示。与Control 组大鼠相比,T2D 组大鼠足底热痛阈值在第0、2、4、6、8 周均显著降低(P<0.001),而T2D+laser 组大鼠足底热痛阈值在第0、2、4、6 周也显著降低(P<0.05),但在第8 周无明显差异(P>0.05)。与T2D 组大鼠相比,T2D+laser 组大鼠足底热痛阈值在第0 周无明显差异(P>0.05),但在第2、4、6、8 周均显著升高(P<0.01)。
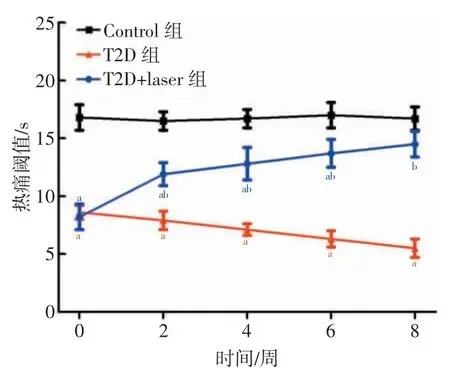
图3 各组大鼠在不同时间的足底热痛阈值比较结果
2.4 低强度脉冲激光降低T2D 大鼠脊髓IL-1β、TNF-α、IL-6 表达水平并提升NGF 表达水平
各组大鼠8 周后的脊髓IL-1β、TNF-α、IL-6 和NGF 表达结果如图4 所示。T2D 组大鼠脊髓IL-1β、TNF-α 和IL-6 的基因表达水平显著高于Control 组大鼠(P<0.001),脊髓NGF 的基因表达水平显著低于Control 组大鼠(P<0.01)。而T2D+laser 组大鼠脊髓IL-1β、TNF-α 和IL-6 的基因表达水平显著低于T2D 组大鼠(P<0.01),其脊髓NGF 的基因表达水平显著高于T2D 组大鼠(P<0.05)。但是T2D+laser 组与Control 组大鼠脊髓IL-1β、TNF-α、IL-6 和NGF基因表达水平无统计学差异(P>0.05)。
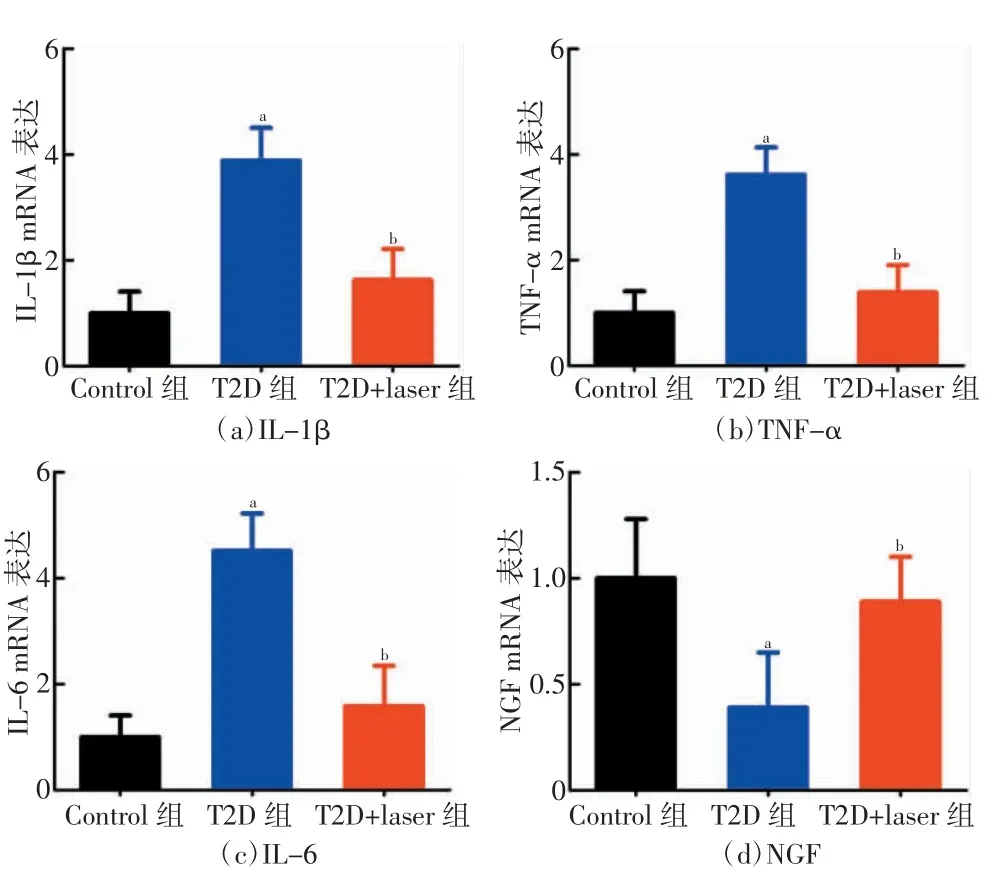
图4 各组大鼠8 周后脊髓重要基因表达结果
3 讨论
T2D 所诱发的神经病理性疼痛一直是糖尿病并发症临床治疗的棘手问题,严重危害了患者的生理和心理健康[13]。对于T2D 的研究,有诸多的动物模型可供选择,这其中包括自发型T2D 模型和诱发型T2D 模型[14]。自发型T2D 模型主要依托基因修饰鼠的途径,而诱发型模型主要通过高脂高糖饮食协同注射STZ 构建。自发型T2D 模型通常需要人为地修改动物体内的特定基因表达,从而达到模拟T2D 临床特征的效果,但其构建成本较高、周期长,且难以避免所改变的基因对于疾病本身的干扰因素。但是无论是自发型T2D 动物还是诱发型T2D 动物,低强度脉冲激光对于其神经病理性疼痛的作用效果国内外尚鲜有研究报道。本研究使用STZ 注射联合高脂高糖膳食方法构建诱发型T2D 模型,系统探究了低强度脉冲激光对于诱发型T2D 所引起的神经病理性疼痛的影响。该模型是目前研究T2D 的经典模型之一,也是较为理想的能够模拟临床T2D 特征的动物模型。
临床上糖尿病神经病理性疼痛最重要的表现是痛觉过敏和超敏,而通过行为学的足底机械痛阈值和热痛阈值检测,能够很好地反映T2D 大鼠对于外界刺激的疼痛忍受能力[15]。本研究发现,小剂量的单次STZ 注射协同高脂高糖饮食所诱发的T2D 在实验的各时间点(第0、2、4、6、8 周)均表现出明显的足底机械痛阈值和热痛阈值的降低,这一结果也表明T2D 模型表现出显著的神经病理性疼痛的特征,提示T2D 神经病理性疼痛模型构建成功。更重要的是,本研究发现低强度的脉冲激光治疗在短时间内(2 周)对T2D 诱发的神经病理性疼痛即可产生积极的治疗效果,且这种积极的治疗效果能够在治疗的全程得以维持,并在第8 周基本达到正常大鼠的水平(T2D+laser 组在第8 周与Control 组无统计学差异)。本文研究结果提示,低强度脉冲激光疗法对于缓解T2D 神经病理性疼痛症状具有积极的效果。
同时,大量研究揭示,糖尿病神经病理性疼痛与机体的炎性反应密切相关,诸多炎性因子介导了糖尿病神经病理性疼痛的发生与发展,而调控炎性因子的表达也被认为是开发抗糖尿病神经病理性疼痛新的作用靶点[16-17]。大量证据表明,促炎性因子包括IL-1β、TNF-α 和IL-6 表达在糖尿病机体的脊髓和背根神经节中被诱发,可以导致神经痛敏反应[18]。在本研究中,同样发现了T2D 大鼠脊髓中的IL-1β、TNF-α 和IL-6 表达水平显著高于正常大鼠,这也与先前关于T2D 的动物和临床研究结果保持一致[19]。研究结果还发现经过8 周的低强度脉冲激光治疗后,T2D 大鼠脊髓中的促炎性因子IL-1β、TNF-α 和IL-6 的表达水平均显著降低,这表明激光疗法对于T2D神经病理性疼痛的改善效应与其抗炎性反应有关。
在T2D 患者机体中,神经再生能力降低,而作为维持神经元存活和生长发育的关键性细胞因子——NGF 的表达水平降低参与T2D 神经病理性疼痛病变的发生与进展[20]。研究发现,T2D 患者血液和脊髓中NGF 的表达水平均显著降低[21],而通过外源性的注射,NGF 能够显著缓解T2D 神经病理性疼痛症状[22]。本研究发现,高脂高糖联合STZ 注射诱发的T2D 大鼠脊髓中的NGF 表达水平显著低于Control 组,这也与先前的临床研究结果保持一致[22]。而8 周的低强度脉冲激光治疗显著提高了T2D 大鼠脊髓NGF的表达水平,这提示激光疗法对于神经再生具有潜在的积极促进作用。
综上所述,本研究证实了8 周的低强度脉冲激光治疗对于STZ 注射联合高脂高糖膳食诱发的T2D大鼠的神经病理性疼痛症状具有明显的改善作用,而该效应与激光对于促炎性因子的抑制和对NGF的促进有关。本研究揭示了低强度脉冲激光疗法凭借其温和、经济、安全等特性有望成为临床治疗T2D神经病理性疼痛的可行方法。虽然本研究明确了低强度脉冲激光对于T2D 神经病理性疼痛的积极治疗效果,但是尚缺乏激光对于T2D 神经病理性疼痛分子信号机制的进一步深入探讨。在后续的研究中,将以促炎性因子相关的调控通路为切入点,结合基因测序、模式动物等手段,进一步明确低强度脉冲激光改善T2D 神经病理性疼痛的分子机制。
