牙龈卟啉单胞菌对大鼠海马组织中β 淀粉样蛋白的影响*
2021-05-08苏心怡唐智群吴红崑
苏心怡 唐智群 吴红崑
阿尔茨海默病(Alzheimer's disease,AD)是一种中枢神经系统进行性退行性病变,为最常见的老年痴呆,临床主要表现为严重的认知能力下降和人格改变[1]。AD 的临床病理特征是β 淀粉样蛋白(Aβ)积聚形成的老年斑、tau 蛋白过度磷酸化形成的神经纤维缠结、神经元丢失及炎症反应[2]。β 淀粉样蛋白(Aβ)是一系列长度为38~43 个氨基酸的短肽,而Aβ42和Aβ40是人体内最常见的具有毒性作用的亚型[3],被认为在AD 的神经元丢失和认知功能障碍中起着关键作用[4]。大脑中的Aβ 由中枢神经系统中高表达的淀粉样前体蛋白(APP)的异常降解生成,即APP 在β-分泌酶1(BACE-1)的作用下首先水解成β-N 端片段和β-C 端片段,再由γ-分泌酶水解生成Aβ 肽段[5]。而早老素是γ 分泌酶的催化活性中心。早老素1(PS-1)和早老素2(PS-2)是早老素的两个亚型,有类似的生物学功能,两者的异常表达能影响γ 分泌酶对APP 的裂解作用,从而影响Aβ 的生成[6]。
牙周炎是一种发生在牙周组织的慢性感染性疾病,P.gingivalis 是其主要致病菌之一。近年来越来越多的研究发现牙周炎和P.gingivalis 是AD 的重要危险因素[7]。牙周炎患者中出现认知功能障碍的比率是非牙周炎患者的2.4 倍[8]。临床附着丧失与脑组织中Aβ 的沉积量存在正相关关系。Ilievski 等发现P.gingivalis 诱导的实验性牙周炎能诱发小鼠海马组织中Aβ42的沉积[9]。Stephen S 等学者在AD 患者的脑脊液中检测出了P.gingivalis 的DNA,且发现P.gingivalis 经口腔感染小鼠后,可进入小鼠海马组织并诱导Aβ42的生成[10]。但是,P.gingivalis对脑组织中Aβ42的影响机制尚未完全明确。本研究通过建立P.gingivalis 静脉感染野生型SD 大鼠模型,研究P.gingivalis 对SD 大鼠海马组织中Aβ42的影响,并进一步分析其可能的作用机制,为通过牙周疾病的防治降低AD 的发病率提供理论依据。
1.材料和方法
1.1 细菌的培养与鉴定 牙龈卟啉单胞菌标准菌株ATCC33277(口腔疾病研究国家重点实验室提供)复苏后接种在含羊血的脑心浸液肉汤(brain heart infusion broth,BHI)琼脂培养基上,37℃厌氧环境中培养5~7 天,革兰氏染色鉴定确认无污染后,于BHI 液体培养基中培养48 h,收集菌体,离心5min(12000 rpm,4℃),收集沉淀于无菌PBS 中重悬2 次,使用麦氏比浊仪将菌液浓度调整至108CFU/ml,4℃储存备用。
1.2 大鼠静脉感染模型的建立 SPF 级SD 大鼠40 只,雄性,3 月龄,体重200±10g,购自四川大学动物实验中心。随机分为4 组,每组10 只,实验组经尾静脉注射P.gingivalis 悬浊液(108CFU/ml,200ul/只,3 次/周),对照组注射等量的PBS 溶液。两组注射4 周,两组注射12 周[11],每组大鼠最后一次注射24 小时后采用安乐法处死。每组6 只行多聚甲醛灌注后,取脑组织,用于免疫组织化学检测,每组4 只取海马组织,液氮保存,用于蛋白表达的检测。所有动物实验均在口腔疾病研究国家重点实验室完成,并获得四川大学华西口腔医院伦理委员会批准(编号为WCHSIRB-D-2017-001)。
1.3 Western Blot 取海马组织,蛋白裂解液提取蛋白,BCA 试剂盒(碧云天,中国)检测蛋白浓度。十二烷基聚丙烯酰胺凝胶电泳(sodium dodecyl sulfate-polyacrylamide gel electrophoresis,SDS-PAGE)后,将蛋白样本转移至硝酸纤维素膜上。质量分数为5%的脱脂牛奶室温封闭1h后,以兔Aβ42多克隆抗体(1∶2000,博奥森,北京),兔Aβ40多克隆抗体(1∶1000,博奥森,北京)、兔APP 多克隆抗体(1∶1000,博奥森,北京)、小鼠BACE-1 单克隆抗体(1∶1000,SANTA CRUZ,美国)、小鼠PS-1 单克隆抗体(1∶1000,SANTA CRUZ,美国)、小鼠PS-2 单克隆抗体(1∶1000,SANTA CRUZ,美国)、小鼠β-actin 单克隆抗体(1∶1000,SANTA CRUZ,美国)4℃下孵育过夜。次日,使用相应来源的辣根过氧化物酶标记的二抗(1∶2000,博奥森,北京)37℃摇床上孵育1h,TBST洗涤3 次,DAB 试剂盒显影,采图后quantity one分析软件分析蛋白灰度值并与内参(β-actin)相比较,得到待测蛋白的相对百分数。
1.4 免疫组织化学检测 脑组织经固定、脱水、石蜡包埋,标本切片,将处理好的切片以1∶200的兔Aβ42多克隆抗体(博奥森,北京)4℃下孵育过夜。次日,使用稀释比例为1∶500 的辣根过氧化物酶标记的山羊抗兔IgG 二抗(博奥森,北京)37℃摇床上孵育30 min,PBS 洗涤3 次,DAB(中杉金桥,北京)显色,复染,中性树胶封片,使用BA200Digital 数码三目摄像显微摄像系统对切片进行图像采集。每只大鼠选取3 张切片,每张切片先于100 倍下观察全部组织,再选取3 个视野分别采集400 倍显微图像。
1.5 数据分析 采用SPSS19.0 软件对分组大于或等于3 的计量资料采用单因素方差分析,分组小于3 的计量资料采用独立样本t 检验。P<0.05为差异有统计学意义。
2.结果
2.1 Aβ42和Aβ40表达水平 Western blot 检测4 周及12 周组SD 大鼠海马组织中Aβ42和Aβ40的表达水平,结果如图1 所示:4 周实验组Aβ42的相对表达量为0.228±0.032,4 周对照组Aβ42的相对表达量为0.122±0.012,实验组明显高于对照组,两组差异有统计学意义(P<0.01);12 周实验组Aβ42的相对表达量为0.296±0.03,12 周对照组Aβ42的相对表达量为0.098±0.019,实验组明显高于对照组,差异有统计学意义(P<0.001);且12 周实验组Aβ42的相对表达量明显高于4 周实验组,两组差异有统计学意义(P<0.05)。4 周实验组Aβ40的相对表达量为1.386±0.390,4 周对照组Aβ40的相对表达量为0.975±0.234,实验组高于对照组,但差异无统计学意义(P>0.05);12 周实验组Aβ40的相对表达量为1.263±0.263,12 周对照组Aβ40的相对表达量为1.200±0,130,实验组高于对照组,但差异无统计学意义(P>0.05)。弱阳性的表达。

图1 Aβ42 和Aβ40 的表达水平(-代表对照组,+代表实验组,*P<0.05,**P<0.01,***P<0.001)

图2 Aβ42 免疫组织化学染色检测Aβ42 的沉积位点×400
2.3 Aβ42相关蛋白BACE-1、APP、PS-1、PS-2 的表达水平 选取Aβ42表达水平差异更明显的12 周组大鼠的海马组织,采用Western blot 检测BACE-1、APP、PS-1、PS-2 的表达水平,结果如图3 显示:实验组APP 的相对表达量为0.840±0.171,对照组为0.491±0.073,实验组明显高于对照组,且差异有统计学意义(P<0.01)。实验组中PS-1 的相对表达量为1.672±0.208,2.2Aβ42的免疫组织化学染色 上述实验中,我们发现P.gingivalis 静脉感染后,SD 大鼠海马组织中Aβ40的表达并无明显变化,而Aβ42表达上调,因此,我们只针对Aβ42做了免疫组织化学的检测。结果如图2 所示:4 周及12 周实验组Aβ42的表达集中于神经元细胞质和细胞间质,呈棕黄色,量大且密集,而4 周及12 周对照组神经元细胞质中Aβ42表达接近阴性,细胞间质中有少量、散在、其在对照组的相对表达量为1.083±0.118,实验组明显高于对照组,差异有统计学意义(P<0.01)。PS-2 在实验组的相对表达量为0.573±0.132,对照组为0.491±0.073,实验组明显高于对照组,差异有统计学意义(P<0.01)。而实验组BACE-1的相对表达量为0.546±0.075,对照组BACE-1的相对表达量为0.391±0.108,实验组高于对照组,但差异无统计学意义(P>0.05)。
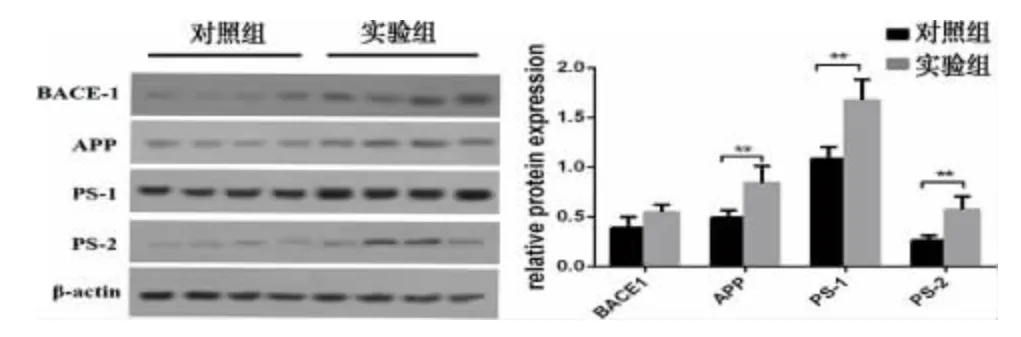
图3 Western Blot 检测Aβ42 相关蛋白BACE-1、APP、PS-1、PS-2 的表达水平(**P<0.01)
3.讨论
以牙周感染为典型代表的口腔感染是菌血症的常见诱因[12],而P.gingivalis 是牙周炎的主要致病菌,在牙周袋中的浓度可以达到108CFU/mL[13]。P.gingivalis 有大量的毒力因子,除能引发牙周组织的炎症外,还能通过糜烂的牙周组织进入循环系统,定植在远端器官[14],影响多种系统性疾病的发展,如动脉粥样硬化[15]、冠心病[16]、类风湿性关节炎[17]等。有研究表明对ApoE 基因敲除小鼠行频率为3 次/周的P.gingivalis 培养液尾静脉注射4 周可加速其氧化应激和炎症反应介导的动脉粥样硬化[11]。课题组前期研究也发现P.gingivalis 经尾静脉感染SD 大鼠4 周和12 周可提高其血清及海马组织中炎性因子IL-1β(白细胞介素1β)、IL-6(白细胞介素6)、TNF-α(肿瘤坏死因子α)水平[18]并促进海马组织中神经元的凋亡[19],我们推测P.gingivalis进入循环系统引起循环系统炎症及神经炎症可能是引发海马组织中AD 样病变的一个重要途径[20]。因此,本研究采用经尾静脉注射P.gingivalis 的方式建立P.gingivalis 外周感染模型,探讨P.gingivalis对Aβ42和Aβ40的影响。
本研究发现SD 大鼠经静脉感染P.gingivalis 后,海马组织中可溶性的Aβ40没有明显变化,但可溶性Aβ42的表达明显增加,并且随着感染时间的延长,这种上调作用更加明显。过表达的Aβ42主要沉积于海马组织神经元细胞的细胞质和细胞间质中。这与Ilievski 等发现P.gingivalis 诱导的实验性牙周炎可以诱发小鼠海马组织中Aβ42的沉积[9],以及Stephen S等发现P.gingivalis 感染小鼠口腔可诱导Aβ42的生成一致[10]。Aβ42是AD 样病变中主要的、标志性的淀粉样沉积物[20],脑内沉积的Aβ42可以激活caspase信号通路,诱导小鼠神经元凋亡[19,21]。
为了进一步探讨P.gingivalis 影响Aβ42表达水平的机制,课题组进一步分析了SD 大鼠海马组织中Aβ42相关蛋白BACE-1、APP、PS-1、PS-2的表达。APP 是Aβ 的前体蛋白,APP 过表达的转基因小鼠,6~9 月龄时即可见脑组织中Aβ 斑块的沉积[22],而γ 分泌酶是Aβ 生成终末环节的关键酶,其活性的高低与是否能生成Aβ 密切相关。PS-1、PS-2 蛋白是γ 分泌酶重要组成部分,两者的基因突变可导致改变γ 分泌酶活性,引起Aβ42的选择性过表达[23,24]。本研究发现SD 大鼠经静脉感染P.gingivalis 后,海马组织中APP、PS-1、PS-2 的表达都出现了上调。这与以往研究中包柔螺旋体能通过上调APP 促进神经元分泌Aβ42[25],以及幽门螺杆菌通过上调PS-2 促进SD 大鼠海马组织中Aβ42的表达[26]相符。同时与Ilievski 等发现慢性牙周炎能上调小鼠海马组织中APP 基因表达的结果一致[9]。我们推测P.gingivalis 可能是通过上调APP 的表达,增加了Aβ42的来源,同时又上调PS-1、PS-2 的表达,增加γ 分泌酶的活性,从而使Aβ42的表达增多。
4.结论
综上所述,本研究发现P.gingivalis 经静脉感染SD 大鼠后,能促进大鼠海马组织中神经元细胞质及细胞间质中Aβ42的表达,其机制可能为P.gingivalis上调了Aβ42前体蛋白APP 及γ 分泌酶活性组成成分PS-1、PS-2 的表达。但APP、PS-1、PS-2介导P.gingivalis 促进SD 大鼠海马组织中Aβ42过表达的具体机制有待进一步研究。
