环境空气中烷烃的光催化氧化实验改进研究*
2021-05-07陈薇薇康春莉
陈薇薇,杨 平,田 涛,康春莉
(吉林大学新能源与环境学院,地下水资源与环境教育部重点实验室,吉林长春 130021)
0 引 言
随着我国社会经济的高速发展,城市化进程的不断推进以及能源的大量消耗[1-2],大气污染所造成的环境问题日益突出.近年来,挥发性有机污染物(volatile organic compounds,VOCs)是造成我国多地出现大范围持续性雾霾天气的“元凶”[3-5].烷烃污染物是VOCs中一类重要的有机污染物,其主要产生于矿物的燃烧,尤其是机动车尾气的排放等人为源[6-7],以及高等植物的排放等天然源[8].如果不能有效地控制和处理VOCs,将会引起日趋严峻的大气污染问题,严重地威胁环境和人类健康.
烷烃性质稳定,在空气中一般不易降解,被认为是VOCs中最难催化的物质之一[9-11],因此,发展高效的VOCs治理技术势在必行.目前,处理VOCs的常规方法主要包括吸附、燃烧、生物降解和催化氧化等,但以上方法均因存在不同的问题,如易造成二次污染、运行条件要求高和处理成本高等,而难以在处理 VOCs上得以广泛应用[5,12].相对于传统处理方法,光催化氧化法具有降解效果好、无二次污染和操作简单等优点,而且可以有效利用烷烃在一些半导体粒子存在条件下,可发生光降解的特性,因此在降解VOCs尤其是烷烃方面越来越受到重视[12-13].常见的半导体催化剂主要是过渡金属氧化物和硫化物等,其中二氧化钛(TiO2)以其催化性能良好、化学性能稳定、安全无毒和价格低廉,并且能在室温下进行光催化反应等优点而应用广泛[12-15].TiO2是一种宽禁带的半导体材料,当受到大于禁带宽度能量的光照射后,处于低能价带上的电子就被激发到高能导带,此时在导带上产生带负电的高活性光生电子,在价带上生成带正电的空穴,从而形成氧化还原体系.光生电子具有强还原性,而空穴具有强得电子能力,可夺取半导体颗粒表面的有机物或体系中的电子,使原本不吸收光的物质被氧化.由于能量传递,将生成活性很强的自由基和超氧离子等活性氧,诱发光化学反应,产生光催化作用[16-17].
光催化反应研究是环境化学实验的重要内容,对学生巩固气相光化学反应的基础理论知识与实验基本操作技能具有重要的理论和实际意义.在吉林大学环境科学专业目前开设的“环境空气中烷烃的光催化氧化”实验课程中,尚存在实验装置陈旧、操作复杂、能耗较高、实验耗时长和实验效率较低等问题,使得该实验存在不利于激发学生的学习兴趣及科研创新能力培养的问题,这不符合本科实验教学深化改革的要求.因此,在原有理论基础、技术方法和教学经验的基础上[10-18],以TiO2为光催化氧化剂,在紫外线照射下进行正庚烷(n-C7H16)光催化氧化降解实验,并对实验装置和部分实验条件进行改进和优化.以期通过该项改进性实验研究,为学生系统地掌握光催化氧化反应机理和实验操作提供帮助.
1 实验部分
1.1 实验材料
n-C7H16(纯度>99.0%)购自北京迈瑞达科技有限公司;TiO2(锐钛矿,纯度>99.0%)购自上海阿拉丁生化科技股份有限公司;高纯氮气(N2)和氧气(O2)购自长春巨洋气体有限公司.
1.2 实验仪器
使用瑞士Hamilton公司生产的1 μL微量注射器进样;使用常州双环热工仪表有限公司生产的LZB-3WB气体流量控制气体流速;使用天津市津腾实验设备有限公司生产的GM-0.33A无油真空泵抽真空;使用天津市盛克威科技有限公司生产的JTM-3000真空压力计控制真空度;使用上海司乐仪器有限公司生产的B11-3型磁力搅拌器进行样品搅拌.
使用日本岛津公司生产的GC-2010Plus气相色谱仪进行改进后实验样品分析,配置氢火焰离子化检测器(FID),DB-1型毛细管柱(30 m×250 μm×250 nm),载气为N2,流速为2 mL/min;柱升温程序:初始温度40℃,保持2 min,再以15℃/min升温至120℃,保持2 min;检测器温度300℃,载气为 N2,流速为 2 mL/min,分流比 10∶1,进样量为 1 μL.
使用美国安捷伦科技有限公司生产的HP4890D气相色谱仪进行改进前实验样品分析[18],配置FID检测,SE-54石英毛细管柱(50 m×200 μm×250 nm),载气为N2,柱前压0.24 MPa,柱温60℃,分流速度68 mL/min,吹扫速度33 mL/min,气化室温度200℃,检测室温度220℃.
1.3 实验装置改进
改进前的光化学反应装置主要由石英玻璃反应器、紫外高压汞灯和隔热石英管组成,其详细结构如图 1(a)所示[19].其中石英玻璃反应器外径为50 mm,长为200 mm,侧面有2个开口,分别用于配气和取样;光源是主波长为365 nm的400 W“一字形”紫外高压汞灯,由1个两侧开有窗口的金属筒罩住,与反应器相距110 mm,中间用柱形石英管隔开.由于该光催化反应装置组成部件较多,需固定在自制铁架(长、宽和高分别为105、55和100 cm)上使用,且实验过程中需使用双层遮光布进行遮挡.
本文在遵循光化学反应原理的基础上,同时考虑了反应体系混合和传质过程、反应动力学和光能利用情况等因素[20],重新设计了内照式光催化反应装置,其主体部分主要包括光源、玻璃反应器和石英冷阱,详细结构如图1(b)所示.其中光源是主波长为365 nm的“U形”紫外高压汞灯,反应器底部加装了磁力搅拌器,整个实验过程在金属箱内完成(长、宽和高分别为36、35和55 cm).

图1 光催化反应装置示意
1.4 实验条件摸索
本文对改进后的实验条件进行了摸索,主要包括优化TiO2用量和确定光催化时间.所有实验均重复2次,结果取平均值.
1.4.1 TiO2用量优化
(1)称量.分别称取 0.10、0.25、0.50、1.00和2.00 g的TiO2催化剂平铺于反应器底部,连接反应器与配气系统,进气口用垫有聚四氟乙烯薄膜的翻口胶塞密封.(2)配气.反应器抽真空后,用N2冲洗再次抽真空,重复4~5次.将n-C7H16和O2在真空状态下注入反应器,控制n-C7H16的物质的量浓度为1.66×10-4mol/L,O2的体积分数为 20%.最后用 N2调节反应器的压力略高于常压,完成配气.(3)振荡.将反应器从配气系统取下,仔细振荡,使TiO2平铺于器壁底部,开启磁力搅拌器,30 r/min持续搅拌,保证TiO2均匀分布.(4)计算.开启高压汞灯,接通冷凝水用来维持反应温度,在反应60 min后取样分析体系中n-C7H16的含量,比较TiO2不同用量时,体系中n-C7H16的降解率(C),计算公式为
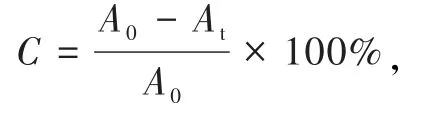
式中A0为n-C7H16初始特征峰面积,At为不同时间的峰面积.
1.4.2 光催化时间确定
分别测量实验改进前和改进后体系中n-C7H16的降解率,绘制降解率随时间变化的曲线.
(1)改进前[18].称取 1.00 g TiO2平铺于反应器底部,抽真空后,开启高压汞灯,分别在光照5、15、30、60、90和120 min时,用微量注射器从翻口胶塞处取样,分析n-C7H16的含量.
(2)改进后.实验操作步骤同1.4.1,其中TiO2用量为 0.50 g,分别在反应进行到 5、10、15、20、25和30 min时,在出气口取样分析.
2 实验改进效果
2.1 催化剂用量
当 TiO2的用量分别为 0.10、0.25、0.50、1.00 和2.00 g时,经计算n-C7H16的光催化降解率分别为31.37%、59.22%、96.19%、64.21% 和 45.21%.可知,当催化剂用量为0.50 g时,n-C7H16的光催化降解率最大.
2.2 催化时间
实验改进前后,n-C7H16的降解率随时间变化曲线如图2所示.由曲线变化趋势可知,改进前和改进后,n-C7H16的降解率均呈快速增加、缓慢增加至达到降解平衡的趋势.在反应趋于平衡时,改进前和改进后所用时间分别为120和30 min,对应的降解率分别为93.32%和96.66%,而当反应进行30 min时,改进前n-C7H16的降解率仅为63.65%.
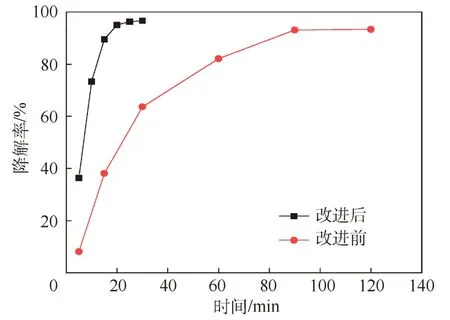
图2 实验改进前后n-C7H16的光催化降解效果
TiO2光催化反应为非均相反应过程,其反应动力学多符合一级反应动力学.采用Langmuir-Hinshelwood反应动力学模型来描述[20-21],改进前和改进后的拟合结果分别为y=0.023 8x+0.257 4,R=0.962 0和 y=0.122 3x+0.147 5,R=0.957 9.可知,改进后,n-C7H16的反应速率(0.122 3)明显高于改进前(0.023 8).
3 讨 论
3.1 改进效果
本研究首先对光催化氧化实验的反应装置进行了改进,其次对部分反应条件进行优化.与改进前相比,改进后由于实验装置中的玻璃反应器与石英冷阱连接处均为磨口,保证反应装置具备良好的气密性;“U形”紫外高压汞灯的设计使光源更加集中;装置底部加装的磁力搅拌器,避免了催化剂分布不均的问题;整个实验在金属箱中进行,有效加强了对紫外线辐射的防护作用.因此,改进后装置具有可操作性强、稳定性高及安全等优点.
由TiO2用量优化的实验结果可知,随着催化剂用量的增加,n-C7H16的降解率呈先增加后降低的趋势,且在TiO2用量为0.50 g时,达到最大降解率.产生这样的变化趋势的原因可能是,当催化剂用量偏低时,分散的TiO2粒子较少,产生的活性羟基自由基(HO·)也相对较少,光源产生的光子能量没有得到充分利用,所以n-C7H16的降解率较低;随着催化剂用量的增加,体系中分散的TiO2粒子增多,具有的催化表面积增大,因此,降解率有所提高;当催化剂用量增大到一定程度后,过量的TiO2粒子容易使颗粒团聚以致光分散,从而阻挡了TiO2表面接收到的紫外线,降低了光催化效果.该结果与吴晓飞等[21]和耿凤华等[22]分别在研究TiO2对游离氰和磺胺吡啶的紫外线光催化降解所得到的结果类似.由此可见,在改进后实验中合理的催化剂用量为0.50 g.
实验改进前和改进后,n-C7H16随时间变化的降解规律相似,但二者达到降解平衡的时间和降解率不同.与改进前相比,当反应进行到30 min时,改进后n-C7H16的降解率增加了29.90%;当均达到降解平衡时,改进后n-C7H16的降解率提高了3.34%.即与改进前相比,改进后达到n-C7H16降解平衡所需的时间更短,且降解率更高.而较短的反应时间和较低的实验成本都更有利于开展教学实验.
3.2 教学效果
在进行环境空气中烷烃的光催化氧化的实验教学时,授课教师需进行全程现场指导,尤其是光化学反应装置的组装和取样分析环节,让学生在更加全面地了解改进实验装置的设计原则和工作原理的同时,正确掌握实验的操作步骤和操作技能.
实验过程中,在组装反应装置时,教师需提醒学生充分考虑实验条件,如装置检漏、光源位置等;在催化剂添加的过程中,强调少量多次原则,避免单次加入过多、过厚;配气过程中,确认反应器的气密性并认真观察反应器内的真空度变化;组装最后,调整高压汞灯至石英冷阱下端,且不能碰触冷阱内壁;在取样时,会存在胶塞由于多次针扎后出现漏气现象,需在取样后立即用胶带封闭胶塞外侧,取样拉速要慢(避免产生气泡)而进样推速要快,避免碰触进样器的针头和有样品部分;整个实验过程中,做好紫外线辐射防护.
实验装置改进前,在实际操作中易出现装置气密性不严、催化剂投加不均匀和紫外线辐射防护不到位等问题,降低了实验的成功率和安全性.实验装置改进后,由于气密性、催化剂的分布情况和辐射防护等问题的有效解决,使实验的操作难度、失败率和危险性大大降低.经过教学实践,不论是授课教师还是学生都对改进后的实验反映良好,教师反馈学生的操作水平和实验能力普遍提高,学生反馈改进后的实验更加易懂且易操作.
4 结束语
本文以环境空气中烷烃的光催化氧化实验为研究内容,通过对光催化反应装置和实验条件进行改进,进行了TiO2对n-C7H16的光催化氧化反应实验,确定了催化剂用量和反应时间,评估了改进后的实验效果,并采用动力学模型拟合进行了验证.使该实验可在较短的反应时间和较低的实验成本下开展,实验设计更加符合本科实验教学的要求和特点,有助于学生更深入直观地了解光催化技术的原理和基本方法,提升了学生的实验技能和专业素质.
