沼泽红假单胞菌LuxR家族调控蛋白的生物信息学分析
2021-05-06杨艳北许晶李袁飞
杨艳北 许晶 李袁飞


摘要:LuxR家族调控蛋白调控革兰氏阴性细菌群体感应系统,从而影响细菌生物被膜的形成。利用在线生物信息学预测软件,分析LuxR家族调控蛋白序列,对其理化性质、亲水性/疏水性、亚细胞定位、信号肽、二级结构、三级结构、磷酸化位点、跨膜结构域和功能结构域进行分析和预测,为后续研究生物被膜形成机制奠定基础,也为生物被膜增强剂的开发提供新的思路。结果表明:LuxR家族调控蛋白为不稳定的亲水性蛋白;定位在细菌的细胞质中;无信号肽结构,推断其为非分泌性蛋白;二级结构中含有α-螺旋、β-转角、延伸链和无规则卷曲等结构元件;α-螺旋和无规则卷曲对三级结构的稳定和功能发挥具有重要意义;含有5个磷酸化位点,其中丝氨酸磷酸化位点包括第79位、第165位和第171位氨基酸,其中苏氨酸磷酸化位点包括第90位和第211位氨基酸;无跨膜结构域,推测LuxR家族调控蛋白不属于跨膜蛋白;LuxR家族调控蛋白参与细菌群体感应系统,含有2个保守结构域,分别为Autoind_bind和 HTH_LUXR,该蛋白通过这2个保守结构域起到转录调控的作用。
关键词:沼泽红假单胞菌;LuxR;生物信息学;生物被膜
沼泽红假单胞菌是光合细菌的代表菌株之一,属于益生菌的一种,广泛作为动物饲料添加剂和水质净化剂使用。沼泽红假单胞菌自身能够产生生物被膜[1],利用生物被膜这一天然保护状态能够提高细菌的存活率,增加活菌数量,稳定产品质量。生物被膜是指细菌黏附于接触物表面而形成的极其复杂的三维立体结构,这种复杂的细菌聚集体结构,抗逆性强,是大多数细菌在自然状态下的生长方式。生物被膜使细菌能够在恶劣的自然环境下生存和繁殖。与浮游状态下的细菌相比,生物被膜状态下的细菌具有更强的生存能力,例如抗冷冻能力、抗干燥能力、耐热性和耐酸性等[2-3]。LuxR家族调控蛋白是一类在革兰氏阴性细菌群体感應中起重要作用的调控蛋白,它们参与由酰基高丝氨酸内酯介导的多种生物学过程,包括调控细菌生物被膜形成、质粒转移、生物发光以及多种胞外酶、毒力因子和次生代谢产物的合成。LuxR家族调控蛋白通过群体感应系统影响生物被膜的形成[4]。本研究采用生物信息学的分析方法,对LuxR家族调控蛋白的理化性质、亲水性/疏水性、亚细胞定位、信号肽、二级结构、三级结构、磷酸化位点、跨膜结构域和功能结构域进行分析和预测,为后续研究沼泽红假单胞菌生物被膜形成机制奠定基础,也为生物被膜增强剂的开发提供新的思路。
1 材料与方法
1.1 数据来源
试验中沼泽红假单胞菌的LuxR家族调控蛋白序列来自于美国国家生物信息中心(NCBI)已登录的序列,蛋白质序列编码为WP_011155889.1(LuxR family transcriptional regulator[Rhodopseudomonas palustris])。
1.2 研究方法
在线生物信息学预测软件分析LuxR家族调控蛋白序列(试验时间:2020年5月,试验地点:江西省南昌市):利用ProtParam(https://web.expasy.org/protparam/)分析理化性质;利用ProtScale (https://web.expasy.org/protscale/)进行亲水性、疏水性的分析和预测;利用PSORTb version 3.0.2 (https://www.psort.org/psortb/)和LocTree3 (https://www.rostlab.org/services/loctree3/)进行细菌亚细胞定位分析和预测;利用SignalP 4.1 Server (http://www.cbs.dtu.dk/services/SignalP-4.1/)进行信号肽分析和预测;利用SOPMA (https://npsa-prabi.ibcp.fr/cgi-bin/npsa_automat.pl? page=/NPSA/npsa_sopma.html)进行蛋白质二级结构分析和预测;利用SWISS-MODEL (https://swissmodel.expasy.org/)进行蛋白质三级结构分析和预测;利用NetPhosBac 1.0 server(https://services.healthtech.dtu.dk/service.php?NetPhosBac-1.0)进行细菌蛋白质的磷酸化位点分析和预测;利用TMHMM 2.0 server(https://services.healthtech.dtu.dk/service.php?TMHMM-2.0)进行跨膜结构域的分析和预测;利用NCBI的保守域数据库(https://www.ncbi.nlm.nih.gov/Structure/cdd/wrpsb.cgi)进行功能结构域分析和预测。
2 结果与分析
2.1 LuxR理化性质分析
利用ProtParam分析LuxR的理化性质。LuxR的氨基酸数量为243个,其中含量较多的氨基酸为丙氨酸(34个,14.0%)、亮氨酸(25个、10.3%),精氨酸(23个、9.5%)。LuxR的分子量为 26 937.94 u,理论等电点为7.73。LuxR含有4个半胱氨酸,说明LuxR可能具有二硫键。LuxR不含有吡咯赖氨酸和硒半胱氨酸等稀有氨基酸。LuxR的氨基酸组成分别为丙氨酸(34个,14.0%)、精氨酸(23个,9.5%)、天冬酰胺(5个,2.1%)、天冬氨酸(14个,5.8%)、半胱氨酸(4个,1.6%)、谷氨酰胺(4个,1.6%)、谷氨酸(14个,5.8%)、甘氨酸(14个,5.8%)、组氨酸(6个,25%)、异亮氨酸(14个,5.8%)、亮氨酸(25个,10.3%)、赖氨酸(6个,25%)、甲硫氨酸(5个,2.1%)、苯丙氨酸(8个,33%)、脯氨酸(15个,6.2%)、丝氨酸(15个,6.2%)、苏氨酸(11个,4.5%)、色氨酸(6个,25%)、酪氨酸(6个,2.5%)、缬氨酸(14个,58%)。LuxR带负电荷氨基酸残基数(天冬氨酸+谷氨酸)为28个,带正电荷氨基酸残基数(精氨酸+赖氨酸)为29个,其分子式为C1 203H1 897N345O341S9,原子总数为3 795。假设LuxR的胱氨酸残基以半胱氨酸的形式出现,即形成二硫键,LuxR的消光系数为 42 190 L/(mol·cm),吸光度(D280 nm)为1.566;假设二硫键全部打开,LuxR的消光系数为 41 940 L/(mol·cm),吸光度(D280 nm)为1.557。当LuxR的N端为甲硫氨酸时,在体外培养的网织红细胞内的半衰期为30 h,在酵母菌细胞内的半衰期大于20 h,在大肠杆菌细胞内的半衰期大于10 h。LuxR的不稳定系数为42.59,因此推测LuxR为不稳定蛋白(蛋白质的稳定系数大于阈值40时,其在溶液中性质不稳定)。LuxR脂肪指数为93.29,亲水性平均值为-0.075。LuxR亲水性平均值为负值,表明此蛋白为亲水性蛋白。
2.2 LuxR亲水性/疏水性分析
利用ProtScale分析LuxR的亲水性/疏水性。如图1所示,LuxR多肽链中,第103位天冬氨酸和第176位异亮氨酸有最低分值-2.678,亲水性最强;第204位异亮氨酸和第205位亮氨酸有最高分值2.111,疏水性最强;亲水性氨基酸数量较多,且亲水性平均值为-0.075,因此LuxR表现为亲水性。
2.3 LuxR亚细胞定位分析
利用PSORTb version 3.0.2分析LuxR的亚细胞定位。PSORTb v3.0.2是目前最精确的细菌定位预测工具之一。LuxR的亚细胞定位分数分别为:细胞质9.97,细胞质膜0.01,周质0.01,外膜0.00,细胞外0.00。定位分数显示LuxR定位在细菌的细胞质中。利用LocTree3分析LuxR的亚细胞定位。由图2可见,LuxR定位在细胞质中,亚细胞定位分数95,精确度98%。基于上述2种在线软件的亚细胞定位预测结果表明,LuxR定位在细胞质中。
2.4 LuxR信号肽分析
利用SignalP 4.1 Server分析LuxR的信号肽。由图3可见,原始剪切位点C最大值在第55个氨基酸,分数为 0.154;综合剪切位点Y最大值在第55个氨基酸,分数为0.154;信号肽S最大值在第42个氨基酸,分数为0.257;平均信号肽S值在第1~54个氨基酸之间,平均值是0.107;D值在第1~54个氨基酸之间,平均值是0.132;临界值是0.570。D值是信号肽S最大值和综合剪切位点Y最大值的平均值,对区分是否为分泌蛋白具有至关重要的作用。D值小于临界值,LuxR未发现信号肽序列,因此推断LuxR为非分泌性蛋白。
2.5 LuxR二级结构分析
利用SOPMA分析LuxR的二级结构。由图4可见,LuxR可能包含的二级结构分别为:α-螺旋(蓝色)115个,占47.33%;β-转角(绿色)14个,占5.76%;延伸链(红色)30个,占12.35%;无规则卷曲(紫色)84个,占34.57%。α-螺旋及无规则卷曲是LuxR二级结构中最大量的结构元件。
2.6 LuxR三级结构分析
利用SWISS-MODEL分析LuxR三级结构,得到6个预测模型,其中以PDB ID:2q0o.1.A为模板
的预测模型质量最高,作为本研究中的LuxR预测模型。由图5可见,LuxR预测模型与模板序列相似度为24.11%。在本研究中,LuxR预测模型的全局模型质量评估分数(GMQE)为0.64,明显高于其他预测模型,更接近1。GMQE是一种质量评估方法,生成的GMQE在0到1之间,数字越高,越接近1表明可靠性越高。在本研究中,LuxR预测模型的QMEAN分数为-2.45,比其他预测模型更接近0。QMEAN分数在0左右,表明模型结构与试验结构具有良好的一致性。QMEAN分数在-4.0以下表示模型质量较低。通过SWISS-MODEL预测得出LuxR的三级结构(图6),可见其α-螺旋和无规则卷曲结构丰富,数量较多。推测α-螺旋和无规则卷曲对LuxR三级结构的稳定和功能发挥具有重要意义。
2.7 LuxR磷酸化位点分析
利用NetPhosBac 1.0 server分析LuxR的磷酸化位点。由图7可见,磷酸化位点有5个,其中丝氨酸磷酸化位点包括:第79位氨基酸(残基得分:0721),第165位氨基酸(残基得分:0.635),第171位氨基酸(残基得分:0.573);苏氨酸磷酸化位点包括:第90位氨基酸(残基得分:0.545),第211位氨基酸(残基得分:0.516)。残基得分介于0和1之间,当得分高于0.5时,残基被预测为磷酸化位点。
2.8 LuxR跨膜结构域分析
利用TMHMM 2.0 server分析LuxR的跨膜结构域。如图8所示,预测LuxR位于膜外(粉色细线)的概率接近100%,位于膜内(蓝色细线)和跨膜区域(红色细线)的概率几乎为0。粉色粗线代表多肽链中跨膜区域所在位置。因LuxR无跨膜结构域,所以图中不显示相应的标记,推测LuxR不属于跨膜蛋白。
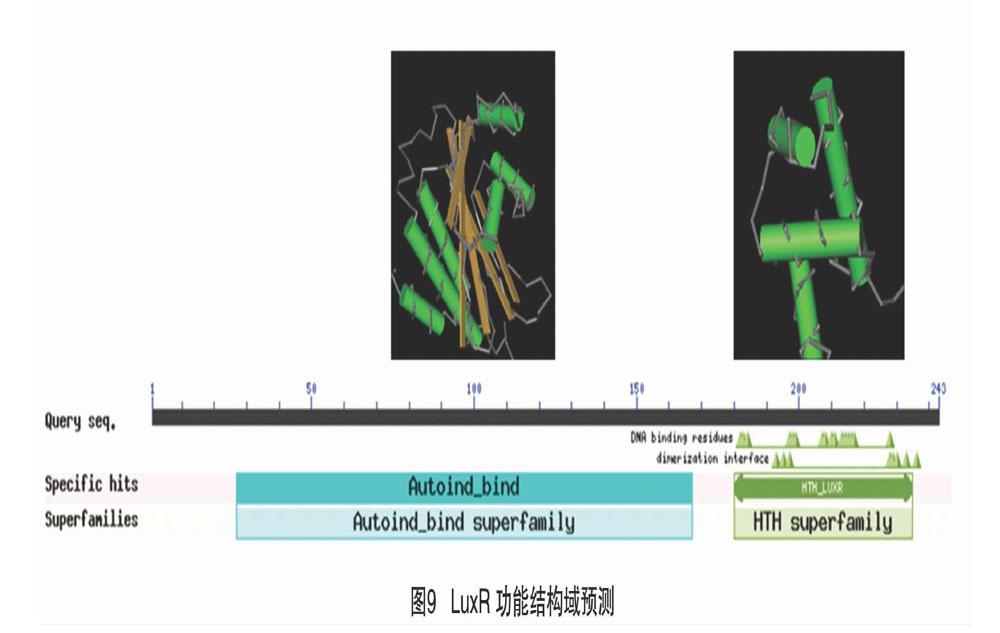
2.9 LuxR功能结构域分析
利用NCBI的保守域数据库进行功能结构域分析,结果显示,LuxR参与细菌的群体感应系统。由图9可见,LuxR在第27~167位氨基酸处含有保守结构域Autoind_bind,该结构域与自诱导物分子能够特异性结合,属于转录调控因子超家族;LuxR在180~235位氨基酸处含有保守结构域HTH_LUXR,该结构域与DNA特异性结合,起到转录调控因子的作用,属于α-螺旋蛋白结构域超家族。因此,LuxR通过Autoind_bind和HTH_LUXR 2个保守结构域起到转录调控的作用。
3 讨论与结论
沼泽红假单胞菌属于益生菌的一种,在畜禽和水产养殖、农作物种植及污水处理方面表现出极高的应用价值[5]。益生菌的发展经过4个阶段:第1代益生菌为不经包被处理的菌株,以浮游状态或冷冻干燥状态存在;第2代益生菌为药用胶囊包被的冷冻干燥菌体;第3代益生菌为荚膜包被或微胶囊制备的菌剂;近几年,第4代益生菌的研发正在蓬勃兴起,其主要创新点就在于生物被膜状态下的益生菌制备和微胶囊技术的换代升级[3,5]。在此研究的大背景下,本研究采用生物信息学的分析方法,对沼泽红假单胞菌生物被膜形成过程中的关键调控蛋白LuxR的理化性质和结构特征进行预测,为后续研究沼泽红假单胞菌生物被膜形成机制奠定坚实的基础。
功能结构域分析结果显示,LuxR家族调控蛋白参与细菌群体感应系统。细菌群体感应现象是指细菌数量达到一定阈值,同时信号分子的浓度也达到一定的水平,细菌之间通过信号分子进行交流,从而调控自身生理特征,并改变自身生理状态的一种现象。细菌之间存在大量的信息交流和沟通,细菌不是完全独立的个体[6-7]。LuxR系统作为革兰氏阴性细菌中普遍存在的一种群体感应系统,在细菌的生存和繁衍过程中发挥着极其重要的调控作用,例如:LuxR家族调控蛋白通过群体感应系统影响生物被膜的形成,增强其对抗外界恶劣自然环境的能力[8-9]。LuxR家族调控蛋白能够与酰基高丝氨酸内酯结合,形成活性分子进而启动下游相关基因的转录和翻译[7,10-11]。LuxR型蛋白的N端为信号分子酰基高丝氨酸内酯的结合区域,C端含有保守的螺旋-转角-螺旋结构,能够与目的基因特异性结合[4,12],本研究中的LuxR家族调控蛋白也具有类似的二级和三级结构。虽然LuxR的高级结构大致相同,但是LuxR的一级结构差异明显。不同种属的微生物之间,LuxR一级结构的氨基酸序列差异较大,具有较多的替代氨基酸[4]。LuxR家族调控蛋白作为生物被膜形成过程中的关键蛋白[13],是理想的生物被膜增强剂的候选蛋白,因此,通過不断对其进行深入研究和分析,对生物被膜的人为控制将具有非常良好的诱人前景。本研究采用生物信息学的分析方法,对沼泽红假单胞菌LuxR家族调控蛋白的理化性质和结构特征进行预测,为生物被膜增强剂的开发提供了新的思路。
参考文献:
[1]Kernan C,Chow P P,Christianson R J,et al. Experimental and computational investigation of biofilm formation by Rhodopseudomonas palustris growth under two metabolic modes[J]. PLoS One,2015,10(6):e0129354.
[2]刘 蕾,刘 义,李平兰. 益生菌生物被膜的研究进展[J]. 食品科学,2016,37(9):214-219.
[3]Salas-Jara M J,Ilabaca A,Vega M,et al. Biofilm forming Lactobacillus:new challenges for the development of probiotics[J]. Microorganisms,2016,4(3):35.
[4]郑世超,罗 瑛,鲁 涛. LuxR家族调控蛋白的结构及功能[J]. 生命科学,2010,22(9):886-895.
[5]王 越,李保珍,李 丹,等. 富纳米硒沼泽红假单胞菌的肝保护作用研究[J]. 生物技术通讯,2018,29(3):367-371.
[6]张炼辉.微生物群体感应系统的研究进展[J]. 华南农业大学学报,2019,40(5):50-58.
[7]韩云燕,李渐鹏,于红雷,等. LuxR基因对希瓦氏菌群体感应特性的影响研究[J]. 食品科技,2019,44(3):27-32.
[8]涂春田,汪 洋,易 力,等. 信号分子调控细菌生物被膜形成的分子机制[J]. 生物工程学报,2019,35(4):558-566.
[9]Tang R,Zhu J,Feng L,et al. Characterization of LuxI/LuxR and their regulation involved in biofilm formation and stress resistance in fish spoilers Pseudomonas fluorescens[J]. International Journal of Food Microbiology,2019,297:60-71.
[10]李更森,孔晋亮,罗 劲,等. 铜绿假单胞菌密度感应系统对铜绿假单胞菌-烟曲霉菌早期混合生物被膜的体外作用研究[J]. 中华医院感染学杂志,2019,29(7):961-965,970.
[11]Zhu Y L,Hou H M,Zhang G L,et al. AHLs regulate biofilm formation and swimming motility of Hafnia alvei H4[J]. Frontiers in Microbiology,2019,10:1330.
[12]Subramoni S,Venturi V. LuxR-family ‘solos:bachelor sensors/regulators of signalling molecules[J]. Microbiology,2009,155(5):1377-1385.
[13]舒 琴,牛永武,陳启和. 细菌生物被膜中群体感应调控机制及其控制研究展望[J]. 生物加工过程,2019,17(3):292-299. 许珊华,章嘉淇,卢 婷,等. 基于微卫星标记的不同种质资源罗氏沼虾遗传多样性研究[J]. 江苏农业科学,2021,49(6):45-51.
