α-MnO2@ZAC活性炭复合材料的制备及其电化学性能研究
2021-05-06赵思宇樊晗晗宋雪萍
李 曜 赵思宇 樊晗晗 宋雪萍,*
(1.广西工业职业技术学院,广西南宁,530001;2.广西大学轻工与食品工程学院,广西南宁,530004;3.广西清洁化制浆造纸与污染控制重点实验室,广西南宁,530004)
生物质材料因其成本较低、来源广泛,已逐渐成为制备高附加值碳材料的重要碳前体物[1-2],近年来,使用低附加值蔗渣制备多孔活性炭材料吸引了越来越多学者的关注。活性炭作为传统的碳基材料,其天然的孔结构优势和高比表面积使其可作为一种较优的导电材料,但是活性炭材料受其比表面积的限制,很难进一步提高由其制备的双电层超级电容器的电容性能。因此,通过材料复合方法提高活性炭电极的性能成为了超级电容器的发展趋势[3]。二氧化锰(MnO2)因其高理论电容(可达1370 F/g)的特点,受到了研究者广泛的关注,同时,MnO2具有资源丰富、成本低、环境友好等特点,被认为是发展赝电容器的理想材料[4-5]。MnO2作为赝电容器常用的电极材料,原理是通过法拉第电化学活化反应的相互作用储存能量(电子)。MnO2的电活化过程有两个关键反应[5]:①电解质的阳离子(X+)渗入MnO2的晶体空腔;②电极向MnO2输送电子(e-)以保持电荷中性,这种法拉第电化学相互作用也称为电化学插层[6]。实际上,能量密度取决于电极中氧化还原材料的电化学活化程度,而氧化还原材料的导电性是决定电化学活化程度的关键[5]。MnO2作为电极材料,其低质量负载和低电化学活化度仍然是有待克服的主要缺点,且理论上电子可以穿透MnO2的厚度需要小于420 nm[6]。MnO2导电性主要通过以下几种方式进行改善:①将MnO2的尺寸缩小到纳米级后,将其电解并沉积在大比表面积的导电材料表面[7];②掺杂其他导电元素来改善MnO2的导电性[8];③用导电材料(如纯碳纳米管薄片)包裹纳米尺寸的MnO2以增强其导电性[5]。此外,α-MnO2纳米线具有独特的一维形貌结构,能进一步提升超级电容器赝电容,且可利用KMnO4进行简单的水热法制得[7];同时活性炭具有的孔结构优势和高比表面积可以为α-MnO2纳米线提供生长成核位点。因此,将α-MnO2与活性炭进行结合制备超级电容器电极,通过协同效应增加活性炭的电化学性能,在发挥MnO2赝电容优势的同时可以优化活性炭的电化学性能,从而增加整体的电化学性能。这种制备方法步骤简单、绿色环保、成本较低,对未来商业化具有一定的应用潜力。
本研究将ZnCl2活化法制备的活性炭(ZAC)作为导电基底,将KMnO4原料在水热过程中反应生成的一维α-MnO2沉积到ZAC 上,并组装成α-MnO2@ZAC//ZAC 非对称超级电容器,在1 mol/L Na2SO4中研究不同α-MnO2沉积量对复合材料电化学性能的影响,以期提高以活性炭作为导电材料的超级电容器的电容性能。
1 实 验
1.1 材料与试剂
实验原料取自广西某造纸厂蔗糖生产后的残余物蔗渣,自然风干后用粉碎机粉碎至60 目。ZnCl2、KMnO4、乙酸(CH3COOH),分析纯;H2O2(质量分数10%),均购自美国Sigma-Aldrich科技有限公司。
1.2 MnZAC-X的制备
1.2.1 活性炭(ZAC)的制备
将15 g绝干蔗渣和90 mL 质量分数为10%的H2O2溶液混合均匀后装载于WZC-500 型高温高压反应釜(五洲鼎创(北京)科技有限公司)中,以3.7℃/min的速率升温至200℃并保温20 min。反应结束后,开启循环冷却水系统迅速冷却物料,待冷却至室温后取出并于(105±5)℃的烘箱中干燥至恒质量后得到水热炭。接着,采用相同流程将水热炭与ZnCl2按质量比2∶1 混合,随后按固液比1∶6 将混合物与去离子水混合后装载于反应釜内,采用相同的水热温度和条件制得固体物备用。采用CHY-1200 型管式炉(河南成仪实验室设备有限公司)对该固体物进行碳化,具体步骤为:将样品置于瓷舟中,通入50 mL/min 的高纯N2,以10℃/min 的速率升温至800℃,在该温度下将N2切换至40 mL/min 的高纯CO2并保温2 h;待反应结束后,迅速将CO2切换成N2,关闭加热器使样品在惰性气氛下冷却至室温后取出。采用0.1 mol/L HCl溶液在80℃下洗涤碳化产物,再用去离子水冲洗至中性并过滤,将获得的固体产物在(105±5)℃下干燥至恒质量,即得到活性炭(ZAC),储存备用。
1.2.2 MnZAC-X的制备
称取0.5 g 的KMnO4粉末装于锥形瓶中,并向锥形瓶中加入0.4 mol/L 的CH3COOH 溶液30 mL,室温下慢速搅拌至KMnO4完全溶解,随后在该溶液中分别加入0.250、0.375、0.500、0.625、0.750 g ZAC,混合均匀后装载到水热反应釜中,在140℃条件下反应12 h;待反应结束后,迅速将反应釜置于冷水中快速冷却至室温,取出样品并用蒸馏水反复抽滤洗涤至中性;随后在60℃的烘箱内干燥至恒质量,制得α-MnO2@ZAC 复合材料。将这种复合材料命名为Mn-ZAC-X,其中MnZAC 为在ZAC 上掺杂α-MnO2纳米线得到的复合材料,X为ZAC和KMnO4按照不同质量比进行掺杂的简单命名,如将m(ZAC)∶m(KMnO4)=0.250∶0.500 的 样 品 命 名 为MnZAC-1,m(ZAC)∶m(KMnO4)= 0.375∶0.500 命名为MnZAC-2,以此类推,最终得到MnZAC-1、MnZAC-2、MnZAC-3、Mn-ZAC-4、MnZAC-5 共5 种复合材料。制备过程示意图如图1所示。
另外设置两个对照组:第一组为ZAC,不进行任何处理;第二组为在不加入KMnO4的情况下,对ZAC 进行水热处理,水热反应条件与MnZAC-X 完全相同,其产物命名为ZAC-S。

图1 α-MnO2@ZAC(MnZAC-X)复合材料的制备过程示意图Fig.1 Schematic illustration of the fabrication process of α-MnO2@ZAC(MnZAC-X)
1.3 MnZAC-X的性能表征
1.3.1 孔结构表征
采用多站式比表面积分析仪ASAP2460(Micro Meritics 公司,美国)对制备好的样品进行孔结构性能分析[9]。具体步骤为:将样品在120℃的条件下进行脱水脱气处理12 h,以高纯N2为吸附介质,在-193.15℃的温度下,相对压力(P/P0)由10-8逐渐增大至1、再从1 逐渐减小至10-8,从而获得N2吸附-脱附等温线。材料的比表面积和平均孔径采用Brunauer-Emmett-Teller(BET)理论计算,微孔体积利用t-Plot方法计算。总孔容为相对压力大于0.999 时的N2吸附量,孔径分布根据密度泛函理论(Density functional theory,DFT)计算获得。
1.3.2 透射电子显微镜(TEM)表征
采用TEM(TECNAI G2 F30,FEI,美国)观察样品的内部孔结构(形貌、尺寸、晶面间距等)[10-11],加速电压为300 kV。样品前处理过程为:样品经研钵研碎后,超声分散于5 mL 无水乙醇中,用一次性注射器取1 滴悬浊液滴于200 目铜网超薄碳支持膜上,室温下自然干燥24 h 后,利用TEM 在高分辨模式下进行观察。
1.3.3 元素分析仪(EA)表征
采用元素分析仪(2400 II,Perkin Elmer,美国)分析样品的元素组成[12]。测试时,使用CHN和O两种工作模式进行分析。测试过程为:取0.02~0.03 g干燥样品包裹于锡囊中,并折叠成约2 mm×2 mm 大小的方块,利用元素分析仪对样品进行测试。
1.3.4 X射线光电子能谱仪(XPS)表征
采用XPS (ESCALAB250XI,Thermo Fisher Scientific,美国)分析样品的表面元素种类及价态信息[13-14]。干燥样品经研钵研碎后,在8 MPa 压力下压制成片,利用XPS 进行分析测试。测试条件为:在2×10-7真空度 下,采用单色化Al 靶 的Kα 源(hv=1486.6 eV)作为辐射光源,先在通能(Pass energy)100 eV、步长1 eV、0~1400 eV 范围条件下进行全谱扫描,再在通能30 eV、步长0.1 eV 条件下进行窄谱扫描3次,以表面污染碳的结合能C 1s=284.8 eV作为内标对样品表面各元素进行荷电校正。
1.3.5 X射线衍射仪(XRD)表征
采用XRD(Bruker D8,Brook,德国)分析表征样品的晶相结构[15]。测试条件:以Cu 靶Kα 源为辐射源,λ波长0.154178 nm,管电压40 kV,管电流40 mA,广角扫描范围2θ=10°~80°、扫描速度5°/min。实验获得的XRD谱图与粉末X射线衍射标准卡(JCPDS)进行比照分析。
1.3.6 拉曼表征
采用显微拉曼光谱仪(LabRAMHR,HORIBA Jobin Yvon,法国)分析样品的内部电子能级、能带结构等物理信息[16]。室温条件下,将样品均匀分散在载玻片上,在激发波长633 nm、功率0.24 mW的条件下进行测试。
1.4 电极片的制备
1.4.1 三电极电极片制备
为了制备三电极测试所需的工作电极,首先对电极片的集流体进行适当的前处理。本实验所用集流体均为泡沫镍,将裁剪好的方形泡沫镍(1 cm×1 cm)置于乙醇中浸泡30 min,再将其置于去离子水中在60 kW 功率下超声波处理1 h,之后将超声波处理完的泡沫镍置于60℃真空干燥箱内进行干燥备用[17-18]。将0.4 g 黏性浆料(MnZAC-X、炭黑和聚四氟乙烯(PTFE)质量比为8∶1∶1)与5 mL 乙醇混合,在60 kW 功率下超声波处理1 h,获得电极材料混合物[19]。最后,将获得的电极材料混合物均匀涂覆于经过前处理的泡沫镍集流体上,再在60℃的真空干燥箱内干燥12 h。干燥的电极片经过称量质量后,利用压片机在15 MPa 下压制30 s,使电极片固定成型。最后,将制备的电极(厚度约100 μm,面积1.0 cm2)在1 mol/L Na2SO4溶液中浸泡10 h。
1.4.2 两电极电极片制备
两电极电极片的制备过程与三电极大致相同,不同的是,两电极体系的电极片集流体泡沫镍裁剪成面积为1 cm2的圆形。
1.4.3 非对称型超级电容器的组装
组装之前,将隔膜与电极一起在电解液中浸泡10 h,从而使电解液能够更好地浸润电极和隔膜。非对称型双电层超级电容器装置的组装过程为:将2个相似质量的电极片对称放置,正极用MnZAC-X 做电极材料,负极用ZAC 做电极材料,用日本NKK 水系滤纸膜隔开,制备成非对称的超级电容器(MnZACX 电极/隔膜/ZAC)。将制备好的电容器置于模具中,并在1 mol/L Na2SO4的电解液中进行电化学测试。每个电极上活性材料的质量负载为5.0 mg/cm2。
1.5 电化学性能表征
在室温下,采用瑞士万通AutoLab M204 电化学工作站表征电极电化学性能。在三电极体系中,制备好的三电极电极片、Pt 片和Ag/AgCl 分别为体系中的工作电极、对电极和参比电极,并根据1.4.3 中的方法组装成非对称型超级电容器。其循环伏安(CV)曲线、恒流伏安(GCD)曲线和交流阻抗(EIS)曲线测试参数和测试条件分别如下。
1.5.1 循环伏安法测试
电极片CV 曲线在电压-1~0 V 和Ag/AgCl 电位范围内获得,分别采用5、10、20、30、50、100 mV/s 6 种扫描速率测试电极片在不同扫描速率下的电容性能。
1.5.2 恒流充放电法测试
在GCD 曲线的测试中,电极片在-1~0 V 的电压范围内,分别以0.5、1、3、5、10 A/g 5 种不同的电流密度进行充放电测试,以获得电极片的充放电性能。
1.5.3 交流阻抗法测试
在交流电流幅度为5 mV,频率范围为10 kHz~0.1 MHz的开路电压下测量电化学阻抗谱(EIS)。
2 结果与讨论
2.1 XPS和元素含量分析
为考察MnO2是否成功掺杂在ZAC 上,采用XPS和EA对材料进行测试,结果如表1和表2所示。
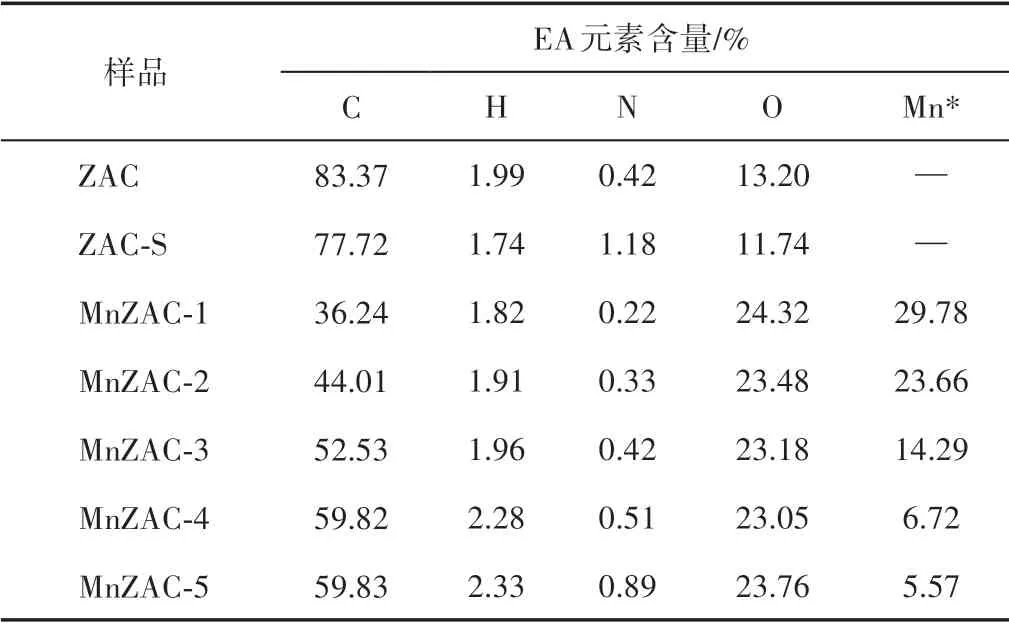
表1 EA测定的ZAC、ZAC-S和MnZAC-X的化学成分Table 1 Chemical composition of ZAC,ZAC-S and MnZAC-X by EA

表2 XPS测定的ZAC、ZAC-S和MnZAC-X的化学成分Table 2 Chemical composition of ZAC,ZAC-S and MnZAC-X by XPS
根据表1 可知,ZAC 中成功掺杂了Mn。其中,MnZAC-1中Mn含量最高,为29.78%;且随着ZAC 占比增加,ZAC 负载的Mn 含量依次降低,在ZAC 占比最大的MnZAC-5 样品中Mn 含量最低,为5.57%。由表2 可知,XPS 的结果与EA 结果相似,Mn 含量随着ZAC 占比增加依次降低。同时,随着ZAC 占比减少,从MnZAC-5 到MnZAC-1 样品的C 含量下降、O 含量上升,可归因于KMnO4的强氧化作用刻蚀了一部分C原子并形成了一些表面含氧基团,这些含氧官能团会提高电极材料的润湿性,增加材料的导电率。此外,与ZAC 相比,ZAC-S 样品中的C、O 含量下降较少,说明水热法对ZAC的元素影响不大。
为了确定Mn元素的价态信息,对MnZAC-X进行了XPS测试,如图2所示。图2(a)为ZAC-S和MnZACX 在全扫描情况下的XPS 光谱图,结果显示主要有C 1s、O 1s 和Mn 2p 3 种主峰,表明ZAC 的表面存在一定量的Mn。对MnZAC-4 进行了分峰处理,结果如图2(b)所示,发现在结合能分别为642.42 eV 和654.17 eV 处观察到Mn 2p3/2和Mn 2p1/2的自旋轨道双峰[5],也说明了KMnO4的Mn7+变成了MnO2的Mn4+,证明该反应成功掺杂了MnO2,推测其反应方程式如式(1)所示,但Mn存在的形态仍需进一步探究。
2.2 XRD和拉曼光谱分析
为了探究MnZAC-X 掺杂的MnO2的形态以及晶型结构,利用XRD 和拉曼光谱对MnZAC-X、ZAC-S 进行了测试,分析结果如图3所示。由图3(a)可以看出,ZAC-S 在2θ=23.1°处展现出了发育良好的石墨堆积峰[20],并且由于形成更高程度的层内结构(石墨结构)而在2θ=43.8°处存在弱峰[21],表明ZAC-S 还保持着典型的活性炭结构。相较于ZAC-S,MnZAC-X 也有类似的衍射峰,表明其石墨结构的存在,但同时MnZAC-X 在2θ分别为28.7°、37.5°、55.9°、65.2°、71.9°处均出现尖锐的衍射峰,尤其在2θ=28.7°处峰最强,其峰位置与2×2 四方晶系结构的α-MnO2的标准谱图基本吻合,分别对应于(310)(211)(600)(002)(312)的晶面峰,这些衍射峰的存在与α-MnO2的沉积有关,且表明该水热法形成的是一种一维隧道结构的纳米状α-MnO2晶体[3]。此外,位于1320 cm-1和1580 cm-1处附近的峰分别归属于传统碳基材料的特征D 带(缺陷和无序) 和G 带(石墨)[22]。由图3(b)可知,MnZAC-X 的D 峰和G 峰的峰值均较弱,而MnZAC-X 样品分别在181、315、374、579、653 cm-1处出现5个较高的拉曼峰,这是由于α-MnO2分子上不同的分子键发生的不同振动(例如平移引起的表面振动、弯曲振动、位移振动等)引起的[23]。同时,MnZAC-X 在653 cm-1处达到最高衍射峰值,也进一步证明了一维隧道结构的纳米状α-MnO2的存在[24],这与XRD 结果相符,也说明了该水热法制备生成了主要以一维隧道结构的纳米棒状为主要晶相的α-MnO2。
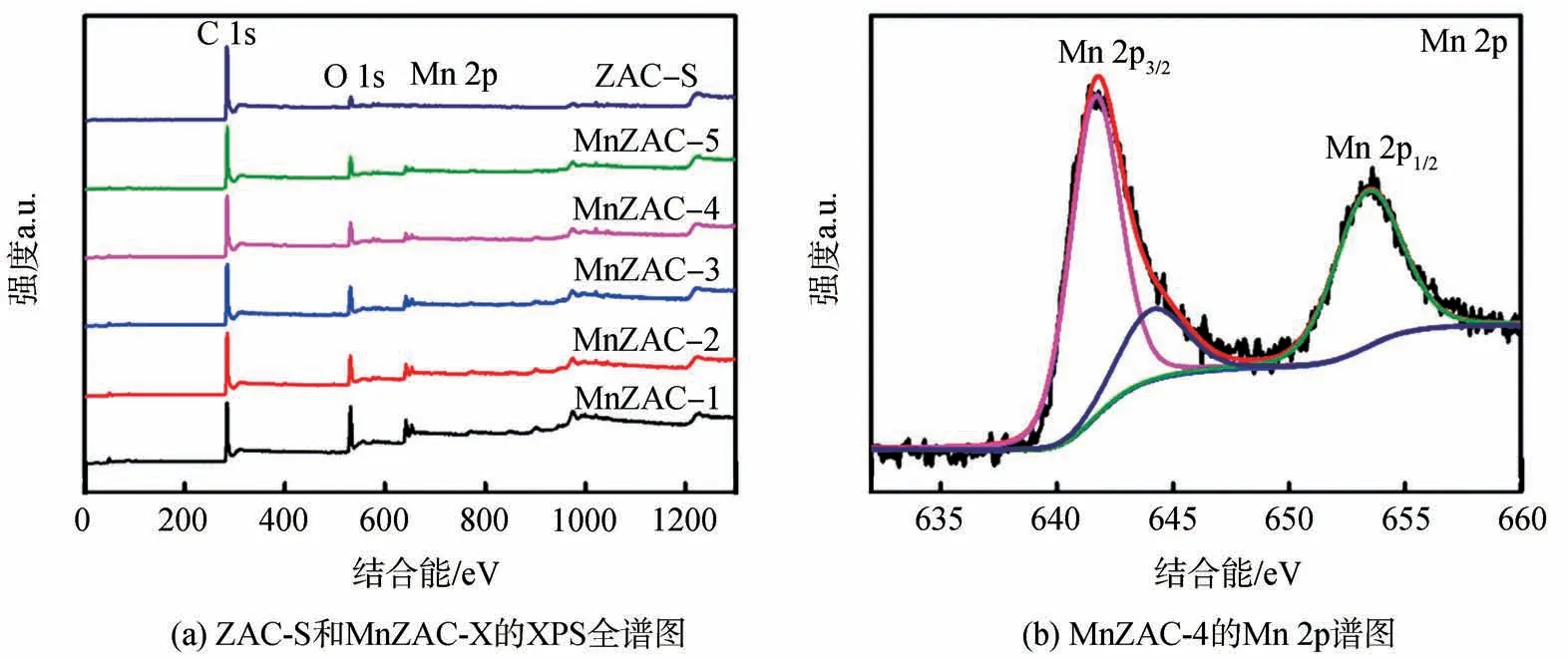
图2 ZAC-S、MnZAC-X的XPS全谱图和MnZAC-4的XPS Mn 2p谱图Fig.2 XPS spectra of ZAC-S,MnZAC-X and the Mn 2p spectrum of MnZAC-4
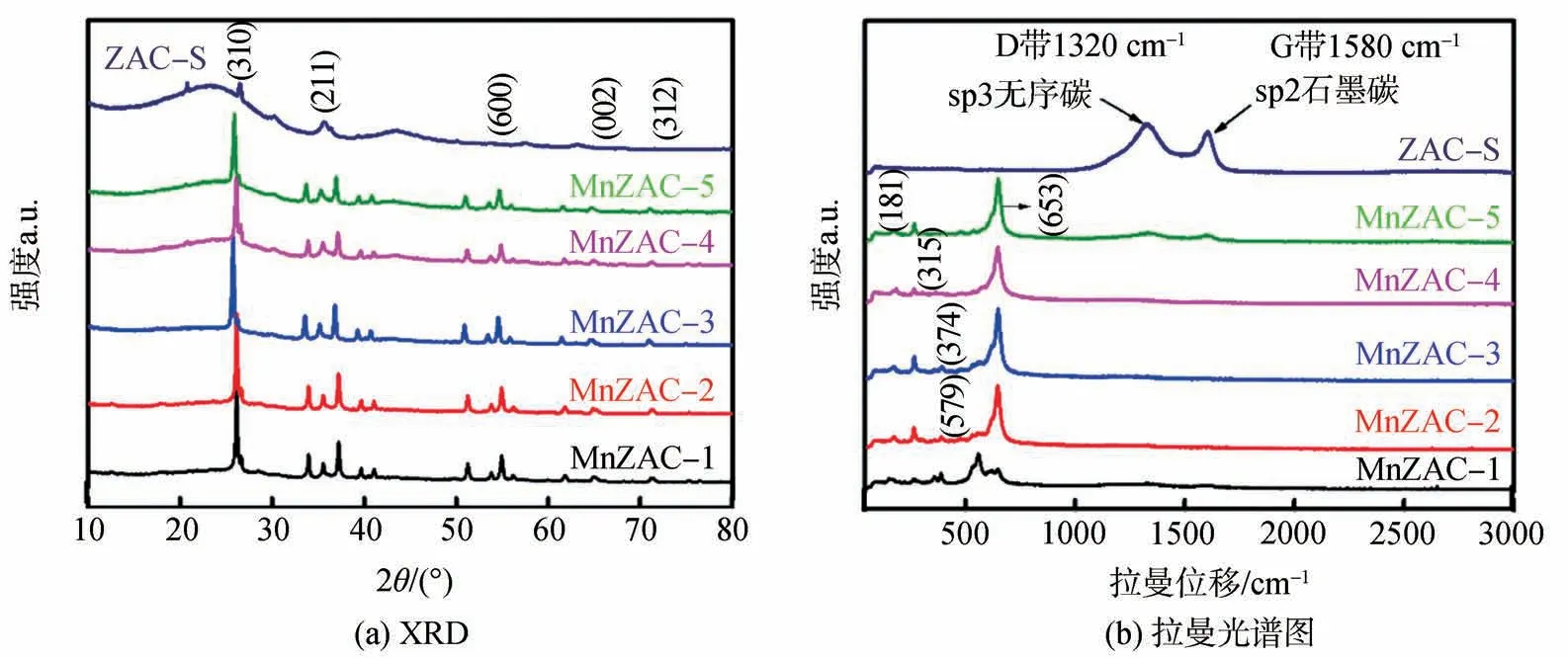
图3 ZAC-S、MnZAC-X的XRD谱图和拉曼光谱图Fig.3 XRD curves and Raman spectra of MnZAC-X and ZAC-S
2.3 TEM分析
图4 为MnZAC-X 的TEM 图。由图4 可知,在分辨率为100 nm 的情况下,MnZAC-1 样品中具有最多的纳米状α-MnO2结构。由图4(d)可以观察到,在高分辨率下,α-MnO2是覆盖兼穿插在ZAC 结构中的,其中直径10 nm、长100 nm 左右的α-MnOOH 纳米棒均匀地沉积在ZAC 表面;而直径5 nm 的α-MnO2纳米线则穿插在ZAC 的结构中,这是因为MnO2和ZAC 之间的吸附能使得MnO2易沉积在非晶碳表面和中孔孔道中,这也说明ZAC中≥5 nm的介孔能够为5 nm左右的α-MnO2纳米线提供生长的成核位点。虽然这将会导致部分介孔体积下降,但由于α-MnOOH 纳米棒也具有一定的比表面积,故MnZAC-X 的比表面积应下降不大。由图4(e)还可以观察到清晰的晶格条纹,间距为0.302 nm,这与XRD的结果一致。
根据以上对MnZAC-X 的分析,推测了α-MnO2的形成机理如图5以及式(2)~式(4)所示。
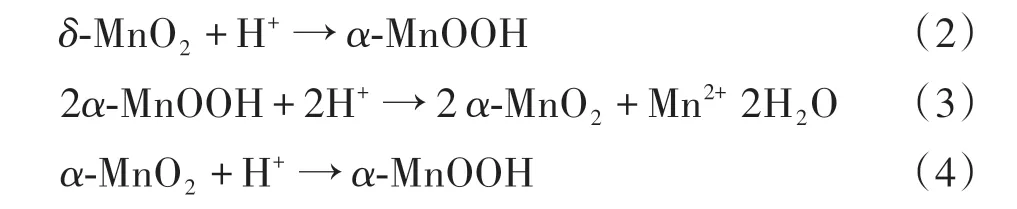

图5 α-MnO2纳米线的生长机理示意图Fig.5 Schematic illustration for the formation of α-MnO2 nanowires
推测机理如下:在0.4 mol/L 的CH3COOH 溶液中,140℃水热条件下反应12 h 过程中,KMnO4首先形成MnO2的大块颗粒,随着反应的进行,高温条件下MnO2会逐渐发生溶解,形成了厚度约10 nm 的δ-MnO2纳米片;δ-MnO2纳米片是属于横向单元链的八面体结构,每个单元链相互连接,中间夹杂着电解质离子平行堆叠成的二维层状空间结构[5],离子扩散通道较宽,有利于电解质离子的快速插入/提取;随着温度的提高和反应时间的延长,这种结构的纳米片又朝着结构更稳定的一维隧道型α-MnOOH 纳米棒发展(见式(2));然后,高温条件下α-MnOOH 纳米棒继续与CH3COOH 溶液中的H+反应生成一维隧道型的α-MnO2纳米线(见式(3));在最后反应阶段,一维隧道型α-MnOOH 纳米棒和一维隧道型的α-MnO2纳米线之间存在动态平衡(见式(4));一维隧道结构较二维空间层状结构具有更好的热力学稳定性,由二维层状结构的δ-MnO2到一维隧道结构的α-MnO2过程,不仅在空间结构上更加稳定,晶体结构也更规则明显,可以提供更多的吸附位点以供电解质离子发生氧化还原反应增加赝电容;同时在此动态平衡中,CH3COOH 溶液中的羰基一部分会与MnO2上的羟基成键[4],由于空间位阻效应,更粗的纳米棒结构的α-MnOOH 也会逐渐形成纳米线结构的α-MnO2,结合图4(a)~图4(c)也可以清楚地观察到;但由于ZAC 表面的羟基也会与CH3COOH 溶液中的羰基发生氢键结合,会争夺一部分CH3COOH 溶液中的羰基;所以,随ZAC比例的增加,纳米线型的α-MnO2会逐渐减少,相应纳米棒结构的α-MnO2出现,由图4(d)和图4(f)也可以观察到,在ZAC 表面堆叠着纳米棒型α-MnOOH和穿插在ZAC孔结构中的纳米线型α-MnO2。
2.4 BET分析
活性炭孔结构的孔径大小及分布对超级电容器储能电解液离子的扩散具有决定性作用[25],为了分析水热反应过程中MnO2的掺杂对ZAC 孔结构的影响,利用BET 对MnZAC-X 进行了测试,结果如图6 和表2所示。由图6(a)可以看出,根据IUPAC 分类,所有等温曲线均显示为IV 型,即在低压区域(P/P0≤0.4)展现出微孔结构特有的台阶线,而在高压区域(P/P0≥0.4)出现介孔结构特有的滞后回环,这表明水热反应下KMnO4对ZAC 的刻蚀以获得微孔和介孔结构为主。由图6(b)和图6(c)可以看出,6 种材料均为兼具微孔(孔径ɸ<2 nm)和介孔(2 nm<ɸ<50 nm)的材料,且在孔径小于2 nm 的微孔区域0.7、1.2、1.6 nm处均出现了峰,且均显示为MnZAC-1 样品峰值最高,其次是MnZAC-4;在孔径大于2 nm 的介孔区域内,MnZAC-3、MnZAC-4 和MnZAC-5 样品的介孔范围主要表现为<5 nm。由图6(b)和图6(c)发现,MnZAC-X的介孔体积均比ZAC-S 的有所增大,这是由于在水热高温下KMnO4的强氧化性对ZAC 进行了刻蚀,一定程度上增加了部分介孔结构;而相同的KMnO4用量时,ZAC 量的增加,单位质量的ZAC 受到KMnO4刻蚀的程度有所下降,导致随着ZAC 用量的增加介孔体积不断下降。然而,MnZAC-X 的微孔体积相比于ZAC-S 出现了先下降后增加又下降的现象,在Mn-ZAC-4处达到最大值,可能是因为MnZAC-1、MnZAC-2、MnZAC-3 3 种材料在形成过程中,KMnO4的强氧化性对ZAC 部分微孔也进行刻蚀形成部分介孔结构,导致微孔减少;在制备MnZAC-4 过程中,KMnO4对ZAC 的刻蚀程度在形成介孔结构的同时更倾向于保留部分微孔结构,导致微孔体积相对上升;在制备MnZAC-5 的过程中,由于KMnO4对ZAC 的刻蚀程度更低,导致ZAC 形成的介孔和微孔结构均下降(见表2)。结合图4 可知,MnO2和ZAC 之间的吸附能使MnO2易沉积在非晶碳表面和中孔孔道中,同时,ZAC 中孔径≥5 nm 左右的介孔能够为α-MnO2纳米线(直径5~10 nm、长100 nm)提供生长的成核位点,这也导致了部分介孔减少。这种α-MnO2占据介孔的行为,可以让α-MnO2成功地穿插在ZAC 结构中,电解质离子就可以在一维隧道状结构的α-MnO2中进行穿插和脱附,从而发生快速的氧化还原反应形成赝电容来进行储能。

图6 MnZAC-X的BET分析图Fig.6 BET analysis graphics of MnZAC-X

表3 MnZAC-X的孔结构Table 3 Pore characteristics of MnZAC-X
进一步分析了样品的BET 比表面积及其孔体积,结果如表3 所示。从表3 可知,随着ZAC 用量的增加,负载α-MnO2后,ZAC 的比表面积和微孔面积出现了先降低后增加又降低的趋势。MnZAC-1 与Mn-ZAC-4的微孔面积几乎一致,同样可以更多地进行储能,但是由于MnZAC-1 具有更多的介孔,会导致电解质离子较快地流失,不利于储能。与ZAC-S 相比,MnZAC-4 样品的比表面积、微孔面积和总孔体积均较大,且总孔体积在所有MnZAC-X 材料中达到最大值,这些特性将使得MnZAC-4 材料非常利于电解质离子的储能,这点在后续材料的电化学性能分析上也得到了体现,说明MnZAC-4 在结构上具有非常大的储能优势。
2.5 电化学性能分析
2.5.1 三电极体系在不同扫描速率下材料电化学性能测试
通过CV 曲线可以判断电极反应的可逆性、反应机理以及电极材料的工作电压窗口范围等,从而评判电极材料电化学性能的好坏[26]。图7为MnZAC-X的电化学性能测试。由图7(a)可以看出,MnZAC-X 的CV曲线均保持类似的矩形形状和良好的对称性,说明其具有良好的可逆性;并且MnZAC-X的CV 曲线均显示出氧化还原波,说明在充放电过程中发生了法拉第现象从而产生赝电容;同时也观察到MnZAC-4 具有最大的扫描曲线面积,说明MnZAC-4 具有更高的比电容。根据图7(b)可知,MnZAC-4 在不同的扫描速率下均能保持类矩形形状,即使在高扫描速率下,CV 曲线的形状也没有明显的变形,这意味着制备得到的材料与电解液的接触电阻很低[27]。而MnZAC-X 的储能机理主要是ZAC 为主的双电层电容和α-MnO2形成的赝电容的结合,其中α-MnO2的储能机理为:电解质离子H+和Na+在α-MnO2结构中的穿插和抽出的过程实现Mn4+、Mn3+、Mn2+多价态之间的转变,通过这种氧化还原反应的方式进行储能,反应方程式如式(5)~式(6)所示。
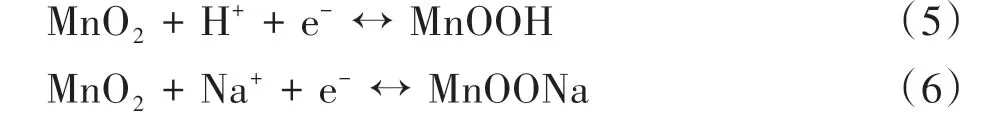
对MnZAC-4的特性进行分析发现,相对于其他4种材料来说,MnZAC-4 拥有最优的电化学性能,这归功于ZAC的孔结构以及与纳米线型α-MnO2的结合。同时,图7(c)也验证了这一点,在相同的电流密度2 A/g条件下,MnZAC-4放电时间最长,对称性最好。质量比电容(Csp)计算见式(7)[28]。

式中,I为放电电流,A;Δt为放电时间,s;ΔV为放电时间Δt内的电位变化,V;m为工作电极中活性物质的质量,g。
在电流密度0.5 A/g 时,经计算得出MnZAC-1、MnZAC-2、MnZAC-3、MnZAC-4 和MnZAC-5 的Csp分别为175、232、264、327、228 F/g,且MnZAC-4的Csp优于ZAC (282 F/g)、刘云鹏等人[29]制备的KOH 复合材料(174 F/g) 和许伟佳等人[30]制备的MnO2/Ac2(250.7 F/g),说明MnZAC-4 是一种理想的电极材料。由图7(d)分析可知,即使在大电流密度下,MnZAC-4 的恒流充放电曲线也能保持良好的对称性,说明该材料的充放电可逆性良好。

图7 MnZAC-X的电化学性能测试Fig.7 Electrochemical performance test of MnZAC-X
分析图7(e)可知,在高频区中,MnZAC-4 具有最小的电荷传质电阻Rct,说明MnZAC-4 氧化还原反应进行得较快;在低频区,MnZAC-X 均具有类垂直于纵轴的曲线,其中MnZAC-1 接近垂直于纵轴,这归因于其较大孔径的介孔结构较多;其次是MnZAC-4,一部分由于介孔结构,另一部分由于纳米线型的α-MnO2在ZAC 的介孔中形成的穿插式独特的一维隧道结构,形成较小的Warburg 阻抗,从而使其拥有最佳的法拉第扩散过程,这些都说明了MnZAC-4 具有优异的电化学性能。图7(f)的倍率性能分析也证明了这一点,从小电流到大电流的过程中,MnZAC-4 的比电容衰减幅度最小,说明其倍率性能最佳。
2.5.2α-MnO2@ZAC//ZAC 型非对称超级电容器的电化学性能测试
将MnZAC-4 作为正极,ZAC 作为负极,中间用日本NKK 水系滤纸隔开,滴加1 mol/L Na2SO4的电解液,组装成α-MnO2@ZAC//ZAC 型非对称超级电容器,通过电化学性能的分析来评估它的实际应用性,结果如图8所示。

图8 α-MnO2@ZAC//ZAC型非对称超级电容器的电化学性能测试Fig.8 Electrochemical performance test of α-MnO2@ZAC//ZAC asymmetric supercapacitors
由图8(a)可知,在不同的扫描速率下,该超级电容器的CV 曲线保持大致的矩形形状,说明其具有良好的电容行为;曲线中未出现较明显的氧化还原峰,保持良好的对称性,说明其可逆性良好;由图8(b)可以看出,该超级电容器具有良好的循环特性;结合图8(c)可以看出,在循环1000 次之后,该电容器仍能保持88.2%的比电容,表现出良好的循环稳定性。
3 结 论
为提高活性炭作为超级电容器的的电容性能,本研究以ZnCl2活化法制备的活性炭(ZAC)作为导电基底,采用水热反应将一维α-MnO2沉积到ZAC 上,研究不同α-MnO2沉积量对MnZAC-X 的电化学性能影响。
3.1 通过水热法在ZAC 表面沉积了以一维隧道结构的纳米棒状为主要晶相的α-MnO2,且MnZAC-X 系列材料中存在石墨结构。在MnZAC-X中,随着ZAC占比的增加,ZAC上负载的Mn含量从29.78%减至5.57%,且ZAC中的碳含量上升、氧含量下降,MnZAC-X的导电性降低。
3.2 在ZAC 上复合α-MnO2制备MnZAC 复合材料的机理为:在CH3COOH 水热环境下,KMnO4首先形成大块颗粒的MnO2,然后MnO2会逐渐发生溶解形成δ-MnO2纳米片;随着温度的提高和反应时间的延长,纳米片δ-MnO2又朝着结构更稳定的一维隧道型α-MnOOH 纳米棒发展,α-MnOOH 继续与CH3COOH中的H+反应,生成空间结构上更加稳定、晶体结构也更规则明显的一维隧道型的α-MnO2纳米线,同时α-MnOOH和α-MnO2之间存在动态平衡。
3.3 MnZAC-4 具有最大的比电容327 F/g;在循环1000 次之后,制备的α-MnO2@ZAC//ZAC 型非对称超级电容器的比电容仍能保持88.2%,且电化学阻抗较小。
