猪带绦虫Ts14-3-3.2重组蛋白诱导小鼠免疫应答的研究
2021-05-06刘美辰欧阳任辉周必英
刘美辰,欧阳任辉,2,罗 波,周必英
14-3-3蛋白是一种在真核生物中广泛存在且高度保守的蛋白质家族[1],其蛋白二聚体可结合多种靶蛋白,通过让2个靶蛋白相互靠近而产生作用,因此很多学者将其看作一种接头蛋白或配体蛋白(adaptor proteins)[2],从而参与了细胞信号转导、分裂增殖、衰老凋亡、酶活性的调节、细胞骨架的塑造等多种重要的生命活动[3]。
目前,很多学者以寄生虫14-3-3蛋白作为一种候选疫苗分子进行了广泛的研究[4]。课题组前期已证实猪带绦虫成虫和囊尾蚴中Ts14-3-3.2在基因[5]和蛋白(另文发表)水平上均有表达,并在成功制备了Ts14-3-3.2重组蛋白的基础上(另文发表),本研究将该重组蛋白免疫昆明小鼠,采用间接ELISA法检测免疫小鼠血清特异性IgG及其亚类(IgG1、IgG2a)水平;通过CCK-8法检测免疫小鼠脾淋巴细胞增殖反应;双抗夹心ELISA法检测免疫小鼠脾淋巴细胞培养上清液中IL-2、IFN-γ、IL-4、IL-10水平,进一步观察其诱导小鼠产生的免疫应答水平,旨在初步探究该重组蛋白的免疫原性,为进一步用于抗囊尾蚴感染的免疫保护力研究奠定基础。
1 材料与方法
1.1 实验材料
1.1.1Ts14-3-3.2重组蛋白来源 课题组前期已通过pC2nl质粒+Arctic Express宿主菌低温表达体系成功制备了较高纯度的Ts14-3-3.2重组蛋白,其相对分子质量约为29 kDa,利用该重组蛋白制备的免抗Ts14-3-3.2多克隆抗体可与猪带绦虫成虫及囊尾蚴中的天然Ts14-3-3.2蛋白发生反应。
1.1.2实验动物 60只6~8周龄SPF级雌性昆明小鼠,购自重庆实岽生物技术有限公司[许可证号:SCXK(辽)2015-0001]。本实验已通过遵义医科大学动物中心审查,符合动物伦理要求。
1.1.3主要试剂仪器 小鼠脾淋巴细胞分离试剂盒(天津灏洋生物制品有限公司);RPMI 1640培养基(美国HyClone公司);刀豆蛋白A(Concanavalin A, ConA)、弗氏完全佐剂(complete Freund’s adjuvant, CFA)、弗氏不完全佐剂(incomplete Freund’s adjuvant, IFA)(美国Sigma公司);辣根过氧化物酶(horseradish peroxidase, HRP)标记的羊抗鼠IgG、IgG1、IgG2a(英国Abcam公司);TMB显色液、ELISA抗原包被稀释液、HRP酶标抗体稀释液(北京索莱宝科技有限公司);CCK-8细胞增殖检测试剂盒(美国AXYGEN公司);鼠IL-2、IFN-γ、IL-4、IL-10检测试剂盒(北京诚林生物公司);其它试剂均为国产分析纯或化学纯。CO2培养箱(美国Thermo公司);超净工作台(中国苏净集团);酶标仪(美国Thermo公司)。
1.2 方 法
1.2.1实验动物分组与免疫 将60只全雌性昆明小鼠随机分为5组,每组12只,分别为Ts14-3-3.2重组蛋白50 μg剂量组、100 μg剂量组、150 μg剂量组以及弗氏佐剂对照组和PBS对照组。Ts14-3-3.2重组蛋白各剂量组采用重组蛋白与等体积CFA充分乳化后进行,间隔14 d后加强免疫1次,连续2次,加强免疫采用等体积IFA乳化,对照组分别注射相应弗氏佐剂和PBS。均以多点皮下注射方式接种。
1.2.2小鼠血清标本采集 在首次免疫后0 d、28 d、56 d每组各取4只小鼠,眼球摘除采血,分离血清,-20 ℃冻存待查。以Ts14-3-3.2重组蛋白(40 μg/mL)作为抗原包被酶标板,每孔100 μL;以小鼠血清(1∶100稀释)为一抗,HRP标记的羊抗鼠IgG(1∶10 000稀释)、IgG1(1∶1 000稀释)、IgG2a(1∶1 000稀释)为二抗,采用间接ELISA法测定血清特异性IgG及IgG1、IgG2a水平。
1.2.3小鼠脾淋巴细胞悬液制备 以无菌操作解剖取小鼠脾脏,按小鼠脾淋巴细胞分离试剂盒说明书制备脾淋巴细胞悬液,并使用10%胎牛血清的RPMI 1640培养液稀释至浓度为5×106/mL,备用。
1.2.4脾淋巴细胞增殖水平的测定 采用CCK-8法对脾淋巴细胞增殖水平进行检测。每份小鼠标本均分设原液组、ConA刺激组、Ts14-3-3.2抗原刺激组,以1.2.3获取的脾淋巴细胞悬液200 μL/孔加至96孔细胞培养板中(即:每孔加入了1×106个脾淋巴细胞),将Ts14-3-3.2重组蛋白和ConA各取2 μg分别加入抗原刺激组和ConA刺激组,混匀,置于5% CO2培养箱中培养46 h后,各组各孔分别加入CCK-8溶液20 μL,混匀,继续置于5% CO2培养箱中培养2 h,使用酶标仪测定波长450 nm处的OD值(即OD450值)。
1.2.5脾淋巴细胞培养上清液中IL-2、IFN-γ、IL-4、IL-10水平的测定 每份小鼠标本均分设原液组、ConA刺激组、Ts14-3-3.2抗原刺激组,以1.2.3步骤获取的脾淋巴细胞悬液0.5 mL/孔加至24孔细胞培养板中,将Ts14-3-3.2重组蛋白和ConA各取5 μg分别加入抗原刺激组和ConA刺激组,混匀,置于5% CO2培养箱中培养48 h,将各组各孔培养液4 000 r/min离心,收集上清液,-20 ℃冻存待查。采用双抗夹心ELISA法检测上清液中IL-2、IFN-γ、IL-4及IL-10浓度。
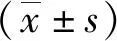
2 结 果
2.1小鼠血清特异性IgG、IgG1、IgG2a水平 如表1~3所示,小鼠血清中特异性IgG、IgG1、IgG2a水平,Ts14-3-3.2重组蛋白各剂量组均在首次免疫后第28~56 d显著升高且在56 d显著高于28 d,以及同时段150 μg剂量组>100 μg剂量组>50 μg剂量组(IgG:F=3365.893,P<0.05;IgG1:F=7879.129,P<0.05;IgG2a:F=4273.769,P<0.05);同时段佐剂组与PBS组相比,差异无统计学意义。
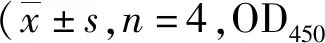
表1 Ts14-3-3.2重组蛋白免疫小鼠血清特异性IgG水平值)Tab.1 Level of specific IgG in sera in mice immunized with Ts14-3-3.2 recombinant protein
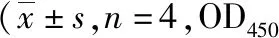
表2 Ts14-3-3.2重组蛋白免疫小鼠血清特异性IgG1水平值)Tab.2 Level of specific IgG1 in sera in mice immunized with Ts14-3-3.2 recombinant protein
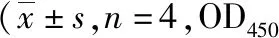
表3 Ts14-3-3.2重组蛋白免疫小鼠血清特异性IgG2a水平值)Tab.3 Level of specific IgG2a in sera in mice immunized with Ts14-3-3.2 recombinant protein
2.2小鼠脾淋巴细胞增殖水平 如表4所示,小鼠脾淋巴细胞增殖水平,Ts14-3-3.2重组蛋白各剂量组经抗原及ConA刺激,均在首次免疫后28~56 d升高,抗原刺激组免疫后28 d达到峰值,ConA刺激组58 d仍显著高于28 d,同时段150 μg剂量组>100 μg剂量组>50 μg剂量组,以及同时段同组内,ConA刺激组>抗原刺激组>空白原液组(F=339.571,P<0.05);佐剂组与PBS组相比,差异无统计学意义。
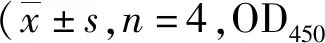
表4 Ts14-3-3.2重组蛋白免疫小鼠脾淋巴细胞增殖水平值)Tab.4 Level of spleen lymphocyte proliferation in mice immunized with Ts14-3-3.2 recombinant protein
2.3小鼠脾淋巴细胞培养上清液IL-2、IFN-γ、IL-4及IL-10水平 如表5~8所示,小鼠脾淋巴细胞培养上清液IL-2、IFN-γ、IL-4及IL-10水平,Ts14-3-3.2重组蛋白各剂量组均在首次免疫后28~56 d升高,免疫后第28 d达到峰值,同时段150 μg剂量组>100 μg剂量组>50 μg剂量组;以及同时段同组内,ConA刺激组>抗原刺激组>空白原液组(IL-2:F=253.527,P<0.05;IFN-γ:F=351.819,P<0.05;IL-4:F=103.935,P<0.05;IL-10:F=233.754,P<0.05);佐剂组与PBS组相比,差异无统计学意义(P>0.05)。
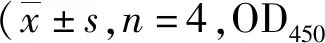
表5 Ts14-3-3.2重组蛋白免疫小鼠脾淋巴细胞培养上清液IL-2水平值)Tab.5 Level of IL-2 in spleen lymphocyte culture supernatant in mice immunized with Ts14-3-3.2 recombinant protein
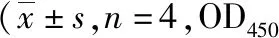
表6 Ts14-3-3.2重组蛋白免疫小鼠脾淋巴细胞培养上清液IFN-γ水平值)Tab.6 Level of IFN-γ in spleen lymphocyte culture supernatant inmice immunized with Ts14-3-3.2 recombinant protein
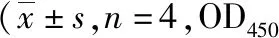
表7 Ts14-3-3.2重组蛋白免疫小鼠脾淋巴细胞培养上清液IL-4水平值)Tab.7 The level of IL-4 in spleen lymphocyte culture supernatant in mice immunized with Ts14-3-3.2 recombinant protein
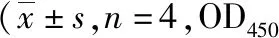
表8 Ts14-3-3.2重组蛋白免疫小鼠脾淋巴细胞培养上清液IL-10水平值)Tab.8 Level of IL-10 in spleen lymphocyte culture supernatant in mice immunized with Ts14-3-3.2 recombinant protein
3 讨 论
囊虫病是一种对人体健康危害极大的人兽共患寄生虫病,囊尾蚴的寄生可引起不同部位发生病变,其中以脑囊虫病最为严重,存在较高的致残率、致死率,并且由于囊虫病临床症状复杂多样,易与其它颅内疾病混淆而误诊误治。该病呈全球性分布,在我国西南地区和一些少数民族地区由于医疗卫生水平相对较低、饮食习惯不良,囊虫病仍然有散在病例[6-8]。研究表明,囊虫病的发生不仅有体液免疫应答的参与,也有细胞免疫应答的参与[9-10]。
IgG是血清主要的抗体成分,由脾、淋巴结等部位的浆细胞合成分泌,以单体形式存在,可分为IgG1、IgG2a、IgG2b、IgG3和IgG4等亚型,Th1型细胞因子促进B细胞产生IgG2a抗体亚型,Th2则促进IgG1和IgE的产生,因此IgG1和IgG2a水平也可提示免疫应答的类型和强弱[11-13]。本研究通过测定免疫小鼠血清IgG1和IgG2a水平,两者比例平衡,提示为Th1/Th2混合型免疫应答,与雷娜等[14]、曾瑞红等[15]的研究类似,在寄生虫14-3-3重组蛋白研究领域,华支睾吸虫[28]、日本血吸虫[16]和旋毛虫[17]14-3-3重组蛋白可诱导产生IgG1和IgG2a,与本研究相仿,而细粒棘球绦虫14-3-3重组蛋白诱导产生抗体倾向于IgG2a[18]。此外,本研究中三种抗体水平在一定范围内均呈现剂量-效应关系,与刘庆中等[16]、郑姣等[19]的结果类似。
淋巴细胞增殖是免疫系统接触抗原后,淋巴细胞发生增殖分化以发挥免疫学效应,其增殖水平反映了淋巴细胞的数量,进而反映了机体细胞免疫应答能力,常用于评价淋巴细胞的活性,而ConA作为一种丝裂原,可非特异性地刺激T淋巴细胞发生增殖[20-23]。目前最常用的淋巴细胞增殖测定方法包括四甲基偶氮唑盐(methyl thiazolyl tetrazolium, MTT)法和CCK-8法,两者均快速简便、灵敏度高,无放射性污染,特别适合大批量检测,尤其在检测悬浮细胞增殖中具有优势,其中MTT法相对CCK-8法操作仍显繁琐,往往因甲臜颗粒溶解不全影响实验结果,灵敏度也不及后者[24],因此有学者认为CCK-8法优于MTT法[20,25]。由于小鼠淋巴细胞增殖实验影响因素较多,有学者认为采用5×106/mL的脾细胞浓度、2~10 μg/mL的ConA刺激浓度可能是该实验的最佳条件[21]。本研究采用CCK-8法,5×106/mL脾细胞浓度,阳性对照采用10 μg/mL ConA刺激,对小鼠脾淋巴细胞增殖水平进行测定,结果显示不同剂量Ts14-3-3.2重组蛋白免疫昆明小鼠后,体外抗原刺激脾淋巴细胞出现明显增殖,与王强等[26]结论类似,其增殖水平均于28~56 d升高并于28 d达到峰值,高剂量组明显高于低剂量组,呈现剂量-效应关系。
根据原始CD4+T细胞受抗原信号刺激分化后产生细胞因子,可分为Th1与Th2两种细胞亚群[27]。其中,Th1细胞主要分泌IL-2、IFN-γ、TNF-α等,介导细胞免疫应答,Th2细胞主要分泌IL-4、IL-5、IL-6、IL-10、IL-13、TGF-β等,介导体液免疫应答[28],这两种细胞亚群之间存在动态平衡及相互抑制[29-31]。其中Th1应答有利于机体清除感染原,但容易引发宿主自身损害;Th2应答参与抗寄生虫的保护性免疫,但也可能引起感染的慢性化[32],Th1型免疫应答所诱导的抗寄生虫免疫保护力显著高于Th2型[33-35]。通过测定T细胞所产生细胞因子的类型和水平,可以明确免疫反应的类型和强弱[36]。对囊虫病而言,Th1和Th2应答同样在其发生、发展过程中同样起着非常重要的作用[9]。本研究通过Ts14-3-3.2重组蛋白联合弗氏佐剂免疫小鼠,测定培养脾淋巴细胞所产生的Th1型细胞因子(IL-2、IFN-γ)和Th2型细胞因子(IL-4、IL-10),观察到Ts14-3-3.2重组蛋白可诱导Th1/Th2混合型免疫应答,与抗体测定结论相符,这与既往研究发现的重组蛋白常可刺激机体产生Th1/Th2混合型应答[14-15, 37]结论相一致,但某些重组蛋白诱导Th2型为主[38],也有免疫初期Th1型,后期转为Th2型为主的报道[39]。在寄生虫14-3-3重组蛋白免疫效应的一系列研究中,通过细胞因子测定发现旋毛虫14-3-3重组蛋白可诱导小鼠产生Th1/Th2混合型应答[17],与本研究类似,而细粒棘球绦虫14-3-3重组蛋白则诱导Th1型主导的免疫应答[18],可能与不同虫种蛋白差异有关。某些添加物(如佐剂[40])还可调节蛋白诱导的免疫应答使之以Th1型为主[41-43],因此通过免疫调节剂增强免疫效果也是研究方向之一。
本研究通过对比小鼠免疫前后的血清中特异性抗体及其亚型水平变化,并检测重组蛋白体外刺激小鼠脾淋巴细胞所产生的细胞因子水平,初步明确了Ts14-3-3.2重组蛋白诱导小鼠产生的免疫应答变化趋势。结果表明,Ts14-3-3.2重组蛋白在28~56 d均诱导Th1/Th2混合型免疫应答,而免疫系统发挥的效应是体液免疫和细胞免疫综合作用的结果,提示Ts14-3-3.2重组蛋白具有囊虫病疫苗潜力。此外,细胞因子水平56 d均低于28 d,可能与免疫程序终止无进一步抗原刺激有关;抗体水平56 d高于28 d,可能与加强免疫诱导的再次应答所产生的抗体浓度高、体内持续时间长有关;免疫的最适剂量仍需要通过进一步增加抗原剂量才能明确。
此外,本研究观察到原液组、各剂量抗原组、ConA组脾淋巴细胞增殖水平和细胞因子水平均表现为ConA刺激>抗原刺激>原液,表明ConA的非特异性刺激诱导的脾淋巴细胞增殖和细胞因子分泌水平高于抗原的特异性刺激,可能与抗原仅能特异性诱导脾淋巴细胞增殖和细胞因子分泌有关。
本文研究了以不同剂量Ts14-3-3.2重组蛋白,在不同时间诱导小鼠产生的免疫效果。结果表明该重组蛋白可诱导小鼠产生特异性的体液免疫和细胞免疫应答,初步确定了较为合适的免疫剂量,为下一步进行该蛋白诱导的免疫保护力研究奠定了基础。
利益冲突:无
