豆渣中可溶性大豆多糖的提取工艺研究
2021-05-06李银峰赵亚奇丁明洁
李银峰,赵亚奇,李 霞,丁明洁
(河南城建学院材料与化工学院,河南平顶山467036)
大豆在我国食品行业占有举足轻重的地位,大豆加工过程中的副产物豆渣中有大量蛋白质、膳食纤维、维生素等对人体健康有利的成分[1-2]。相对于其他国家,我国每年产生的豆渣是其他国家的许多倍,但对于豆渣的利用率却较低,造成了大量的浪费。
水溶性大豆多糖是一种酸性多糖,可从豆渣中提取获得。水溶性大豆多糖具有较多优良性能,如抗氧化性[3]、保健功效[4-5]、酸稳定性[6]、作为抗结剂[7-8]、成膜性[9]等。豆渣中大约含有 30%的可溶性大豆多糖,与其他多糖相比,能显著降低血液中的胆固醇含量,减少糖尿病人对胰岛素的消耗。因此,将大豆产品制作过程中产生的豆渣废料进行充分的利用,从中提取可溶性大豆多糖,能降低企业的成本,提高原料的利用率。
据不完全统计,日本是提取和利用可溶性大豆多糖最早的国家,在1975年以前日本就有了8项专利,到20世纪末,关于豆渣的开发专利,日本已经遥遥领先世界上其他国家[10]。目前,我国也开始积极研究利用豆渣,并取得了一定成果。但同发达国家相比,仍存在较明显差距,主要表现在提取利用率低、开发方法简单,因此我国对于豆渣的开发利用研究有待深入。
目前,从豆渣中提取可溶性大豆多糖的方法包括热水浸提法[11-12]、酸浸提法[13-14]、碱浸提法[15]、超声波辅助提取法[16-17]、微波提取法[18]、酶提法[19-20]等。本文利用酸浸提法从豆渣中提取水溶性大豆多糖,分别从pH值、提取时间和固液比三个方面进行单因素试验,经过正交试验结果分析得出实验室条件下的最优提取工艺参数。
1 实验
1.1 实验原料及试剂
实验所需原料主要是干豆渣,购买自新瑞公司。实验所需试剂如表1所示。

表1 试剂
1.2 主要的仪器
实验所用仪器及设备如表2所示。

表2 实验仪器
1.3 实验方法
取豆渣粉并加入一定量水搅拌均匀,用盐酸调节其pH值,再进行加热处理后离心过滤,将得到的上清液进行浓缩处理,加入氢氧化钠进行去甲基化,再离心去除其中的沉淀;将调节过后的上清液浓缩,加入80%的乙醇进行沉淀处理,弃去上层溶液后沉淀干燥处理,得到可溶性大豆多糖的粗品。
2 结果与讨论
2.1 提取条件优化
从pH值、提取时间、固液比三个方面进行单因素实验,并分析每一个变量对可溶性大豆多糖提取的影响程度,然后进行正交实验分析,从而得出可溶性大豆多糖的最佳提取方案。
2.1.1 pH值对可溶性大豆多糖提取率的影响
按5组分别称取5 g豆渣粉,加入100 mL二次水,然后利用pH计用盐酸(HCL)调节pH值至2.5、3.0、3.5、4.0、4.5。用DF-101S集热式加热搅拌器在100℃温度下保温处理1 h,旋转速度为中,转子选大转子,然后进行离心处理得到上清液,将上清液用氢氧化钠进行去甲基化处理,调节pH值为11,同样用加热搅拌器在75℃加热50 min后取出,加入80%的乙醇进行沉淀处理,将其静置12 h,在TG16-WS高速台式离心机上7 000转离心20 min,得出沉淀,即粗多糖,将其放在电热真空干燥箱内恒温80℃进行烘干处理,最后将其研磨,放入试样袋保存。
pH值对可溶性大豆多糖提取率的影响如图1所示,从图1中可以看出,在同等条件下,pH值为3.0时提取率相对较高,在其两边呈递减状态。因此,确定提取液适宜的pH值为3.0。
2.1.2 提取时间对可溶性大豆多糖提取率的影响
将提取温度设定为100℃,提取时间分别为1 h、1.5 h、2 h,pH值取3.0,进行可溶性大豆多糖的提取,提取完成后进行研磨,留样封袋保存。

图1 pH值对可溶性大豆多糖提取率的影响

图2 时间对可溶性大豆多糖提取率的影响
提取时间对提取率的影响如图2所示,从图2中可以看出,在同等条件下,提取时间在1.5 h时提取率相对较高,并在其两端呈现递减状况,因此,选择提取时间为1.5 h。
2.1.3 提取的固液比对可溶性大豆多糖提取率的影响
分组分别称取5 g豆渣粉,设定提取温度为100℃,但调节固液比为1:20、1:25、1:30,固定时间为1 h,pH值取3.0,提取可溶性大豆多糖,进行研磨,封袋保存试样。
固液比对提取率的影响如图3所示,从图3可知,固液比为1:25时,提取率相对较高。因此,选择固液比为1:25。
2.1.4 正交实验分析
正交实验主要是通过pH值、提取时间以及固液比来设计,正交实验数据见表3,结果分析见表4。

图3 固液比对可溶性大豆多糖提取率的影响
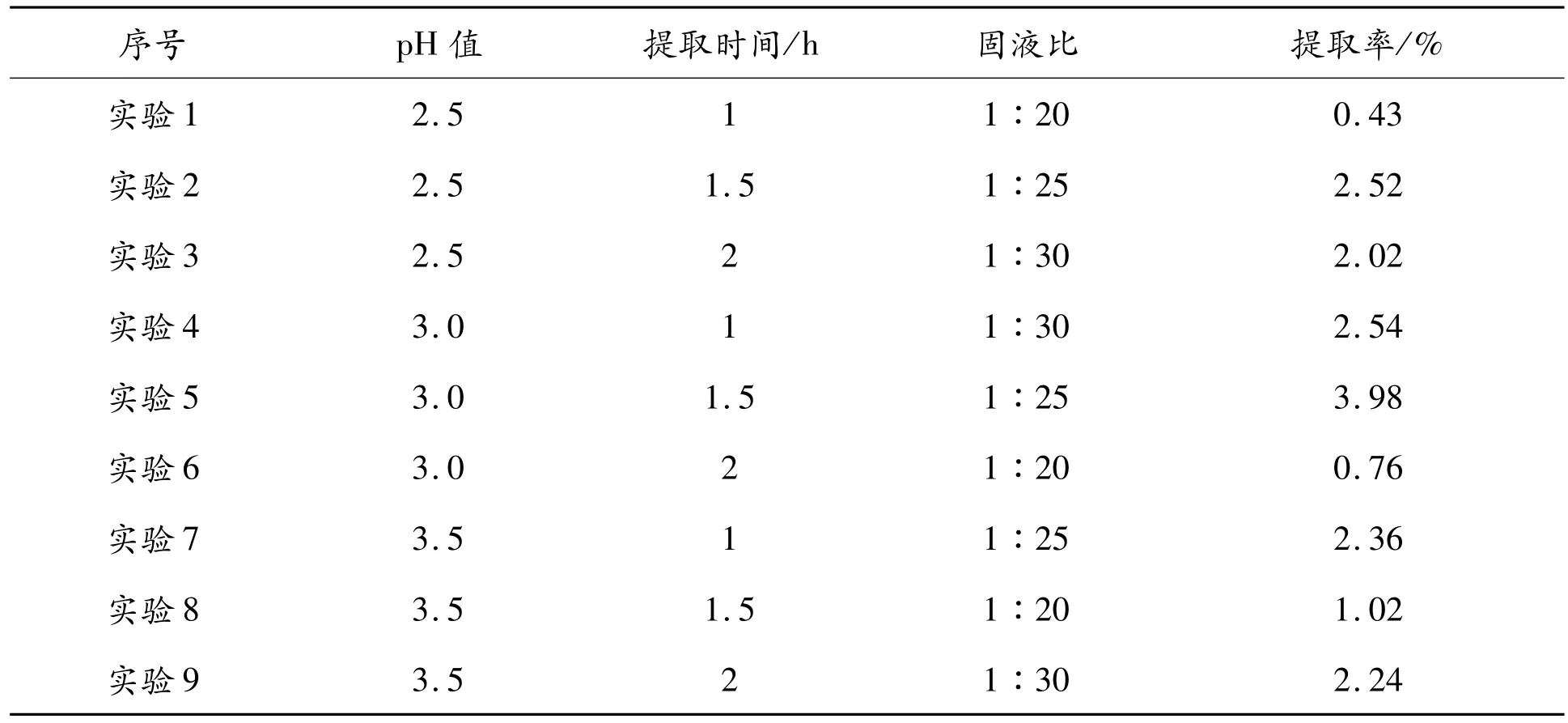
表3 正交实验

表4 正交实验结果分析
由表3、表4可知:豆渣中提取可溶性大豆多糖的因素优劣关系为:固液比>提取时间>pH值,正交实验的最优条件:pH值为3.0、时间为1.5 h、固液比为1:25,提取率为3.98%。
2.2 产品分析
2.2.1 对多糖进行纯度分析
利用苯酚—硫酸法进行多糖含量纯度的测定,包括工作曲线的绘制和实际样品的测定。
(1)葡萄糖标样工作曲线绘制
标准曲线的测定:准确配置葡萄糖标准溶液,浓度为100μg/mL。精密吸取葡萄糖标准溶液0 mL、0.2 mL、0.4 mL、0.6 mL、0.8 mL、1.0mL、1.2 mL、1.6 mL、2.0 mL分别置于 20 mL的比色管,加水至2.00 mL,此时葡萄糖的浓度为0μg/mL,10μg/mL,20μg/mL,30μg/mL,40μg/mL,50μg/mL,60μg/mL,80μg/mL,100μg/mL。
向上述各比色管中加入6%的苯酚溶液1.00 mL,摇匀,移液管移取5.00 mL的浓硫酸于比色管中,震荡摇匀,沸水加热2 min左右,冷却至室温,以未加入葡萄糖的比色管为参比,在486 nm下进行试样吸光度的测定,实验结果见表5。
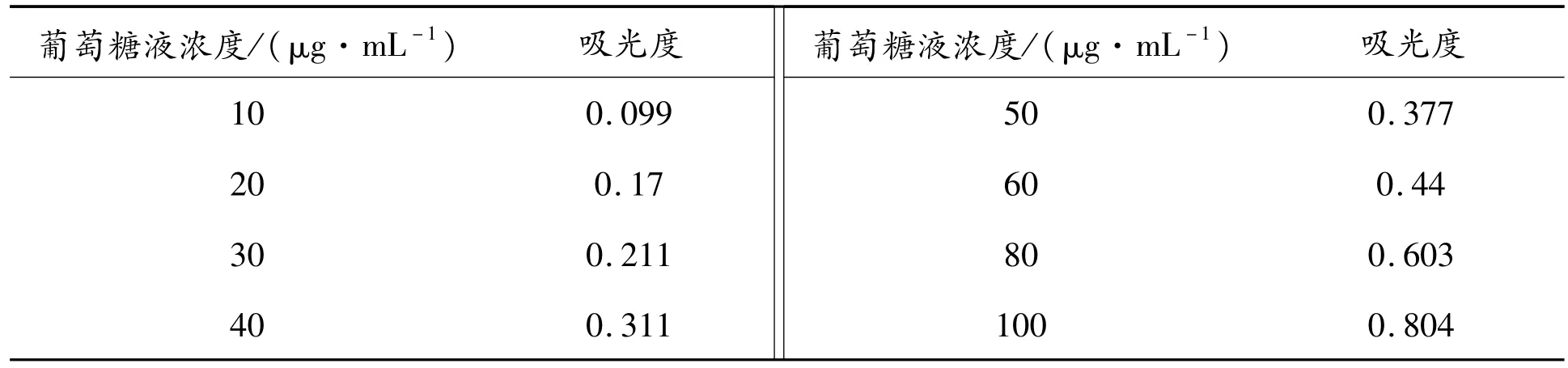
表5 葡萄糖的吸光度表
以吸光值为纵坐标,葡萄糖浓度为横坐标,制作标准曲线,如图4所示。对其进行线性拟合,得到回归方程y=0.0077x+0.0006(R2=0.9942)。
(2)可溶性大豆多糖含量的测定
将所得的粗糖进行配样,准确称取0.01 g的可溶性粗糖于100 mL的容量瓶中进行定容,振荡溶解,得100μg/mL的样品溶液。取1.00 mL样品液加入1.00 mL二次水,再加入1.00 mL苯酚溶液,5.00 mL的浓硫酸,进行振荡,同样放入DF-101S集热式加热搅拌器用沸水加热2 min左右,在室温下静置,同样在486 nm下测定吸光度,进行多糖粗品试样的分析,结果见表6。

图4 标准曲线

表6 测定数据
由表6可以看出:不同提取条件下得到的多糖含量在42.1%~85.8%,其中pH值为3.0条件下提取的多糖含量在75.7%~85.8%,说明pH值不仅影响提取多糖的产率,而且影响样品多糖的含量。
2.2.2 红外光谱分析
对正交实验中不同条件下获得的多糖样品进行了红外光谱分析,如图5所示。从红外光谱图中可以看出,不同提取条件下的样品,具有相似的红外吸收曲线。在峰值为3 000~3 500 cm-1时,存在-OH的伸缩振动吸收峰;在2 500~3 000 cm-1时,C-H因为变角振动出现吸收峰;在1 680 cm-1左右应该为C=O的吸收峰;在500~1 000 cm-1时存在着α糖苷键以及β糖苷键。
3 结论
本文以豆渣为原料,运用酸浸提法提取可溶性大豆多糖,研究了用酸浸提取法提取可溶性大豆多糖的提取工艺。对影响可溶性大豆多糖提取率的主要因素(包括提取液pH值、提取时间、固液比)进行了对比分析,得到较优提取工艺为:pH值取3.0,固液比为1:25,提取时间为1.5 h,在此条件下提取率为4%左右,纯度达到85%。
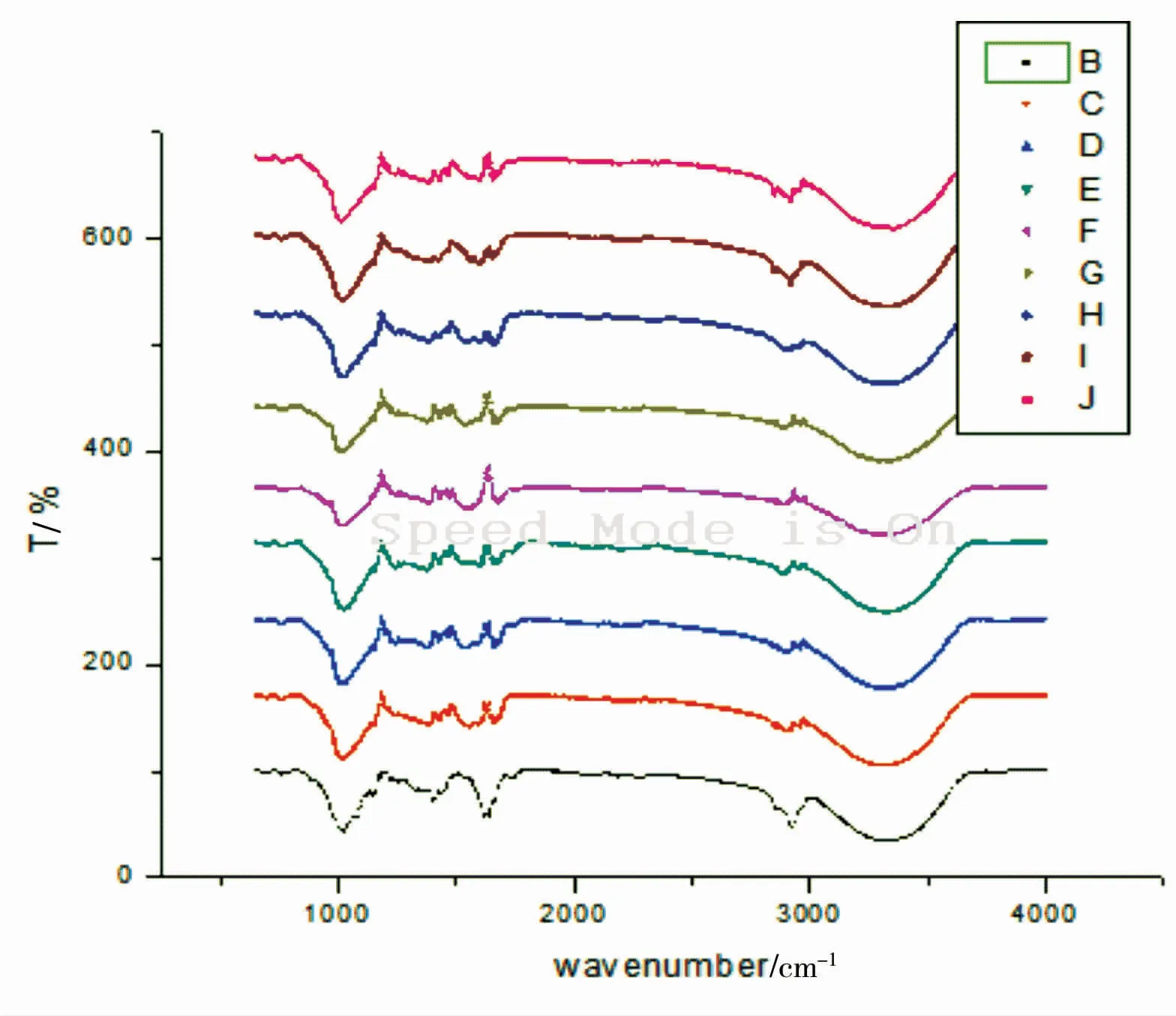
图5 红外光谱(B-J为正交实验1-9获得的样品)
