武汉东湖沉积物好氧氨氧化微生物时空分布
2021-04-30张志忠程德玺廖明军汪淑廉
张志忠,程德玺,廖明军,汪淑廉,李 祝*
武汉东湖沉积物好氧氨氧化微生物时空分布
张志忠1,2,程德玺1,廖明军1,2,汪淑廉1,李 祝1,2*
(1.湖北工业大学土木建筑与环境学院,湖北 武汉 430068;2.河湖生态修复及藻类利用湖北省重点实验室,湖北 武汉 430068)
采用实时荧光定量PCR(qPCR)技术,测定了武汉东湖沉积物中氨氧化古菌(AOA)和氨氧化细菌(AOB)氨单加氧酶基因()的丰度,并结合沉积物水体环境中各形态氮素的含量,分析氮素含量对AOA和AOB的时空分布的影响.结果显示, AOA基因丰度大于AOB基因丰度,表明AOA对氨氧化过程的贡献较大.同时,AOA和AOB基因丰度都随深度增加而降低.此外,间隙水的总氮、氨氮、硝酸盐氮以及亚硝酸盐氮浓度分别为6.28~33.56、2.71~22.7、0.12~0.98、0.01~0.13mg/L;上覆水的总氮、氨氮、硝酸盐氮以及亚硝酸盐氮平均浓度分别为1.68,0.79,0.16,0.04mg/L;表层水的总氮、氨氮、硝酸盐氮以及亚硝酸盐氮平均浓度分别为1.34,0.62,0.11,0.03mg/L,表明东湖东湖沉积物相对于水体呈营养盐可释放状态.相关性分析表明:AOA基因丰度与间隙水氨氮和亚硝酸盐氮浓度呈显著正相关(<0.05),AOB基因丰度与间隙水亚硝酸盐氮(NO2--N)浓度呈显著正相关(<0.05).
实时荧光定量PCR;沉积物;氨氧化古菌;氨氧化细菌;丰度
沉积物作为湖泊水体中氮的重要“源”和“汇”,是水体中氮的主要贡献者[1-2].栖息于沉积物中的部分微生物通过参与氮循环过程,包括氮的固定、硝化作用、反硝化作用和氨氧化作用[3],促进氮的转化.其中氨氧化作用作为硝化作用的首要环节,是硝化过程的关键限速反应[4].氨氧化作用的速率取决于氨氧化古菌(AOA)和氨氧化细菌(AOB)的丰度[5].而AOA与AOB在不同的生境中,受温度、溶解氧、有机质、pH值、氮素浓度和盐度等环境因子的影响,两者的丰度、群落结构、多样性以及氨氧化效率等不尽相同[6-8],氨氧化微生物的分布与氮循环氨氧化过程之间的联系复杂.
由于生理生化机制的差异,AOA与AOB具有不同的环境偏好[9-10].在大多数湖泊环境中,AOA的丰度均高于AOB[11-12],但也存在AOB的丰度高于AOA的情况[13-15].总体来说,AOA往往在低pH值、低氧和寡营养的条件下比AOB更占优势.在巢湖以及太湖的沉积物中,AOA的丰度与硝酸盐氮浓度呈显著负相关,AOB的丰度与氨氮和亚硝酸盐氮浓度呈显著正相关[14].而在若尔盖花湖的沉积物中,总氮、氨氮、硝酸盐氮以及亚硝酸盐氮与AOA的丰度均呈显著正相关[16].造成不同湖泊中氮素含量与好氧氨氧化微生物分布之间联系差异的原因尚不明确,需要进一步研究.
根据近几年对武汉东湖各子湖水质的监测结果发现,牛巢湖水质为Ⅳ类,官桥湖水质为劣Ⅴ类,郭郑湖水质状况次于牛巢湖.其次,牛巢湖靠近风景区,周边污染源较少,官桥湖和郭郑湖靠近学校生活区,有利于对比研究.因此,本研究选取具有代表性的郭郑湖、官桥湖、牛巢湖作为研究对象,监测表层水、上覆水及沉积物间隙水中的氮素浓度.同时,采集沉积物泥样提取泥样中微生物的DNA,采用实时荧光定量PCR技术,以功能基因作为分子标记,定量分析沉积物中AOA和AOB基因丰度.研究AOA和AOB在沉积物中不同时空以及深度下的分布特征,分析其与表层水、上覆水和沉积物间隙水中氮素浓度之间的相关性.旨在揭示武汉东湖不同营养水体中氨氧化微生物的动态变化,为进一步研究湖泊沉积物氮循环机理和开展湖泊生态修复提供理论参考.
1 材料与方法
1.1 样品采集
本研究以东湖为研究对象,在东湖子湖郭郑湖(采样点A)、官桥湖(采样点B)和牛巢湖(采样点C)各设置一个采样点(图1).采样坐标为A:(30°33'19''N, 114°23’26''E);B:(30°31'51''N,114°23'31''E); C:(30°33'39''N,114°25'43''E).采样时间为2016年7月30日、2016年11月28日、2017年4月4日及2017年9月10日,分别代表夏(SU)、冬(WI)、春(SP)、秋(AU)4个季节.沉积物采样的同时采集表层水、上覆水和间隙水.

图1 东湖采样点
1.2 理化性质测定
以《水和废水监测分析方法》第四版[17]方法测定硝酸盐氮(NO3--N)、亚硝酸盐氮(NO2--N)、氨氮(NH4+-N)以及总氮(TN).参考国标《CJ/T221-2005》[18]方法测定沉积物含水率.
1.3 AOA和AOB丰度测定
1.3.1 沉积物DNA的提取 参考陆诗敏等[19]报道的方法,提取沉积物中总基因组.以λ-Hind Ⅲ DNA Maker为标准,在1%的琼脂糖凝胶电泳上进行检测,观察目的基因是否有条带,用Nanodrop ND-1000测定样品的浓度及纯度,-20℃保存,以待后续分析.

表1 氨氧化微生物amoA基因PCR扩增引物及条件
1.3.2 标准质粒的构建 AOA和AOB所用的PCR引物、扩增的目的片段及扩增条件见表1,扩增体系为:2μL模板,上下游引物各0.25μL (10μmol/L), 2× Taq Master Mix 10μL加上无菌双蒸水补足至20μL. PCR产物经切胶纯化后,用DNA连接试剂盒将纯化后的PCR产物连接到pMD18-T载体上,产物再经过转化、筛选后测序.AOA和AOB序列的阳性质粒克隆菌株用LB液体培养基扩大培养,用TIAN prep Mini Plasmid Kit质粒小提试剂盒提取质粒备用.
1.3.3 AOA和AOB基因丰度测定 采用SYBR Green法进行qPCR,反应体系使用SYBR Premix Ex TaqTMⅡ替代普通PCR反应体系中的2×Taq Master Mix,其余条件与普通PCR相同,得到标准曲线.每次扩增都设置阴性对照组,分别对4个季节中3个子湖的不同分层沉积物样品中的AOA和AOB基因进行扩增,得到每个样品提取的DNA中基因丰度.
1.4 数据处理与分析
利用Originpro 2019b软件对东湖表层水、上覆水以及间隙水理化指标数据进行处理,利用SPSS 22.0统计分析软件对丰度和环境因子数据进行方差分析和相关性分析.
2 结果与分析
2.1 表层水、上覆水和间隙水不同季节氮含量的变化
如图2(a)所示,表层水的总氮、氨氮、硝酸盐氮以及亚硝酸盐氮平均浓度分别为1.34,0.62,0.11, 0.03mg/L.在4个季节中,官桥湖的表层水中硝酸盐氮、亚硝酸盐氮、氨氮和总氮的含量均显著高于郭郑湖和牛巢湖(<0.05).对于不同的季节而言,3个子湖表层水中春季总氮含量最高,而秋季总氮含量最低.对于同一子湖的表层水,3种无机氮中氨氮含量明显高于硝酸盐氮和亚硝酸盐氮的含量,且氨氮的含量与总氮含量变化一致,而硝酸盐氮和亚硝酸盐氮的含量较低且无明显变化趋势.
如图2(b),上覆水的总氮、氨氮、硝酸盐氮以及亚硝酸盐氮平均浓度分别为1.68,0.79,0.16,0.04mg/ L.与表层水相似,在4个季节中官桥湖的上覆水中硝酸盐氮、亚硝酸盐氮、氨氮和总氮的含量均显著高于牛巢湖和郭郑湖(<0.05).同时,官桥湖春季上覆水中总氮含量远高于其它季节,而郭郑湖和牛巢湖的上覆水在不同季节中的氮含量无明显差异(> 0.05).同样地,上覆水中3种无机氮中氨氮含量最高,且氨氮含量的变化趋势与总氮一致,而硝酸盐氮和亚硝酸盐氮的含量较低且无明显变化趋势.
如图2(c),间隙水的总氮、氨氮、硝酸盐氮以及亚硝氮浓度分别为6.28~33.56、2.71~22.7、0.12~ 0.98、0.01~0.13mg/L.分析3个子湖表层沉积物(0~ 5cm)间隙水在不同季节氮含量的变化,发现氮的各种存在形态在间隙水中的含量比在表层水和上覆水中的含量高.官桥湖的表层沉积物间隙水中氨氮和总氮的含量显著高于牛巢湖和郭郑湖(<0.05),而硝酸盐氮和亚硝酸盐氮的含量在3个子湖中则无明显差异(>0.05).对于同一子湖中无机氮的含量,氨氮含量最高,其次是硝酸盐氮,亚硝酸盐氮含量最低.
综上分析,硝酸盐氮和亚硝酸盐氮的含量在表层水、上覆水和间隙水中无明显差异;而对于总氮和氨氮的含量依次是间隙水>上覆水>表层水.表明3个子湖的氨氮在4个季节中不断由沉积物向湖水中释放,导致湖水中氨氮和总氮浓度不断上升,这可能是东湖一直处于重度污染的内在原因.
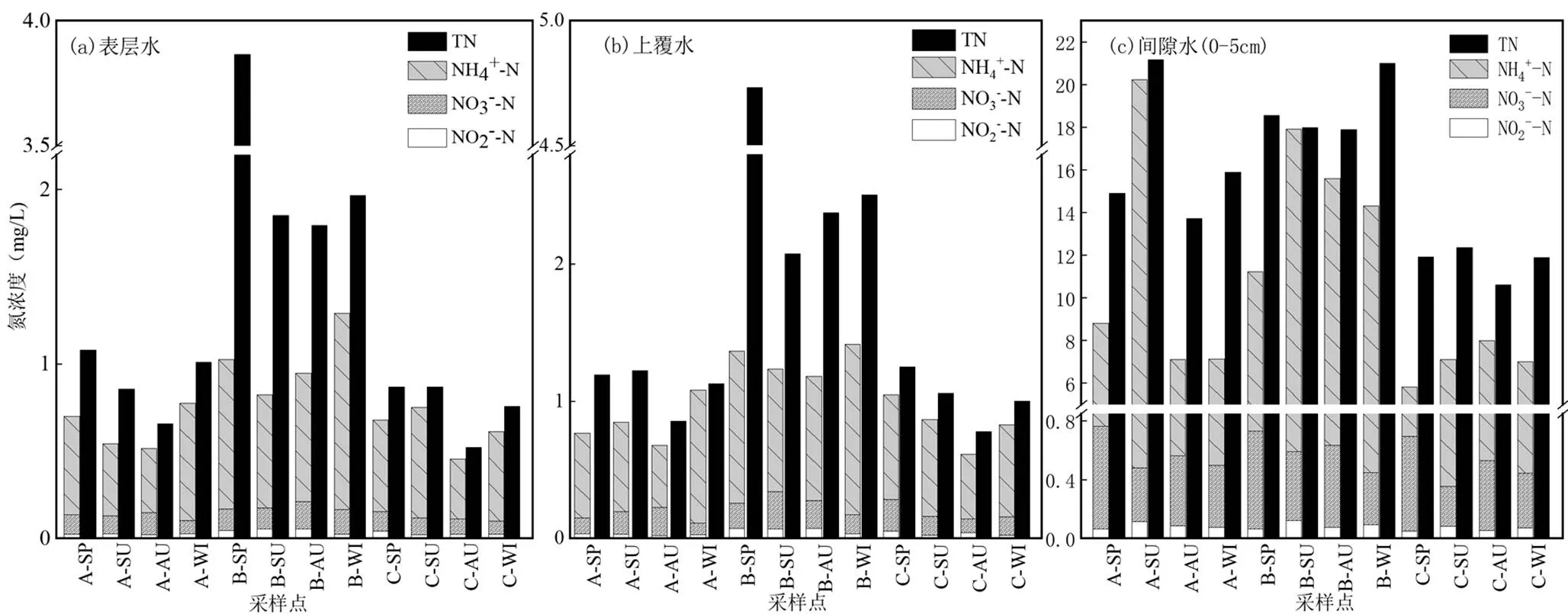
图2 不同季节研究水体中4种氮素含量变化情况
2.2 AOA与AOBamoA基因丰度时空分布特征
东湖3个子湖中AOA与AOB丰度有明显的季节差异性;同时,在沉积物的分层采样结果中发现,丰度随空间变化较大,结果见图3.
不同季节中AOA基因丰度不同,春季的丰度为4.50×105~3.68×108copies/g,夏季的丰度为8.07×105~1.58×108copies/g,秋季的丰度为6.21×105~ 4.99×108copies/g,冬季的丰度为8.27×105~4.13× 108copies/g.同样的,AOB基因丰度在不同的季节也明显不同,春夏秋冬4个季节中AOB基因丰度分别为1.14×105~5.32×106,1.66×104~1.14× 106,9.57×104~4.21×106和5.18×104~8.89×105copies/ g.总体来看,AOA基因丰度在夏季最高,而在其它3个季节无明显差异(>0.05);AOB基因丰度在春季最高,冬季最低,而在其它2个季节无明显差异(>0.05).
不同深度沉积物的AOA基因丰度见图3(a)~(d).表层沉积物丰度为2.38×106~4.99× 108copies/g,中层沉积物AOA基因丰度为6.21×105~1.25×108copies/g,底层沉积物丰度为4.50× 105~5.06×107copies/g.在东湖的3个子湖中,夏季AOA基因丰度随着采样深度的增加而降低,官桥湖的AOA基因丰度比郭郑湖和牛巢湖高(图3a).而在春、秋和冬季,AOA主要存在于表层沉积物中(0~5cm),而在5cm以下的深度,基本无AOA的存在,且都在0~1cm深度时AOA丰度最大;在这3个季节中,在0~1cm深度均是官桥湖中AOA基因丰度最高,郭郑湖次之,牛巢湖最低(图3b-d).

不同深度沉积物的AOB基因丰度见图3(e)~(h).表层沉积物AOB基因丰度为1.25× 105~5.32×106copies/g,中层和底层沉积物AOB基因丰度分别为7.31×104~7.68×105copies/g和1.66× 104~5.15×105copies/g.在夏季和冬季,3个子湖不同深度(0~20cm)沉积物中均有AOB的分布,表层(0~5cm)AOB基因丰度最高;在夏季最高的是郭郑湖,而冬季最高的是官桥湖.在春季和秋季,AOB主要分布在0~4cm深度,同样是在表层(0~1cm)最高;在春季最高的是官桥湖郭郑湖,而冬季最高的是郭郑湖.
2.3 AOA/AOB(amoA基因丰度比)
在所有采样点中,AOA基因丰度均高于AOB,AOA/AOB为2~546.相关性分析表明,AOA基因丰度与AOB基因丰度呈极显著正相关(<0.01,相关系数为0.572).如图4所示,郭郑湖和牛巢湖的AOA/AOB在夏季均呈现先增加后降低的变化趋势,郭郑湖AOA/AOB在15~20cm达到峰值(图4a),而牛巢湖AOA/AOB在10~15cm达到峰值(图4c).在其他季节,AOA/AOB在不同深度变化不大.

图4 不同子湖AOA/AOB(amoA基因丰度比)垂直变化
2.4 氨氧化微生物amoA基因丰度与间隙水理化性质相关性
如表2所示,夏季AOA基因丰度与间隙水氨氮和亚硝酸盐氮浓度呈极显著正相关(<0.01), AOB基因丰度与间隙水氨氮和亚硝酸盐氮浓度呈极显著正相关(<0.01);冬季AOA基因丰度与间隙水氨氮浓度呈显著正相关(<0.05),AOB基因丰度与间隙水亚硝酸盐氮浓度呈显著正相关(<0.05);AOA/AOB与间隙水硝酸盐氮呈显著正相关(<0.05);秋季AOA/AOB与氨氮呈显著负相关(<0.05).按照不同沉积物层数来分类,中层沉积物AOA基因丰度与间隙水氨氮浓度呈显著正相关(<0.05).按照不同子湖来分类,官桥湖AOA和AOB基因丰度均与间隙水氨氮和亚硝酸盐氮浓度呈极显著正相关(<0.01),AOB基因丰度与间隙水总氮浓度呈显著负相关(<0.05),AOA/AOB与氨氮呈显著正相关(<0.05).

表2 AOA和AOB amoA基因丰度与间隙水氮浓度皮尔逊相关系数
注:*<0.05 ; **<0.01.
3 讨论
AOA和AOB广泛生存于水生环境中, 氨氮作为氨氧化微生物的基质,与氨氧化微生物丰度关系密切[22].一般而言,在低氨的贫营养水体中,AOA占绝对优势[23],而AOB生长受到限制.适当提高氨氮浓度会提高AOA的生长速率[24].3个子湖间隙水中,官桥湖的氨氮要显著高于郭郑湖和牛巢湖,这很可能是官桥湖沉积物中AOA远高于其他2个子湖的原因.同时,3个子湖不同季节不同深度的沉积物中, AOA基因丰度高于AOB,可能是由于3个子湖间隙水的氨氮浓度为2.71~22.7mg/L,有利于AOA生存而限制AOB生长[25].因此推测东湖属于一个低氨氮环境,导致AOB生长受氨氮影响被抑制.AOA处于优势地位,表明AOA可能在东湖沉积物氨氧化过程中发挥着主要作用.湖泊沉积物生境较为复杂,也存在其他环境因子对氨氧化微生物分布有不同程度影响的可能性,在目前的研究中已发现NO3--N、NH4+-N、TOC 、TP、TN和pH值等因素对AOA基因丰度的影响较多,AOB基因丰度受NO3--N、NH4+-N和pH值的影响更多[22].
夏季AOA基因丰度与间隙水氨氮和亚硝酸盐氮浓度呈极显著正相关,冬季AOA基因丰度只与间隙水氨氮浓度呈显著正相关,原因可能是冬季温度低,AOA的代谢活性降低,较少的氨氮转化为亚硝酸盐氮,导致亚硝酸盐氮的浓度降低.夏冬季节AOB基因丰度与间隙水氨氮和亚硝酸盐氮浓度分别呈极显著正相关和显著正相关,表明温度变化对AOB的代谢活性影响不大.而在沉积物不同分层水平上,仅中层沉积物AOA基因丰度与间隙水氨氮浓度呈显著正相关,这可能与沉积物中溶解氧和有机质有关.对于不同子湖,官桥湖AOA和AOB基因丰度均与间隙水氨氮和亚硝酸盐氮浓度呈极显著正相关.3个子湖中官桥湖水质最差、富营养化最严重,可能是由于官桥湖间隙水的氨氮浓度适宜氨氧化微生物生长,而亚硝酸盐氮浓度对好氧氨氧化微生物无明显的抑制作用.
不同季节带来的温度差异会影响AOA和AOB基因丰度.在3个子湖表层和中层沉积物中,AOA基因丰度在夏季明显高于其他3个季节.这与Auguet等[26]人在研究高山湖泊中泉古菌分布规律时发现的AOA基因丰度在夏季最高,在春季和冬季均有下降趋势相一致. 在东湖表层沉积物中,AOB基因丰度在冬季显著低于其他3个季节,在春季显著高于其他3个季节.不同季节对于AOB基因丰度的影响因素可能在于温度的差异.温度是影响AOB分布的关键性因素,同时随着季节的变化,氨浓度和pH值也会改变,从而影响AOB的群落结构[27].Avrahamk等[28]人发现,在土壤中的湿度、氨氮和pH值处于稳定状态时,AOB基因丰度以及其硝化活性在15~25℃时最高.这与Godde等[29]研究的N2O释放率中温时低而低温时高的结论恰好相反,其原因可能在于两者所研究对象的营养水平不同.因此,在研究氨氧化微生物不同季节分布特征时,各种因素对其的影响情况不能一概而论,应结合实地水文、水质等情况深入研究.
普遍发现在空间垂直方向上,随着沉积物深度的增加,AOA与AOB基因丰度均有下降的趋势[16,30-32],本研究中AOA与AOB基因丰度在垂直方向上的变化趋势亦是如此,这可能与溶解氧浓度的变化有关.AOA和AOB均属于好氧型,随深度的增加,溶解氧浓度逐渐降低,基因丰度逐渐减少.在东湖沉积物中,AOA和AOB基因丰度都在0~1cm最高,在前3cm迅速下降,然后趋于平缓.这表明表层沉积物与上覆水氧气交换频繁,溶解氧浓度相对较高,该趋势与其他关于氨氧化微生物垂直分布的研究结论一致[33-34].对于同一季节,秋季的官桥湖和郭郑湖以及冬季的官桥湖沉积物中随着深度增加,AOA/AOB呈上升的趋势.这与AOA比AOB更适于厌氧浓度条件有关[35].亚硝酸盐氮作为氨氧化反应的产物,其浓度也会影响AOA和AOB基因丰度[36].本研究中发现AOA/AOB与硝酸盐氮呈显著负相关. AOA 广泛地分布于海洋、土壤、沉积物这样的中好氧到缺氧的环境中[37],相比于AOB, AOA更适应缺氧的环境,硝酸盐氮作为硝化反应的最终产物,其浓度一定程度上反映了氧气浓度的多少,硝化速率越低的区域其溶解氧一般越低,而AOA比AOB更耐低氧环境,所以硝酸盐氮越低的区域,其AOA/AOB反而较高.
湖泊沉积物中氮循环相关的微生物受多种环境因子的影响,比如溶解氧以及有机质含量.溶解氧会影响氨氧化微生物的丰度,进而影响间隙水氨氮的浓度;高的有机质含量会使异养细菌(如硝化细菌)的丰度增加,从而降低亚硝酸盐氮的浓度,减低亚硝酸盐氮对好氧氨氧化微生物的产物抑制作用.从而达到增加氨氧化微生物的氨氧化活性,降低氨氮浓度的目的.因此可以通过生物法如种植水生植物使溶解氧含量升高,以及向湖泊沉积物投加外源碳增加有机质含量等措施来实现定向促进氨氮向亚硝酸盐氮的转化.
4 结论
4.1 武汉东湖不同水层各营养盐(氮)浓度表现为间隙水>上覆水>表层水, 上覆水的总氮和氨氮浓度显著高于表层水,显示东湖沉积物相对于水体呈营养盐可释放状态.
4.2 武汉东湖沉积物中AOA基因丰度为4.50×105~4.99×108copies/g,AOB基因丰度为1.66×104~5.32×106copies/g,AOA/AOB基因丰度比为2~546,AOA可能在东湖沉积物氨氧化过程中发挥着主要作用.
4.3 AOA和AOB基因丰度随沉积物深度增加而降低.在夏季,AOA基因丰度在15cm以上的沉积物中下降速率更快,AOB基因丰度在15cm以上的沉积物中下降速率更快,其他3个季节普遍在前3cm快速下降,之后趋于平缓.
4.4 AOA基因丰度与间隙水氨氮和亚硝酸盐氮浓度呈显著正相关(<0.05);AOB基因丰度与间隙水亚硝酸盐氮浓度呈显著正相关(<0.05); AOA/AOB基因比值与间隙水硝酸盐氮呈显著负相关(<0.05).
[1] 朱元荣,张润宇,吴丰昌.滇池沉积物中氮的地球化学特征及其对水环境的影响 [J]. 中国环境科学, 2011,31(6):978-983. Zhu Y R, Zhang R Y, Wu F C. Geochemical characteristics and influence to overlying water of nitrogen in the sediments from Dianchi Lake [J]. China Environmental Science, 2011,31(6):978-983.
[2] 吉芳英,颜海波,何 强,等.龙景湖龙景沟汇水区沉积物-水界面氮形态空间分布特征 [J]. 中国环境科学, 2015,35(10):3101-3107. Ji F Y, Yan H B, He Q, et al. Distribution of nitrogen speciation at the sediment-water interface in Longjinggou Catchment Area of Longjinghu Lake [J]. China Environmental Science, 2015,35(10): 3101-3107.
[3] 刘正辉,李德豪.氨氧化古菌及其对氮循环贡献的研究进展[J]. 微生物学通报, 2015,42(4):774-782. Liu Z H, Li D H. Ammonia-oxidizing archaea and their contribution to global nitrogen cycling: a review [J]. Microbiology China, 2015, 42(4):774-782.
[4] 郭 佳.典型环境因子对硝化作用和氨氧化微生物生理生态的影响[D]. 重庆:西南大学, 2016. Guo J. The influence of typical environmental factors on nitrification and physiological ecology of ammonia-oxidazers [D]. Chongqing: Southwest University, 2016.
[5] 苏 瑜,王为东.我国北方四类土壤中氨氧化古菌和氨氧化细菌的活性及对氨氧化的贡献[J]. 环境科学学报, 2017,37(9):3519-3527. Su Y, Wang W D. Activity of AOA and AOB and their contributions to ammonia oxidization in four soils in North China [J]. Acta Scientiae Circumstantiae, 2017,37(9):3519-3527.
[6] Zheng Y L, Hou L J, Newell S, et al. Community Dynamics and Activity of Ammonia-oxidizing Prokaryotes in Intertidal Sediments of the Yangtze Estuary [J]. Applied Microbiology and Biotechnology, 2014,80(1):408-419.
[7] Liu S, Shen L D, Lou L P, et al. Spatial Distribution and Factors Shaping the Niche Segregation of Ammonia-Oxidizing Microorganisms in the Qiantang River, China [J]. Applied and Environmental Microbiology, 2013,79(13):4065-4071.
[8] Vissers E W, Anselmetti F S, Bodelier P L E, et al. Temporal and spatial coexistence of archaeal and bacterialgenes and gene transcripts in Lake Lucerne [J]. Achaea, 2013,2013(12):289478.
[9] Martens-Habbena W, Berube P M, Urakawa H, et al. Ammonia oxidation kinetics determine niche separation of nitrifying Archaea and Bacteria [J]. Nature, 2009,461(7266):976-979.
[10] Erguder T H, Boon N, Wittebolle L,et al. Environmental factors shaping the ecological niches of ammonia-oxidizing archaea [J]. FEMS Microbiology Reviews, 2009,33(5):855-869.
[11] Herrmann M, Saunders A M, Schramm A. Effect of lake trophic status and rooted macrophytes on community composition and abundance of ammonia-oxidizing prokaryotes in freshwater sediments [J]. Applied and Environmental Microbiology, 2009,75(10):3127-3136.
[12] Auguet J C, Triadó-Margarit X, Nomokonova N, et al. Vertical segregation and phylogenetic characterization of ammonia-oxidizing Archaea in a deep oligotrophic lake [J]. The ISME Journal, 2012,6(9): 1786-1797.
[13] Wu Y C, Xiang Y, Wang J J , et al. Heterogeneity of archaeal and bacterial ammonia-oxidizing communities in Lake Taihu, China [J]. Environmental Microbiology Reports, 2010,2(4):569-576.
[14] Hou J, Song C L, Cao X Y, et al. Shifts between ammonia-oxidizing bacteria and archaea in relation to nitrification potential across trophic gradients in two large Chinese lakes (Lake Taihu and Lake Chaohu) [J]. Water Research, 2013,47(7):2285-2296.
[15] Jiang H C, Dong H L, Yu B S,et al. Diversity and abundance of ammonia-oxidizing archaea and bacteria in Qinghai Lake, Northwestern China [J]. Geomicrobiology Journal, 2009,26(3): 199-211.
[16] 丁 浩,徐慧敏,苏 芮,等.若尔盖花湖沉积物氨氧化与反硝化功能基因丰度垂向分布特征及其环境响应[J]. 环境科学学报, 2019, 39(10):3482-3491. Ding H, Xu H M, Su R, et al. Vertical distribution and environmental response of the abundance of ammonia-oxidizing and denitrifying functional genes in sediments of Huahu Lake in Zoige [J]. Acta Scientiae Circumstantiae, 2019,39(10):3482-3491.
[17] 国家环境保护总局.水和废水监测分析方法 [M]. 北京:中国环境科学出版社, 2002:258-285. State Environmental Protection Administration. Water and Wastewater Monitoring and Analysis Methods [M]. Beijing:China Environmental Press, 2002:258-285.
[18] CJ/T 221-2005 城市污水处理厂污泥检验方法[S]. CJ/T 221-2005 Determination method for municipal sludge in wastewater treatment plant [S].
[19] 陆诗敏.淡水养殖池塘环境中氨氧化微生物的研究[D]. 武汉:华中农业大学, 2014. Lu S M. Study on the ammonia-oxidizing microorganisms in the freshwater aquaculture pond environment [D]. Wuhan;Huazhong Agricultural University, 2014.
[20] Jian Y, Jiang H, Dong H, et al.-encoding archaea and thaumarchaeol in the lakes on the northeastern Qinghai-Tibetan Plateau, China [J]. Frontiers in Microbiology, 2013,4(329):329.
[21] Ju X, Wu S, Huang X, et al. How the novel integration of electrolysis in tidal flow constructed wetlands intensifies nutrient removal and odor control [J]. Bioresour Technol, 2014,169:(605-613)
[22] 贾仲君,翁佳华,林先贵,等.氨氧化古菌的生态学研究进展[J]. 微生物学报, 2010,50(4):431-437. Jia Z G, Weng J H, Lin X G, et al. Microbial ecology of archaeal ammonia oxidation—A review [J]. Acta Microbiologica Sinica, 2010,50(4):431-437.
[23] Yang Y Y, Zhang J G, Zhao Q, et al. Sediment Ammonia-Oxidizing Microorganisms in Two Plateau Freshwater Lakes at Different Trophic States. [J]. Microbial ecology, 2016,71(2):257-265.
[24] 王 萃.密云水库库滨区土壤和底泥中氨氧化微生物的群落特征及与环境因子的响应关系[D]. 北京:首都师范大学, 2014. Wang C. Community characteristics of ammonia-oxidizing microorganisms and their response to environmental factors in soil and sediment of Miyun Reservoir riparian area [D]. Beijing: Capital Normal University, 2014.
[25] 周磊榴,祝贵兵,王衫允.洞庭湖岸边带沉积物氨氧化古菌的丰度、多样性及对氨氧化的贡献[J]. 环境科学学报, 2013,33(6):41-47. Zhou L L, Zhu G B, Wang S Y. Abundance, biodiversity and contribution to ammonia oxidization of ammonia-oxidizing archaea in littoral sediments of Dongting Lake [J]. Acta Scientiae Circumstantiae, 2013,33(6):41-47.
[26] Auguet J C, Casamayor E O. A hotspot for cold crenarchaeota in the neuston of high mountain lakes [J]. Environmental Microbiology, 2008,10(4):1080-1086.
[27] 董莲华,杨金水,袁红莉.氨氧化细菌的分子生态学研究进展[J]. 应用生态学报, 2008,19(6):81-85. Dong L H, Yang J S, Yuan H L. Research progress in molecular ecology of ammonia-oxidizing bacteria [J]. Chinese Journal of Applied Ecology, 2008,19(6):81-85.
[28] Avrahamk S, Liesack W, Conrad R. Effects of temperature and fertilizer on activity and community structure of soil ammonia oxidizers [J]. Environmental Microbiology, 2003,5(8):691–705.
[29] Godde M, Conrad R. Immediate and adaptational temperature effects on nitric oxide production and nitrous oxide release from nitrification and denitrification in two soils [J]. Biology & Fertility of Soils, 1999,30(1/2):33-40.
[30] Lipsewers Y A, Hopmans E C, Meysman F J R, et al. Abundance and Diversity of Denitrifying and Anammox Bacteria in Seasonally Hypoxic and Sulfidic Sediments of the Saline Lake Grevelingen. [J]. Frontiers in microbiology, 2016,7(1661):1-15.
[31] Mylène H, Sandrine E, Antoine B, et al. Dynamics of ammonia- oxidizing Archaea and Bacteria in contrasted freshwater ecosystems [J]. Research in Microbiology, 2013,164(4).
[32] 郑鹏飞,张晓黎,龚 骏.大叶藻(Zostera marina)海草床沉积物细菌和古菌丰度及组成的垂直剖面特征[J]. 微生物学通报, 2020,47(6): 1662-1674. Zheng P F, Zhang X L, Gong J. Vertical patterns of bacterial and archaeal abundance and community Vertical patterns of bacterial and archaeal abundance and community [J]. Microbiology China, 2020, 47(6):1662-1674.
[33] 古小治,张启超,孙淑雲,等.富氧-缺氧过程对氧气分布及交换过程影响[J]. 中国环境科学, 2015,35(5):1495-1501. Gu X Z, Zhang Q C, Sun S Y, et al. Influence of anaerobic and aerobic processes on bottom oxygen dynamic and exchange process across sedimentwater interface [J]. china environmental science, 2015,35(5): 1495-1501.
[34] 于少兰,乔延路,韩彦琼,等.好氧氨氧化微生物系统发育及生理生态学差异[J]. 微生物学通报, 2015,42(12):2457-2465. Yu S L, Qiao Y L, Han Y Q, et al. Differences between ammonia- oxidizing microorganisms in phylogeny andphysiological ecology [J]. Microbiology China, 2015,42(12):2457-2465.
[35] Abell G C, Banks J, Ross D J, et al. Effects of estuarine sediment hypoxia on nitrogen fluxes and ammonia oxidizer gene transcription [J]. Fems Microbiology Ecology, 2011,75(1):111-122.
[36] 鲍林林,陈永娟,王晓燕.北运河沉积物中氨氧化微生物的群落特征[J]. 中国环境科学, 2015,35(1):179-189. Bao L L, Chen Y J, Wang X Y. Diversity and abundance of ammonia-oxidizing prokaryotes in surface sediments in Beiyun River [J]. china environmental science, 2015,35(1):179-189.
[37] Wang X L, Han C, Zhang J B, et al. Longterm fertilization effects on active ammonia oxidizers in an acid upland soil in China [J] Soil Biologyand Biochemistry, 2015,84:28-37.
Spatiotemporal distribution of aerobic ammonia-oxidizing microorganisms in sediments of Lake Donghu, Wuhan.
ZHANG Zhi-zhong1,2, CHENG De-xi1, LIAO Ming-jun1,2, WANG Shu-lian1, LI Zhu1,2*
(1.School of Civil Engineering, Architecture and Environment, Hubei University of Technology, Wuhan 430068, China;2.Hubei Key Laboratory of Ecological Remediation for Rivers-Lakes and Algal Utilization, Wuhan 430068, China)., 2021,41(4):1917~1924
Thegene abundances of ammonia-oxidizing archaea (AOA-) and bacteria (AOB-) in the sediments of Lake Donghu, Wuhan, was determined by the real-time quantitative polymerase chain reaction (qPCR). Moreover, the influence of nitrogen content on the temporal and spatial distribution of AOA and AOB was analyzed. The results showed that the abundance of AOA-was higher than that of AOB-, indicating greater contribution of AOA-to the ammonia oxidation process. Meanwhile, the abundances of AOA-and AOB-decreased with elevated sediment depth. In addition, the concentrations of total nitrogen (TN), ammonia nitrogen (NH4+-N), nitrate nitrogen (NO3--N) and nitrite nitrogen (NO2--N) in interstitial water were 6.28~33.56, 2.71~22.7, 0.12~0.98 and 0.01~0.13mg/L, respectively. The average concentrations of TN, NH4+-N, NO3--N and NO2--N in overlying water were 1.68, 0.79, 0.16 and 0.04mg/L, respectively, while in surface water were 1.34, 0.62, 0.11 and 0.03mg/L, respectively. These results suggested that the sediments of Lake Donghu were important sources of nutrient. In addition, the abundance of AOA-was positively correlated with the concentrations of NH4+-N and NO2--N in interstitial water (<0.05), while the abundance of AOB-was positively correlated with the concentration of NO2--N in interstitial water (<0.05).
qPCR;sediment;ammoxidation archaea;ammonia oxidizing bacteria;abundance
X524
A
1000-6923(2021)04-1917-08
张志忠(1996-),男,湖北仙桃人,湖北工业大学硕士研究生,主要研究方向环境微生物生态.发表论文1篇.
2020-08-24
国家自然科学基金资助项目(51579092,51879099);国家重点基础研究项目(2016YFC0401702);广东省水利科技创新项目(2017—14)
*责任作者, 副教授, iamlizhu@163.com
