富炭硅肥对水稻土铁还原菌群落特征的影响
2021-04-30林美芬王晓彤许旭萍王维奇
林美芬,郑 毅*,王晓彤,许旭萍**,王维奇
富炭硅肥对水稻土铁还原菌群落特征的影响
林美芬1,郑 毅1*,王晓彤1,许旭萍1**,王维奇2,3
(1.福建师范大学生命科学学院,福建 福州 350117;2.福建师范大学地理研究所,福建 福州 350007;3.福建师范大学湿润亚热带生态地理过程教育部重点实验室,福建 福州 350007)
为了探究富炭硅肥施加处理对稻田土壤铁还原菌相对丰度、多样性及群落结构的影响,以福州平原稻田为研究对象,分别设置对照组及3种不同剂量(300,600和900kg/hm2)富炭硅肥施加处理组.研究结果表明:施加富炭硅肥有助于土壤铁还原菌的生长和繁殖,其中600kg/hm2施加处理对铁还原菌的生长影响最为显著(<0.05).由Shannon指数可知,3种施加处理均使晚稻拔节期土壤铁还原菌多样性有所下降,以300kg/hm2施加处理组多样性指数降低最为明显,较对照组降低了29.4%.在早、晚稻拔节期土壤中共鉴定出5个菌门,其中变形菌门(Proteobacteria)、拟杆菌门(Bacteroidetes)和厚壁菌门(Firmicutes)的占比之和平均高达95%以上,是稻田土壤中的优势菌门.施加富炭硅肥后,早稻拔节期土壤中拟杆菌属()的相对丰度显著提高(<0.05),而厌氧粘细菌属()的相对丰度则有所降低.此外,环境因子与稻田土壤铁还原菌的相对丰度具有相关性,的相对丰度与土壤pH值呈显著正相关(<0.05),的相对丰度与土壤温度(ST)呈显著正相关(<0.05).
富炭硅肥;铁还原菌;多样性;群落结构;稻田
稻田土壤是温室气体的主要来源,对全球农业生产和生态环境功能维持具有重要意义,其周期性的干湿交替会产生氧化还原反应,影响各种具有氧化还原活性的元素进行生物地球化学循环元素.其中异化Fe(Ⅲ)还原就是发生在厌氧沉积物及淹水稻田中重要的微生物学过程,是多种细菌和古菌在厌氧条件下以有机物为电子供体,Fe(Ⅲ)为呼吸链末端电子受体,在氧化有机物质的过程中将电子传递给Fe(Ⅲ),从而对生物地球化学过程产生影响[1-3].有研究表明,Fe(Ⅲ)氧化物是水稻土中含量最丰富的氧化物,可通过异化Fe(Ⅲ)还原促进铁还原菌对不稳定可溶性有机物(DOM)的生物修饰和矿化作用来驱动水稻土的碳循环,减少气态碳的排放和DOM的化学多样性[4].铁还原菌也可以利用产甲烷菌常用的电子供体(如乙酸、氢气)还原Fe(Ⅲ),在铁还原菌和产甲烷菌同时存在的环境中,二者会由于竞争电子供体而抑制甲烷的产生与排放[5].由此可知,微生物铁还原在稻田温室气体产生与排放、物质循环与肥力演变等过程中发挥重要作用.
随着我国经济快速发展及环境与资源问题日益突出,工、农业废弃物处理还田再利用成为目前国内外的研究热点.生物炭作为有效的土壤改良剂,施加于旱地土壤中,可以增加土壤的持水性和孔隙度,促进植物根系的生长[6].黄超等[7]研究表明红壤施用生物炭能明显提高土壤水稳定性团聚体数量,增强土壤保肥能力,降低土壤容重.许多研究也表明,生物炭能够调节土壤pH值并提高土壤肥力[8],增加农作物产量[9],同时还可以改善土壤理化性质[10],促进微生物生长[11].此外,Wang等[12]研究发现,工业废弃物炉渣能够有效降低CH4的排放,提高稻田土壤碳的固存,从而提高水稻产量.Ali等[13]也证实了钢铁炉渣施加于稻田能够有效减缓CH4的产生与排放,同时还能改善土壤环境,增加土壤养分含量并提高稻田生产力.目前,大多数研究主要集中在探究废弃物对土壤理化性质及减排效应的影响,而忽略了铁还原菌在控制水稻土碳循环的过程中发挥的重要作用及其参与介导的异化铁还原过程与水稻土中有机质分解的密切关系.因此,研究工、农业废弃物对稻田土壤中铁还原菌多样性及群落结构的影响具有深远意义.
前期研究证实了炉渣与生物炭的施加在处理工、农业废弃物的同时,能够有效提高稻田土壤碳固持并减少温室气体排放[14-15],更进一步探究了其对土壤铁还原菌群落结构及铁代谢活性等产生的影响[16].但是,由于生物炭质量较轻,施加于土壤中易随水分流失,因此前期自主研发以废弃物为原料的土壤改良剂——将生物炭和炉渣进行复合造粒制成富炭硅肥.本文以福州平原稻田为研究对象,借助高通量测序平台,分析比较不同施加量富炭硅肥处理对稻田土壤铁还原菌丰度、多样性及群落结构组成的影响,以及稻田土壤环境因子与铁还原菌群落结构的相关性,旨在探究富炭硅肥对稻田土壤铁还原菌的影响机制,为工、农业废弃物再利用提供依据,并为富炭硅肥应用于稻田提供理论支持.
1 研究区与研究方法
1.1 研究区概况
本实验于福建省仓山区农科院水稻研究所吴凤综合实验基地(26.1°N,119.3°E)内进行,该实验基地共有红壤稻田7hm2,区内实行早稻-晚稻-蔬菜的轮作制度.水稻生长前期采用水淹管理的传统灌溉方式,分蘖期后实行淹水-烤田-湿润灌溉相结合的方式,实验前对土壤进行人工整平,以确保土壤的均一性.该实验地区位于闽江河口区福州平原的南分支,属于亚热带海洋性季风气候,其气候条件、降水量、地形地貌及土壤理化性质等均可参见文献[17].
1.2 施加物与施加方式
本实验于2018年在水稻田内分别设置300, 600和900kg/hm2的富炭硅肥施加处理组,以无施加处理为对照组,水稻种植密度为20穴/m2.施加物是本文以废弃物为原料自主研制的富炭硅肥,主要成分为C(5.54%)、N(0.52%)、P(0.48%)、K(0.53%)、Ca(16%)、Mg(2.81%)、Fe(0.78%)、S(0.21%)和Si(14%),pH值为(8.93±0.03).对照及各施加处理分别设置3个重复,每个重复均分割成一个面积为10m2的小区块,共有12个小区块,随机区组排列.各小区块之间用0.5cm厚、30cm高的PVC板隔开,以免相互干扰.富炭硅肥于早、晚稻秧苗移栽前各施加一次,对照组不予施加.除此之外,本研究施加的主要肥料是复合肥(N-P2O5- K2O=16-16-16)和尿素(46% N),具体施加时间和施加方式可参照Wang等[18].
1.3 试验时间与土壤样品的采集
早稻生长时间为2018年4月18日~7月6日,晚稻生长时间为2018年8月1日~11月8日.由于拔节期的淹水状态可为铁还原菌提供一个较为适宜的生长环境,本研究分别于早、晚稻拔节期用小型土壤采样器进行土壤样品采集(早稻拔节期采样时间为2018年6月2日,晚稻拔节期采样时间为2018年9月19日),采集样品为深度0~15cm的表层土壤,剔除样品中的植物残根和石砾后,放入冰盒中带回实验室.将每个样品分成3份,一部分鲜土用于土壤铁还原菌数量的测定;一部分置于-20℃冰箱中保存,以便用于土壤微生物基因组的提取与分析;另一部分自然风干、研磨过筛后,用于土壤理化指标的测定.
1.4 土壤样品理化性质的测定
土壤容重(BW)采用环刀法测定[19];含水量(WC)采用烘干称重法测定[19];电导率(EC)和土壤温度(ST)采用2265SF电导/温度计测定,并以电导率表征土壤盐度;土壤pH值采用水土质量比为5:1,摇床振荡30min,静置后用PHS-3CpH计测定.
1.5 土壤铁还原菌数量的测定——最大或然数法
称取5g土样加入盛有45mL无菌超纯水的三角瓶中,充分振荡10min,此即为10-1浓度的土壤悬液,然后进行一系列10倍稀释,制成10-2~10-7浓度的土壤悬液.取最后5个稀释度的土壤悬液各1mL,接种到装有铁还原菌培养液的试管中,每一稀释度做3个重复.接种后置于30℃培养10d(不接种的对照管同时培养),观察培养液的颜色,培养液颜色由红褐色变为浅绿色或无色,则记为铁还原菌阳性管.最后根据不同稀释度出现的阳性管数确定数量指标,查“最大或然数法则统计表,MPN表”得到菌数近似值,并根据菌数计算公式计算结果[19].
1.6 土壤铁还原菌群落组成分析
本研究的铁还原菌门、属的分类数据是借助Illumina HiSeq高通量测序平台对实验项目的土壤样品基因组16S rRNA基因中的V3~V4可变区域进行测序分析,再与NCBI数据库进行比对,从中筛选出已知的铁还原菌[16],并对其进行重分析,最终得到铁还原菌的多样性及群落结构组成结果.
1.6.1 基因组DNA的提取与PCR扩增 采用CTAB(十六烷基三甲基溴化铵)方法对土壤样品的基因组DNA进行提取后,利用琼脂糖凝胶电泳检测DNA的纯度和浓度,取适量样品DNA于离心管中,使用无菌水稀释样品至1ng/μL.以稀释后的基因组DNA为模板,使用带Barcode的特异引物,New England Biolabs公司的Phusion® High-Fidelity PCR Master Mix with GC Buffer和高效高保真酶进行PCR,确保扩增效率和准确性.PCR扩增引物为341F (CCTAYGGGRBGCASCAG)和806R(GGACTACN NGGGTATCTA AT).
1.6.2 PCR产物的混样与纯化 PCR产物使用2%浓度的琼脂糖凝胶进行电泳检测40min;根据PCR产物浓度进行等量混样,充分混匀后使用1×TAE浓度2%的琼脂糖凝胶电泳纯化PCR产物,剪切回收目标条带.产物纯化试剂盒使用的是Thermo Scientific公司GeneJET胶回收试剂盒回收产物.
1.6.3 文库构建与上机测序 使用Thermofisher公司的Ion Plus Fragment Library Kit 48rxns建库试剂盒进行文库的构建,构建好的文库经过Qubit定量和文库检测合格后,使用Thermofisher的Ion S5TMXL进行上机测序.
1.7 数据处理
应用Excel 2016和SPSS 21统计分析软件对测定数据进行整理分析,利用Origin 8软件进行绘图;通过Uparse软件对所有样品的全部Clean Reads进行聚类,以97%的一致性将序列聚类成为OTUs;使用QIIME软件(Version 1.9.1)计算土壤铁还原菌的Alpha多样性指数;利用Canoca软件进行PCA和CCA分析;使用R软件(Version 2.15.3)对土壤环境影响因子与铁还原菌群落结构的关系进行Spearman相关性分析.
2 结果与分析
2.1 富炭硅肥施加对稻田土壤理化性质的影响
注:EJC:早稻拔节期对照组;EJ300:早稻拔节期300kg/hm2施加处理组;EJ600:早稻拔节期600kg/hm2施加处理组;EJ900:早稻拔节期900kg/hm2施加处理组;LJC:晚稻拔节期对照组;LJ300:晚稻拔节期300kg/hm2施加处理组;LJ600:晚稻拔节期600kg/hm2施加处理组;LJ900:晚稻拔节期900kg/hm2施加处理组;同列不同字母表示同一指标不同处理之间具有显著差异(ABCD表示早稻,abcd表示晚稻,<0.05,下同).
如表1所示,与对照组相比,早、晚稻3种施加处理均在不同程度上提高了土壤pH值.在早稻土壤中,600kg/hm2施加处理使土壤pH值较对照显著提高了2.1%(<0.05);在晚稻土壤中,300和900kg/ hm2施加处理分别使土壤pH值较对照显著提高了5.3%和8.9%(<0.05).此外,早、晚稻拔节期土壤的BW、WC、EC和ST等环境因子与对照组相比虽有所波动,但变化均不显著(0.05),说明富炭硅肥施加处理并未对稻田土壤的BW、WC、EC和ST等造成显著影响.
2.2 富炭硅肥施加对稻田土壤铁还原菌数量的影响
如图1所示,晚稻3种处理及对照土壤中铁还原菌数量均高于早稻.在早稻拔节期中,对照组及300,600,900kg/hm2富炭硅肥施加处理组土壤铁还原菌数量分别为1.67´105,2.16´105,2.12´105,1.16´105MPN/g,与对照组相比,300和600kg/hm2施加处理均使土壤铁还原菌数量显著升高(<0.05),而900kg/hm2施加处理使土壤铁还原菌数量显著降低(<0.05).在晚稻拔节期中,对照组及300,600, 900kg/hm2富炭硅肥施加处理组土壤铁还原菌数量分别为2.55´105,3.43´105,5.32´105,3.23´105MPN/g,与对照组相比,3种施加处理均使土壤铁还原菌数量显著升高(<0.05),其中600kg/hm2施加处理对铁还原菌数量影响最为明显,较对照组提高了108.6%.由此可知,富炭硅肥施加有助于铁还原菌的生长和繁殖,且当施加量为600kg/hm2时最有利于土壤铁还原菌的生长.
2.3 富炭硅肥施加对稻田土壤铁还原菌多样性的影响

图1 富炭硅肥施加对稻田土壤铁还原菌数量的影响
如表2所示,早、晚稻8个土壤样品经高通量测序以97%的一致性进行OTUs聚类,共有437个铁还原菌OTUs.各样品文库的Coverage(覆盖率)范围为95.5%~98.7%,说明土壤样品中基因序列被检出的概率较高,测序深度足够,可以真实反映稻田土壤铁还原菌群落的真实情况.
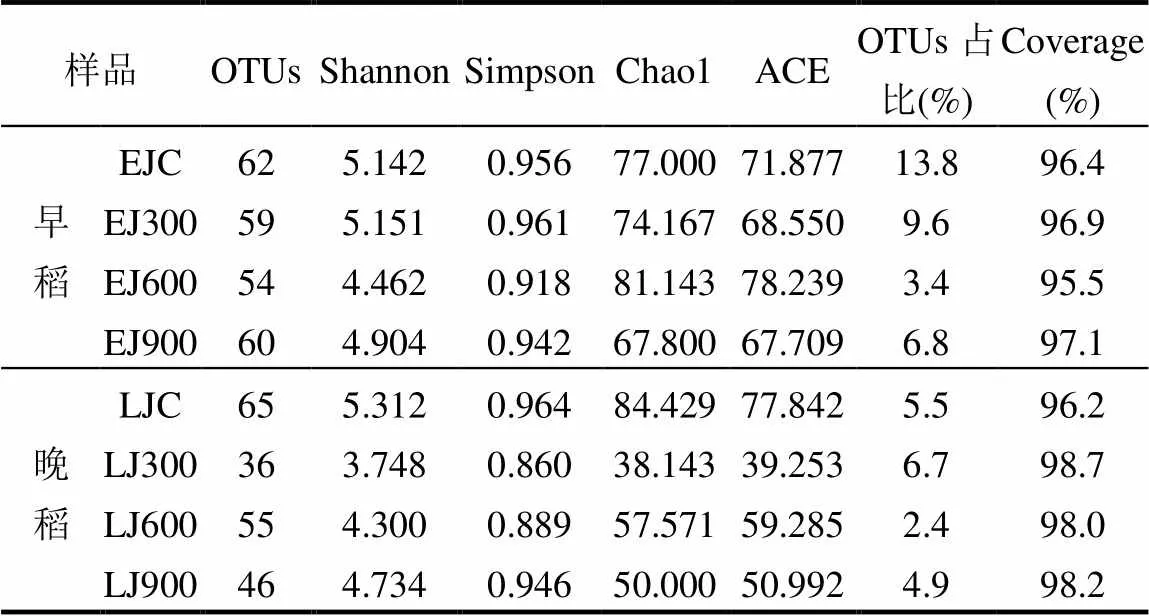
表2 不同施加处理条件下稻田土壤铁还原菌多样性指数
注:OTUs占比指的是铁还原菌OTU数目占总OTU数目的比值.
Shannon指数和Simpson指数均是用来估算样品中微生物的多样性指数,其指数值越大,则样品中群落多样性越高.由Shannon指数可知(表2),早稻拔节期中300kg/hm2施加处理略微提高了土壤铁还原菌多样性,而600和900kg/hm2施加处理使土壤铁还原菌多样性相比于对照均略微降低;晚稻拔节期中3种施加处理均使土壤铁还原菌多样性在一定程度上有所下降,其中300kg/hm2施加处理组多样性指数降低最为明显,较对照降低了29.4%.Chao1指数和ACE指数均可用来评估样品中微生物的群落丰度.以Chao1指数为例,Chao1指数在生态学中常用来估算物种总数,其指数值越高,群落中含有的OTU数目越多,群落丰度也就越高.早稻拔节期600kg/hm2施加处理提高了土壤铁还原菌的群落丰度,较对照提高了5.4%;而晚稻拔节期3种施加处理均降低了土壤铁还原菌的群落丰度,其中600kg/hm2施加处理组的群落丰度高于其它两种施加处理.
2.4 富炭硅肥施加对稻田土壤铁还原菌OTU分布的影响
通过Venn图可分析出多个样品中所共有和特有的OTU数目,能够较直观的比较出早、晚稻施加处理组与对照组样品OTU组成的相似性和差异性.由图2(a)可知,早稻拔节期对照组,300,600和900kg/hm2施加处理组特有的OTUs分别为1、7、5和4个,3个处理组与对照组共有的OTUs为31个;从图2(b)可以看出,晚稻拔节期对照组,300,600和900kg/hm2施加处理组特有的OTUs分别为7、5、6和6个,3个处理组与对照组共有的OTUs为15个.早稻土壤样品中,300kg/hm2施加处理组所特有的OTUs最多;而晚稻土壤样品中,对照组所特有的OTUs最多,这一结果与Shannon指数相吻合,说明在不同施加量富炭硅肥处理条件下,早、晚稻土壤中的铁还原菌均出现了新菌型,分析其原因可能是由于土壤中某些原有的铁还原菌因其相对丰度发生改变而被检测出来,从而影响土壤铁还原菌群落组成.

2.5 富炭硅肥施加对稻田土壤铁还原菌群落组成的影响
2.5.1 稻田土壤门水平的铁还原菌群落组成 如图3(a)所示,在早、晚稻拔节期土壤中共鉴定出5个菌门的铁还原细菌,其相对丰度分别为:变形菌门(Proteobacteria)占32.81%~80.58%、拟杆菌门(Bacteroidetes)占0.89%~62.05%、厚壁菌门(Firmicutes)占1.34%~31.70%、酸杆菌门(Acidobacteria)占0~ 0.89%和unidentified Bacteria 占0~0.67%.在8个土壤样品中变形菌门(Proteobacteria)、拟杆菌门(Bacteroidetes)和厚壁菌门(Firmicutes)的铁还原细菌占比之和平均高达95%以上,是早、晚稻拔节期土壤中优势菌门的铁还原细菌.
在早稻拔节期,与对照组相比,施加处理组土壤中拟杆菌门(Bacteroidetes)的相对丰度均有所提高,而变形菌门(Proteobacteria)的相对丰度均有不同程度的降低,此外在施加处理组土壤中新增了酸杆菌门(Acidobacteria)和其它新的未知菌门.晚稻300kg/hm2施加处理组(LJ300)土壤中拟杆菌门(Bacteroidetes)的相对丰度从15.4%下降到0.9%,而厚壁菌门(Firmicutes)的相对丰度从3.1%提高到31.7%;晚稻其它施加处理土壤中变形菌门(Proteobacteria)和拟杆菌门(Bacteroidetes)相对丰度的变化趋势与早稻一致.从门水平来看,不同施加量富炭硅肥处理对稻田土壤中变形菌门(Proteobacteria)、拟杆菌门(Bacteroidetes)和厚壁菌门(Firmicutes)的相对丰度影响较大,而对铁还原菌群落组成的影响较小.
2.5.2 稻田土壤属水平的铁还原菌群落组成 如图3(b)所示,8个土壤样品中共鉴定出18个铁还原菌属,其中相对丰度排列前10位的属占总菌属的89.51%~100.00%,分别为拟杆菌属()、厌氧粘细菌属()、芽孢杆菌属()、地杆菌属()、气单胞菌属()、硫杆菌属()、假单胞菌属()、地温杆菌属()、脱硫微菌属()、红杆菌属().其中拟杆菌属()、厌氧粘细菌属()和芽孢杆菌属()相对丰度较高,是福州平原稻田土壤中的优势铁还原菌属.
在早稻拔节期土壤中施加处理组与对照组相比,拟杆菌属()相对丰度均有不同程度的升高,而厌氧粘细菌属()相对丰度均有所降低;晚稻拔节期300kg/hm2施加处理组(LJ300)与对照组相比,拟杆菌属()相对丰度从15.40%下降到0.89%,而厌氧粘细菌属()和芽孢杆菌属()相对丰度大幅度升高,分别升高33.93%、28.58%;晚稻其它施加处理组中拟杆菌属()和厌氧粘细菌属()相对丰度变化趋势与早稻一致.早、晚稻土壤施加处理较对照均有新的铁还原菌属出现,也有铁还原菌属消失,如地发菌属()和脱硫杆菌属().由此可知,不同施加量富炭硅肥处理对稻田土壤铁还原菌的相对丰度和群落组成均有不同程度的影响.

2.6 富炭硅肥施加对稻田土壤铁还原菌属水平分布的影响
为进一步探究早、晚稻土壤在不同施加量富炭硅肥处理条件下铁还原菌属水平优势菌属的差异,根据所有样本在属水平的物种注释及丰度信息,选取丰度排名前35的属,从物种和样本两个层面进行聚类,绘制成热图(图4),便于发现不同菌属在不同处理样本中的聚集程度.
如图4所示,在早、晚稻拔节期土壤中,早稻对照组(EJC)的优势菌属为等,早稻300kg/hm2施加处理组(EJ300)的优势菌属为等,早稻600kg/hm2施加处理组(EJ600)的优势菌属为、等,早稻900kg/hm2施加处理组(EJ900)的优势菌属为等;晚稻对照组(LJC)的优势菌属为等,晚稻300kg/hm2施加处理组(LJ300)的优势菌属为,晚稻600kg/hm2施加处理组(LJ600)的优势菌属为等,晚稻900kg/hm2施加处理组(LJ900)的优势菌属为等.由此可知,早、晚稻拔节期各个样品处理之间土壤铁还原菌优势菌属差异较大,不同菌属在不同样品中的相对丰度也存在一定差异,说明富炭硅肥施加处理对土壤微生物的生存环境造成影响,进而导致稻田土壤中铁还原菌优势菌属发生改变.
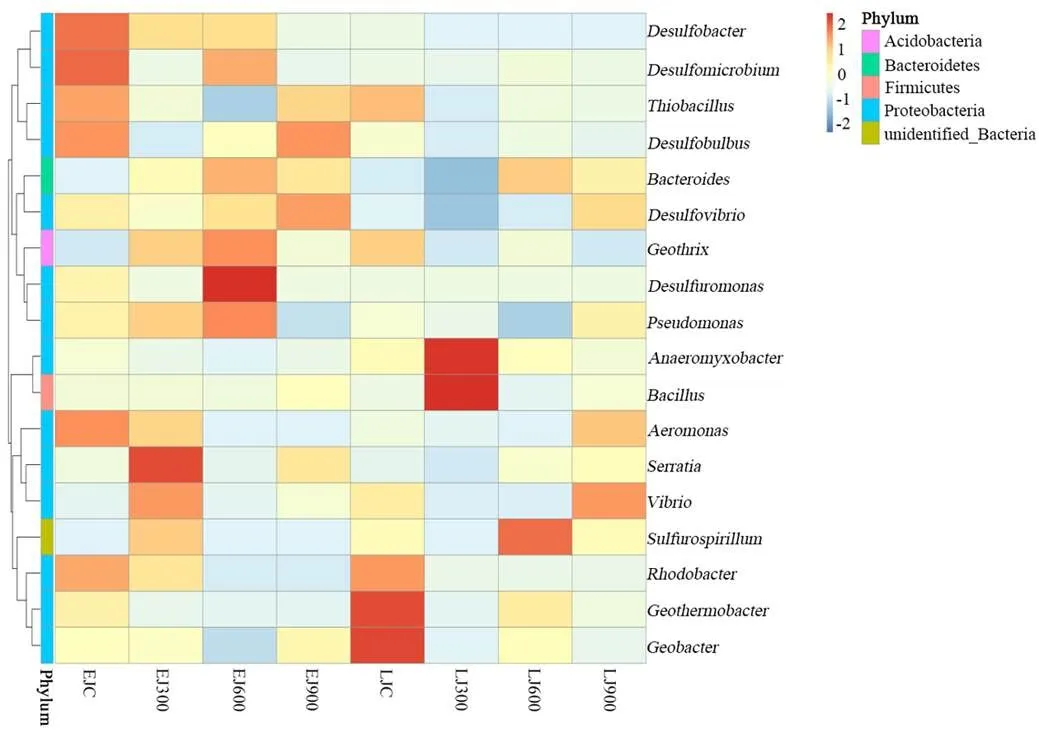
图4 不同施加处理下稻田土壤铁还原菌属相对丰度聚类热图
2.7 富炭硅肥施加对稻田土壤铁还原菌群落结构主成分的影响
为了能够更加直观的分析不同施加量富炭硅肥对稻田土壤铁还原菌群落结构间造成的差异性,绘制了基于OTU水平的PCA分析图(图5).
如图5所示,早、晚稻土壤选择前两个主成分(PC1和PC2)进行分析,第1主成分对样本差异的贡献值为24.34%,第2主成分对样本差异的贡献值为19.45%,说明这两个主成分是造成稻田土壤铁还原菌群落结构差异的主要因素.早、晚稻各处理样品代表的点在空间上均具有一定的距离.EJC组与EJ300、EJ900组点距离较近,与EJ600组点距离最远,说明早稻300、900kg/hm2施加处理与对照的土壤铁还原菌群落结构相似,而600kg/hm2施加处理对土壤铁还原菌群落结构的影响最为显著;LJC组与LJ600、LJ900组点距离较近,而与LJ300组点距离最远,说明晚稻600、900kg/hm2施加处理与对照的土壤铁还原菌群落结构相似,而300kg/hm2施加处理对土壤铁还原菌群落结构的影响最为明显.综上所述,不同施加量富炭硅肥处理都会对稻田土壤铁还原菌群落结构造成影响,但不同稻季的土壤铁还原菌对富炭硅肥的响应有所不同.

图5 不同施加处理下稻田土壤铁还原菌群落结构PCA分析
2.8 稻田土壤环境因子与铁还原菌群落结构的相关性分析
2.8.1 Spearman 相关性分析 用Spearman相关性分析来研究稻田土壤环境因子与微生物物种及其丰度之间的相互变化关系,得到两两之间的相关性和显著性值.如图6可知,的相对丰度与WC呈极显著负相关(<0.01),与BW呈极显著正相关(<0.01),与ST呈显著负相关(0.05);的相对丰度与土壤pH值呈显著正相关(<0.05);的相对丰度与EC呈显著正相关(0.05);的相对丰度与ST呈显著正相关(<0.05).以上结果分析说明,环境因子与土壤铁还原菌的相对丰度具有相关性,环境因子的改变能够使稻田土壤中某些铁还原菌属的相对丰度发生改变.

图6 Spearman 相关性分析热图
横向为环境因子信息,纵向为物种信息,中间热图对应的值为Spearman相关系数,介于-1,1之间,<0为负相关,>0为正相关,*<0.05,**<0.01
2.8.2 CCA分析 CCA分析主要用来反映菌群与环境因子之间的关系,可以检测环境因子、样本、菌群三者之间的关系或者两两之间的关系,可得到影响样本分布的重要环境驱动因子.由图7可知早稻对照组(EJC)和300,600kg/hm2处理组(EJ300、EJ600)点距离较近,群落结构差异较小,因此这3个样本土壤铁还原菌群落结构与环境因子的相关性也较为一致;而早稻900kg/hm2处理组(EJ900)点距离最远,其与WC和ST呈正相关,与BW、EC及pH值呈负相关,这与其他3个样本的相关性相反.和与WC、ST之间的角度均为锐角,说明这3个菌属的相对丰度与环境因子WC、ST呈正相关;同时可以看出和这3个菌属与晚稻对照组(LJC)铁还原菌群落结构呈正相关,而正是晚稻对照组(LJC)土壤的优势菌属.因此,由以上分析结果可知富炭硅肥能够通过改变土壤理化性质,影响土壤中某些优势菌属的相对丰度,进一步对稻田土壤铁还原菌群落结构造成影响,而这一系列的影响机制同时受到水稻不同生长时间和气候条件的影响与调控.

图7 CCA分析
3 讨论
3.1 富炭硅肥施加处理对稻田土壤铁还原菌数量的影响
本文研究土样采自早、晚稻拔节期,此时稻田正处于淹水阶段,水稻生长旺盛,根系分泌出大量的营养物质可供微生物利用,有利于微生物生长繁殖[20].此外,本研究稻田土壤中施加的富炭硅肥主要成分为生物炭和炉渣,有研究表明生物炭因其疏松多孔状结构,施加于土壤中能够贮存更多养分,为微生物群落的生长提供充足的营养物质,同时可避免外界不良因素对微生物造成干扰与毒害,从而提高微生物数量和活力[21-22].而炉渣中含有大量的微量元素和矿物质,植物生长消耗土壤中大量的营养物质,炉渣的施加可补充土壤中硅、钙、镁和铁等营养元素,进而促进微生物生长[12,23].通过不同剂量富炭硅肥施加处理发现,300和600kg/hm2施加处理使早稻土壤铁还原菌数量显著升高(<0.05);晚稻3种施加处理均使土壤铁还原菌数量显著升高(<0.05),其中600kg/hm2施加处理组升高最为显著,这表明富炭硅肥能够提供充足的营养物质,促进铁还原菌的生长和繁殖,同时为铁还原菌的生存提供一个良好的微环境.
3.2 富炭硅肥施加处理对稻田土壤铁还原菌多样性的影响
土壤微生物多样性和丰度的增加对提高水稻土生态功能的稳定和健康具有重要意义[24].富炭硅肥是由生物炭和炉渣混合造粒制作而成的肥料,其中生物炭在土壤中施用具有多重效应,如改善土壤理化性质和土壤微生物生境、提供营养物质、增加土壤有机碳含量、减少温室气体排放等[25-27].此外,生物炭施用还能显著影响微生物的群落结构和活性[28-29].本研究发现,早、晚稻土壤铁还原菌对不同施加量富炭硅肥处理具有不同响应.由Shannon指数和Chao1指数可知,早稻拔节期中300kg/hm2施加处理略微提高了土壤铁还原菌群落多样性,600kg/ hm2施加处理提高了土壤铁还原菌群落丰度,这一结果表明富炭硅肥施加改变了微生物生存环境并为其提供了丰富的营养物质,进而提高稻田土壤铁还原菌多样性及丰度,有助于稳定稻田生态系统.但晚稻与早稻恰好相反,3种施加处理均使土壤铁还原菌群落多样性及丰度有所降低,其中300kg/hm2施加处理组多样性指数降低最为明显,这一现象可能与微生物对营养物质的竞争作用以及早、晚稻不同生长时间和气候条件有关.
营养竞争是发生在生活于同一生态位、生理学需求相同的微生物之间的普遍现象,它们以此调节不同种群的数量,尤其是在营养成分有限的环境中更为明显[30].另有研究表明,养分的投入促进微生物的生长和多样性的增加,而养分的投入处于超营养化状态时,会导致优势菌种的过量生长,反而影响其它菌种的生长[31].除了微生物之间的营养竞争外,早、晚稻不同生长时间及气候条件也会对微生物产生影响.王国兵等[32]研究发现季节通过影响土壤微生物生存环境间接影响微生物群落且作用明显,这主要与植物生长规律、土壤水、肥、气、热条件等因素有关.杨宁等[33]对紫色土丘陵坡地微生物群落的季节变化进行了研究,发现夏季土壤微生物三大类菌群以及总量最高,其次为春季,秋季最低;夏季土壤微生物多样性显著高于春秋两季.本研究早稻生长期处于春夏季,随着气温逐渐回升,水稻代谢物和根系分泌物增多,同时富炭硅肥的施加也为土壤提供了丰富的营养物质,这为微生物营造了一个营养充足、竞争较小的良好环境,因此有利于提高土壤铁还原菌群落多样性;而晚稻生长期处于夏秋季,气温逐渐降低,水稻代谢物和根系分泌物减少,富炭硅肥的施加虽为土壤提供了营养物质,但营养有限使得微生物之间产生了营养竞争,导致优势菌种大量生长,其它菌种可能因无法获取营养物质使得其生长活性受到抑制,从而导致土壤铁还原菌群落多样性下降.
3.3 富炭硅肥施加处理对稻田土壤铁还原菌群落结构的影响
在稻田生态系统中,合理施肥可以促进土壤有机碳积累和植物生长,并驱动稻田土壤微生物群落结构演变[34].王伟华等[35]研究发现化肥配合秸秆还田可以显著改善土壤养分含量和土壤微生物量、微生物群落结构和活性;Kumar等[36]研究发现使用有机肥可以增加稻田土壤有机碳含量,同时提高微生物多样性.本研究在稻田土壤中施加富炭硅肥,其中含有硅和氮元素,可作为硅肥、氮肥使用来改善土壤肥力,改变土壤理化性质,在一定程度上影响稻田土壤铁还原菌的群落结构.
对于稻田土壤的菌群结构分布,Cui等[37]借助高通量测序手段研究发现,松嫩平原盐碱性水稻土根际的主要微生物群落为变形菌门(Proteobacteria)、酸杆菌门(Acidobacteria)、拟杆菌门(Bacteroidetes)和厚壁菌门(Firmicutes).本研究在富炭硅肥施加处理条件下从稻田土壤中鉴定出的菌门为变形菌门(Proteobacteria)、拟杆菌门(Bacteroidetes)、厚壁菌门(Firmicutes)和酸杆菌门(Acidobacteria),这一结果与前人一致.变形菌门在施加处理土壤中的相对丰度虽有不同程度的降低,但仍在土壤铁还原菌丰度中占有最大比重,其在修复土壤以及促进氮肥的利用等方面发挥着重要作用[38-39].由此看来,稻田土壤铁还原菌在门水平上群落结构差异不大,但从土壤铁还原菌属水平分布热图可知,在属水平下不同施加处理菌属差异较大,每种样品处理之间都有各自的优势菌属.因此,本研究在稻田土壤中施用富炭硅肥,在改变土壤理化性质,增强土壤肥力的同时也会作用于微生物,导致土壤中优势菌属的种类和相对丰度发生变化,从而进一步影响土壤铁还原菌群落结构和分布.
3.4 富炭硅肥施加处理条件下稻田土壤铁还原菌与环境因子的相关性
土壤微生物群落结构及多样性变化是多种因素共同作用的结果,如土壤类型、pH值、温度和湿度、作物根系分泌物、耕作方式、气候条件等都是影响土壤微生物的因子[40].土壤pH值决定了土壤的酸碱度,从而影响土壤中所能够生存的微生物数量与种类,pH值降低,土壤酸性增强刺激耐酸性细菌生长,抑制嗜碱性细菌的生命活动,反之亦然.Sheng等[41]研究发现,生物炭在酸性土壤中施用会导致富营养型微生物丰度增加,如拟杆菌门和芽单胞菌门;而在碱性土壤中会使贫养型微生物增加,如酸杆菌门.本研究检测发现早、晚稻土壤pH值呈酸性,施加富炭硅肥后,各处理土壤中拟杆菌门(Bacteroidetes)的相对丰度均有所升高,这一结果与前人研究一致.此外,研究发现在晚稻施加处理土壤中酸杆菌门(Acidobacteria)的相对丰度下降,甚至消失,这可能是因为酸杆菌门是嗜酸菌,而富炭硅肥中含有二氧化硅、氧化钙、氧化镁及生物炭等弱碱性物质,施加后必然会使土壤pH值有所升高,从而影响土壤中酸杆菌门的相对丰度.
本研究发现和的相对丰度与ST、WC呈正相关,说明温度和湿度对微生物的生命活动具有一定影响.有研究表明异化铁还原菌微生物适宜的环境温度有所不同,分为嗜低温菌、嗜温菌、嗜热菌和超嗜热菌这几种[42],所以温度的改变会影响土壤铁还原菌的种类及相对丰度.另外,早、晚稻3种施加处理均使土壤含水量较对照有所升高,土壤中的含水量直接关系到土壤空隙中的溶氧量.铁还原菌大多为厌氧或兼性厌氧菌[43],充足的水分不仅为微生物细胞的生长提供必要的水分条件,同时也为铁还原菌的生长提供一个无氧或少氧的微环境,从而促进铁还原菌的生长和繁殖.
3.5 富炭硅肥施加处理对稻田土壤的综合影响
有研究表明生物炭的施加能够改变土壤的某些物理结构和性质,对提高土壤肥力及作物对肥料的利用效率,增加作物产量等都有重要作用[44-45],另有研究发现炉渣富含硅、钙、镁等营养元素,能够为水稻的生长提供养分,促进产量增加[13,46].本研究所施用的富炭硅肥主要成分为生物炭和炉渣,由此初步推测,富炭硅肥对土壤理化性质及微生物群落的综合效应可能会对土壤肥力以及作物产量产生一定影响,这一推测需要进一步研究证明.
铁还原菌通常是具有异化Fe(Ⅲ)还原功能,并通过对有机物的分解从而获取其生长所需能量的厌氧或兼性厌氧微生物[43].根据获取能量途径的不同,可将铁还原菌分为两类[47]:专性铁还原菌,它们能够通过Fe(Ⅲ)还原从有机质或H2氧化中获取能量,包括地杆菌和厌氧粘细菌;兼性铁还原菌,它们在厌氧环境下代谢有机物生成有机酸或H2,并将少量电子传递给Fe(Ⅲ)使其还原,包括芽孢杆菌,其中厌氧粘细菌属()和芽孢杆菌属()是本研究稻田土壤中的优势铁还原菌属.富炭硅肥能够增加土壤养分和有机物含量,促进铁还原菌的生长,并为铁还原菌进行异化Fe(Ⅲ)还原提供能量.此外,富炭硅肥中还含有丰富的钙离子,能够与稻田生成的CO2发生反应,形成碳酸钙沉积于土壤中,进而减少气态碳的排放,有效提高稻田土壤碳的固持.基于此,未来可对不同施加量富炭硅肥处理条件下的土壤碳含量及温室气体排放量进行检测,以此来进一步研究富炭硅肥在稻田中的作用.
4 结论
4.1 施加富炭硅肥能够改变稻田土壤铁还原菌数量,有助于铁还原菌的生长和繁殖,其中600kg/hm2施加处理对铁还原菌的生长影响最为显著(<0.05).
4.2 3种施加处理均使晚稻拔节期土壤铁还原菌多样性有所下降,以300kg/hm2施加处理组多样性指数降低最为明显,较对照组降低了29.4%.
4.3 在早、晚稻土壤中共鉴定出5个菌门,其中变形菌门(Proteobacteria)、拟杆菌门(Bacteroidetes)和厚壁菌门(Firmicutes)的占比之和平均高达95%以上,是稻田土壤中的优势菌门.
4.4 施加富炭硅肥后,早稻拔节期土壤中拟杆菌属()的相对丰度显著提高(<0.05),而厌氧粘细菌属()的相对丰度则有所降低.
4.5 环境因子与稻田土壤铁还原菌的相对丰度具有相关性.的相对丰度与WC呈极显著负相关(<0.01),与BW呈极显著正相关(<0.01),与ST呈显著负相关(<0.05);的相对丰度与pH值呈显著正相关(<0.05);的相对丰度与ST呈显著正相关(<0.05).
[1] Lovley D R, Chapelle F H. Deep subsurface microbial processes [J]. Reviews of Geophysics, 1995,33(3):365-381.
[2] Sung Y, Fletcher K E, Ritalahti K M, et al.sp. nov. strain S Z, a novel metal-reducing and tetrachloroethene- dechlorinating bacterium [J]. Applied and Environmental Microbiology, 2006,72(4):2775-2782.
[3] Amos B K, Sung Y, Fletcher K E, et al. Detection and quantification of Geobacter lovleyi strain SZ: implications for bioremediation at tetrachloroethene and uranium-impacted sites [J]. Applied and Environmental Microbiology, 2007,73(21):6898-6904.
[4] Xu J X, Li X M, Sun G X, et al. Fate of labile organic carbon in paddy soil is regulated by microbial ferric iron reduction [J]. Environmental Science & Technology, 2019,53(15):8533-8542.
[5] Hori T, Müller A, Igarashi Y, et al. Identification of iron-reducing microorganisms in anoxic rice paddy soil by13C-acetate probing [J]. The ISME Journal, 2010,4(2):267-278.
[6] Chan K Y, Van Z L, Meszaros I, et al. Agronomic values of greenwaste biochar as a soil amendment [J]. Soil Research, 2008,45(8):629-634.
[7] 黄 超,刘丽君,章明奎.生物质炭对红壤性质和黑麦草生长的影响 [J]. 浙江大学学报, 2011,37(4):439-445. Huang C, Liu L J, Zhang M K. Effects of biochar on properties of red soil and ryegrass growth [J]. Journal of ZheJiang University, 2011, 37(4):439-445.
[8] Van Z L, Kimber S, Morris S, et al. Effects of biochar from slow pyrolysis of papermill waste on agronomic performance and soil fertility [J]. Plant and Soil, 2010,327(1/2):235-246.
[9] 卜晓莉,薛建辉.生物炭对土壤生境及植物生长影响的研究进展 [J]. 生态环境学报, 2014,23(3):535-540. Bu X L, Xue J H. Biochar effects on soil habitat and plant growth:A review [J]. Ecology and Environmental Sciences, 2014,23(3):535-540.
[10] 赵学通,包 立,康宏宇,等.秸秆生物炭对亚热带葡萄园土壤性质的影响 [J]. 中国农学通报, 2015,31(6):104-108. Zhao X T, Bao L, Kang H Y, et al. Straw biochar influence on soil properties quality for subtropical vineyards [J]. Chinese Agricultural Science Bulletin, 2015,31(6):104-108.
[11] Gorovtsov A, Minkina T, Mandzhieva S, et al. The mechanisms of biochar interactions with microorganisms in soil [J]. Environmental Geochemistry and Health, 2019,42(8):2495-2518.
[12] Wang W Q, Lai D Y F, Li S C, et al. Steel slag amendment reduces methane emission and increases rice productivity in subtropical paddy fields in China [J]. Wetlands Ecology and Management, 2014,22(6): 683-691.
[13] Ali M A, Oh J H, Kim P J, et al. Evaluation of silicate iron slag amendment on reducing methane emission from flood water rice farming [J]. Agriculture Ecosystems and Environment, 2008,128(1): 21-26.
[14] 王妙莹,许旭萍,王维奇,等.炉渣与生物炭施加对稻田温室气体排放及其相关微生物影响 [J]. 环境科学学报, 2017,37(3):1046-1056. Wang M Y, Xu X P, Wang W Q, et al. Effect of slag and biochar amendment on greenhouse gases emissions and related microorganisms in paddy fields [J]. Acta Scientiae Circumstantiae, 2017,37(3):1046-1056.
[15] Wang W Q, Lai D Y F, Abid A A, et al. Effects of steel slag and biochar incorporation on active soil organic carbon pools in a subtropical paddy field [J]. Agronomy, 2018,8(8):135.
[16] 王晓彤,许旭萍,王维奇.炉渣与生物炭施加对稻田土壤铁还原菌群落结构及甲烷排放影响 [J]. 中国环境科学, 2019,39(6):2495-2505.Wang X T, Xu X P, Wang W Q, Slag and biochar application on community structure and methane emission of iron-reducing bacteria in paddy soil [J]. China Environmental Science, 2019,39(6): 2495-2505.
[17] 马永跃,仝 川,王维奇,等.浮萍对福州平原稻田CH4和N2O排放的影响分析 [J]. 中国生态农业学报, 2012,20(6):723-727. Ma Y Y, Tong C, Wang W Q, et al. Effect ofon CH4and N2O emissions in Fuzhou Plain paddy fields [J]. Chinese Journal of Eco Agriculture, 2012,20(6):723-727.
[18] Wang W Q, Lai D Y F, Wang C, et al.Effects of inorganic amendments, rice cultivars and cultivation methods on greenhouse gas emissions and rice productivity in a subtropical paddy field [J]. Ecological Engineering, 2016,95:770-778.
[19] 鲁如坤.土壤农业化学分析方法[M]. 北京:中国农业科技出版社, 1999. Lu R K. Soil agricultural chemical analysis method [M]. Beijing: China Agricultural Science and Technology Press, 1999.
[20] 陈 哲,陈春兰,秦红灵,等.化肥对稻田土壤细菌多样性及硝化、反硝化功能菌组成的影响 [J]. 生态学报, 2009,29(11):6142-6147. Chen Z, Chen C L, Qin H L, et al. Effect of fertilization on bacterial community,genetic diversity ofandgenes in paddy soil [J]. Acta Ecologica Sinica, 2009,29(11):6142-6147.
[21] Lehmann J, Da Silva J P, Steiner C, et al. Nutrient availability and leaching in an archaeological Anthrosol and a Ferralsol of the Central Amazon basin: fetilizer, manure and charcoal amendments [J]. Plant and Soil, 2003,249(2):343-357.
[22] Topoliantz S, Ponge J F, Ballof S. Manioc peel and charcoal: a potential organic amendment for sustainable soil fertility in the tropics [J]. Biology and Fertility of Soils, 2005,41(1):15-21.
[23] Ali M A, Sattar M A, Islam M N, et al. Integrated effects of organic, inorganic and biological amendments on methane emission, soil quality and rice productivity in irrigated paddy ecosystem of Bangladesh: field study of two consecutive rice growing seasons [J]. Plant and Soil, 2014,378(1):239-252.
[24] Zheng J, Chen J, Pan G, et al. Biochar decreased microbial metabolic quotient and shifted community composition four years after a single incorporation in a slightly acid rice paddy from southwest China [J]. Science of The Total Environment, 2016,571:206-217.
[25] Ahn C, Peralta R M. Soil bacterial community structure and physicochemical properties in mitigation wetlands created in the Piedmont region of Virginia (USA) [J]. Ecological Engineering, 2009,35(7):1036-1042.
[26] Stewart C E, Zheng J Y, Botte J, et al. Co-generated fast pyrolysis biochar mitigates green-house gas emissions and increases carbon sequestration in temperate soils [J]. GCB Bioenergy, 2013,5(2): 153-164.
[27] 孔丝纺,姚兴成,张江勇,等.生物质炭的特性及其应用的研究进展 [J]. 生态环境学报, 2015,24(4):716-723. Kong S F, Yao X C, Zhang J Y, et al. Review of characteristics of biochar and research progress of its applications [J]. Ecology and Environmental Sciences, 2015,24(4):716-723.
[28] Prayogo C, Jones J E, Baeyens J, et al. Impact of biochar on mineralisation of C and N from soil and willow litter and its relationship with microbial community biomass and structure [J]. Biology and Fertility of Soils, 2014,50(4):695-702.
[29] Xu H, Wang X, Li H, et al. Biochar impacts soil microbial community composition and nitrogen cycling in an acidic soil planted with rape [J]. Environmental Science & Technology, 2014,48(16):9391-9399.
[30] 王 超,郭坚华,席运官,等.拮抗细菌在植物病害生物防治中应用的研究进展 [J]. 江苏农业科学, 2017,45(18):1-6. Wang C, Guo J H, Xi Y G, et al. Advances in the application of antagonistic bacteria in biological control of plant diseases [J]. Jiangsu Agricultural Sciences, 2017,45(18):1-6.
[31] 刘 明,李忠佩,路 磊,等.添加不同养分培养下水稻土微生物呼吸和群落功能多样性变化 [J]. 中国农业科学, 2009,42(3):1108-1115. Liu M, Li Z P, Lu L, et al. Changes in soil respiration and microbial functional diversity of paddy soil under different fertilizer amendments [J]. Scientia Agricultura Sinica, 2009,42(3):1108-1115.
[32] 王国兵,阮宏华,唐燕飞,等.森林土壤微生物生物量动态变化研究进展 [J]. 安徽农业大学学报, 2009,36(1):100-104. Wang G B, Ruan H H, Tang Y F, et al. A review on the dynamics of soil microbial biomass in forest ecosystems [J]. Journal of Anhui Agricultural University, 2009,36(1):100-104.
[33] 杨 宁,杨满元,雷玉兰,等.紫色土丘陵坡地土壤微生物群落的季节变化 [J]. 生态环境学报, 2015,24(1):34-40. Yang N, Yang M Y, Lei Y L, et al. Seasonal variations of soil microbial communities on sloping-land with purple soils [J]. Ecology and Environmental Sciences, 2015,24(1):34-40.
[34] Cruz A F, Hamel C, Hanson K, et al. Thirty-seven years of soil nitrogen and phosphorus fertility management shapes the structure and function of the soil microbial community in a Brown Chernozem [J]. Plant and Soil, 2009,315(1/2):173-184.
[35] 王伟华,刘 毅,唐海明,等.长期施肥对稻田土壤微生物量、群落结构和活性的影响 [J]. 环境科学, 2018,39(1):430-437. Wang W H, Liu Y, Tang H M, et al. Effects of long-term fertilization regimes on microbial biomass,community structure and activity in a paddy soil [J]. Environmental Science, 2018,39(1):430-437.
[36] Kumar U, Shahid M, Tripathi R, et al. Variation of functional diversity of soil microbial community in sub-humid tropical rice-rice cropping system under long-term organic and inorganic fertilization [J]. Ecological Indicators, 2017,73:536-543.
[37] Cui J, Li Y, Wang C, et al. Characteristics of the rhizosphere bacterial community across different cultivation years in saline-alkaline paddy soils of Songnen Plain of China [J]. Canadian Journal of Microbiology, 2018,64(12):925-936.
[38] 张 晶,林先贵,刘魏魏,等.土壤微生物群落对多环芳烃污染土壤生物修复过程的响应 [J]. 环境科学, 2012,33(8):2825-2831. Zhang J, Lin X G, Liu W W, et al. Response of soil microbial community to the bioremediation of soil contaminated with PAHs [J]. Environmental Science, 2012,33(8):2825-2831.
[39] 徐鹏霞,韩丽丽,贺纪正,等.非共生生物固氮微生物分子生态学研究进展 [J]. 应用生态学报, 2017,28(10):3440-3450. Xu P X, Han L L, He J Z, et al. Research advance on molecular ecology of asymbiotic nitrogen fixation microbes [J]. Chinese Journal of Applied Ecology, 2017,28(10):3440-3450.
[40] 潘孝晨,唐海明,肖小平,等.不同土壤耕作方式下稻田土壤微生物多样性研究进展 [J]. 中国农学通报, 2019,35(23):51-57. Pan X C, Tang H M, Xiao X P, et al. Paddy soil microbial diversity under tillage practices: research progress [J]. Chinese Agricultural Science Bulletin, 2019,35(23):51-57.
[41] Sheng Y, Zhu L. Biochar alters microbial community and carbon sequestration potential across different soil pH [J]. Science of the Total Environment, 2018,622-623:1391-1399.
[42] 王媛媛.磷酸盐对水稻土中异化铁还原菌丰度和群落结构的影响 [D]. 咸阳:西北农林科技大学, 2018. Wang Y Y. Effect of phosphate on abundance and community structure of dissimilatory iron-reducing in paddy soil [D]. Xianyang: Northwest Agriculture and Forestry University, 2018.
[43] 陈 蕾,张洪霞,李莹,等.微生物在地球化学铁循环过程中的作用 [J]. 中国科学:生命科学, 2016,46(9):1069-1078. Chen L, Zhang H X, Li Y, et al. The role of microorganisms in the geochemical iron cycle [J]. Scientia Sinica Vitae, 2016,46(9):1069- 1078.
[44] Glaser B, Lehmann J, Zech W, et al. Ameliorating physical and chemical properties of highly weathered soils in the tropics with charcoal-a review [J]. Biology and Fertility of Soils, 2002,35(4):219-230.
[45] 张伟明.生物炭的理化性质及其在作物生产上的应用 [D]. 沈阳:沈阳农业大学, 2012. Zhang W M. Physical and chemical properties of biochar and its application in crop production [D]. Shenyang: Shenyang Agricultural University, 2012.
[46] Ali M A, Lee C H, Kim P J, et al. Effect of silicate fertilizer on reducing methane emission during rice cultivation [J]. Biology and Fertility of Soils, 2008,44(4):597-604.
[47] 林 颖.水稻根际土壤铁还原微生物的丰度及多样性变化特征 [D]. 杨凌:西北农林科技大学, 2019. Lin Y. Changing characteristics of iron-reducing microbial abundance and diversity in paddy rhizosphere soil [D]. Yangling: Northwest Agriculture and Forestry University, 2019.
Effects of carbon-enrich silicon fertilizer on the community characteristics of iron-reducing bacteria in paddy fields.
LIN Mei-fen1, ZHENG Yi1*, WANG Xiao-tong1, XU Xu-ping1**, WANG Wei-qi2,3
(1.College of Life Science, Fujian Normal University, Fuzhou 350117, China;2.Institute of Geography, Fujian Normal University, Fuzhou 350007, China;3.Key Laboratory of Humid Sub-tropical Eco-geographical Process of Ministry of Education, Fujian Normal University, Fuzhou 350007, China)., 2021,41(4):1778~1789
In order to explore the relative abundance, diversity and community structure of iron-reducing bacteria (FeRB) in paddy fields of Fuzhou Plain, by setting up the control group and the treatment groups with three dosage levels (300, 600 and 900kg/hm2) of carbon-enrich silicon fertilizer (CESF). The results showed that the application of CESF facilitated the growth and reproduction of FeRB, among which 600kg/hm2treatment had the most significant impact on the growth of FeRB (<0.05). According to the Shannon index, the diversity of FeRB was decreased by the three treatment groups during the jointing stage of late rice. The diversity index of the 300kg/hm2treatment group decreased most significantly, which was 29.4% lower than the control group. In the jointing stage of early and late rice, a total of 5 phyla have been identified in the soils. The total proportion of Proteobacteria, Bacteroidetes and Firmicutes was over 95% on average, and they were the dominant bacteria phyla in paddy fields.After application of CESF, the relative abundance ofin the soil at early rice jointing stage was significantly increased (<0.05), while that ofwas decreased. In addition, environmental factors were correlated with relative abundance of FeRB in the soils. The relative abundance ofwas significantly and positively correlated with soil pH (<0.05). The relative abundance ofwas significantly and positively correlated with soil temperature (<0.05). The above studies concluded that diversity and community structure of FeRB were significantly affected by CESF in paddy fields.
carbon-enrich silicon fertilizer;iron-reducing bacteria;diversity;community structure;paddy field
X53
A
1000-6923(2021)04-1778-12
林美芬(1995-),女,福建泉州人,福建师范大学硕士研究生,主要从事环境微生物研究.
2020-08-28
国家自然科学基金资助项目(42077086;41571287);福建省公益类科研院所基本科研专项(2018R1034-1)
* 责任作者, 郑 毅, 副教授,eyizheng@fjnu.edu.cn; 许旭萍, 教授, xuping@finu.edu.cn
